7: Стратегії синтезу лонгфолена
- Page ID
- 24364
Синтез Лонгифолена протягом декількох десятиліть утримує захоплення синтетичних хіміків-органіків. Оскільки з'єднання було доступним в чистому вигляді з природних джерел в достатній кількості, захоплення було чисто академічним. Під час досліджень з'ясування структури було помічено, що ця мостова структура зазнала безліч міграційних реакцій. Ці перестановки викликали інтерес як з теоретичної, так і з практичної точки зору. Концепція «відключення» та «ретросинтезу», що розвивалася приблизно в 1960 році, призвела до розвитку логіки в органічному синтезі протягом цього періоду. Структура Longifolene була щасливим розвідувальним майданчиком для тих великих магістрів, які були залучені до цих розробок. З цієї причини синтез Лонгіфолену був тісно пов'язаний з цими розробками. Аналізуючи такі структури, Корі запропонував кілька «стратегічних роз'єднань облігацій»
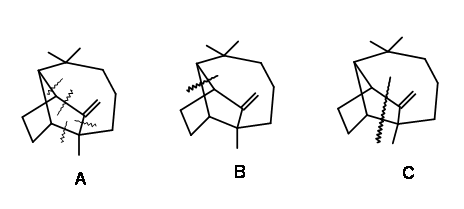
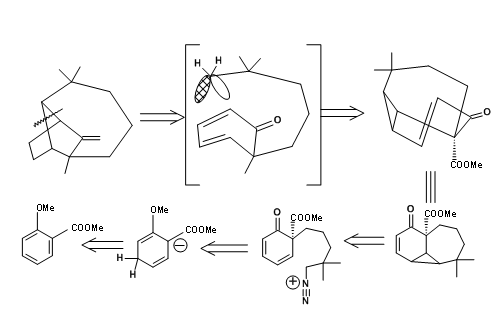
для логічних підходів до синтезу (рис. 7.1). Зверніть увагу, що ці пропозиції мали на меті надати керівні принципи і тому не повинні обмежувати будь-які подальші нововведення. Далі було зазначено, що будь-яке з цих відключень може призвести до декількох шляхів для будівництва синтетичних дерев. Для прикладу розглянемо одне з таких роз'єднань у зв'язку «а», показане на рис. 7.2. Це може кинути відкриті чотири гілки на синтетичне дерево. З них Корі вперше вибрав стратегію Майкла, оскільки одна така циклізація вже була відома в хімії Сантоніна.
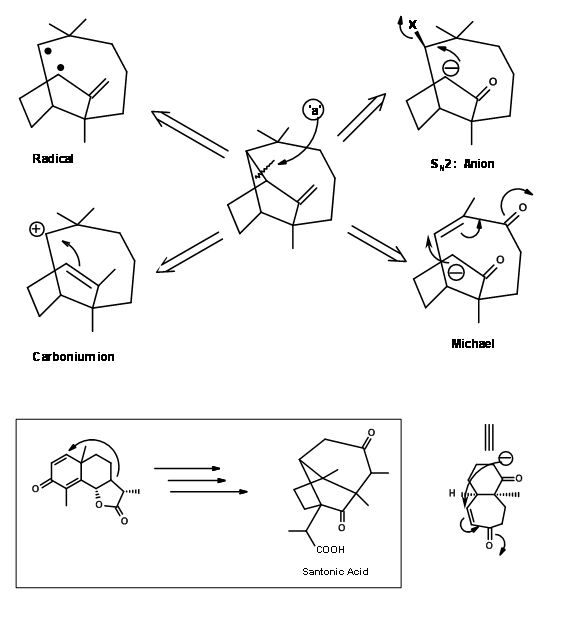
Виконання цієї концепції Корі (J.Am. Хім. Соц., 83, 2151 (1961); там же, 86, 478 (1964)) показано на рис. 7.3.
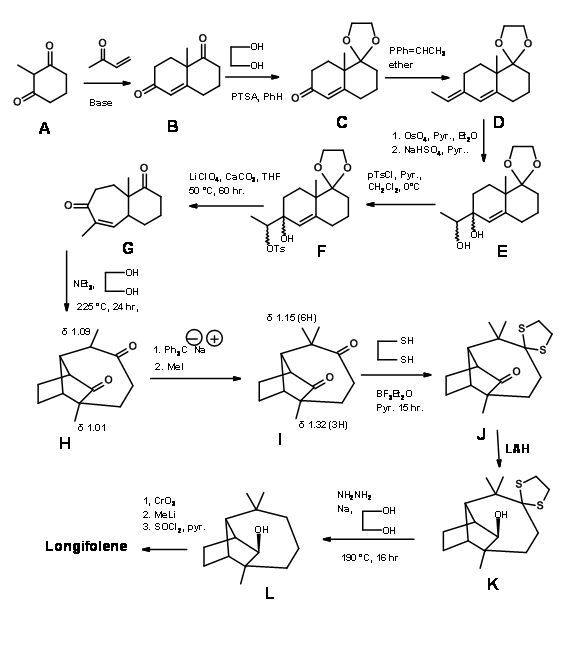
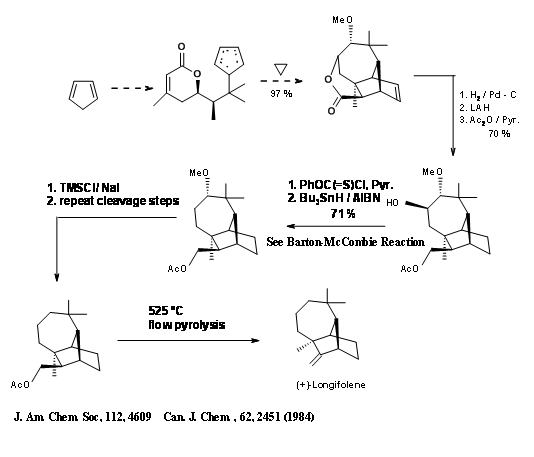
L.W. Oppolzer та ін., створили кільцеву систему лонгіфолену шляхом перетворення перестановки. Він використав реакцію Де Майо, яка є фотоциклізація - ретроальдол послідовність показана нижче (рис. 7.4).
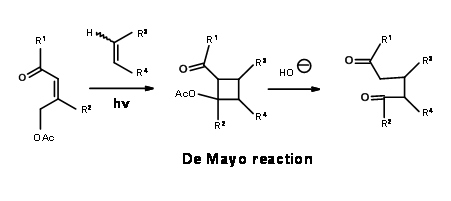
Як показано на синтетичній схемі рис. 7.5, реакція циклоприєднання [2+2] на С дала D, яка піддавала компоненти ретроальдолу після гідрогенолізу. Ще однією корисною особливістю цього синтезу є реакція утилізації гідрогенолізу на циклопропан для впливу гем-диметильної групи. Хіральний вихідний матеріал А дав (+) -Лонгіфолен в 25% загального виходу.
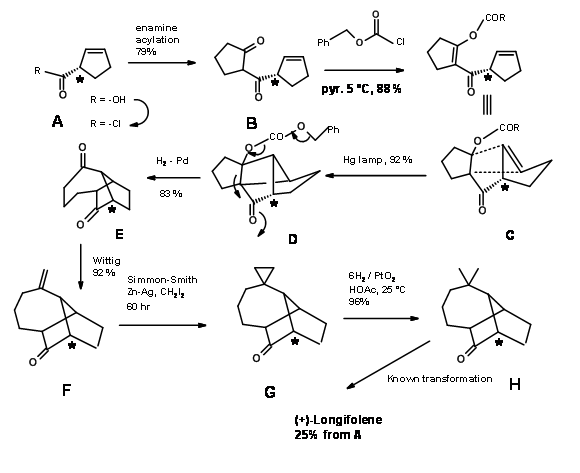
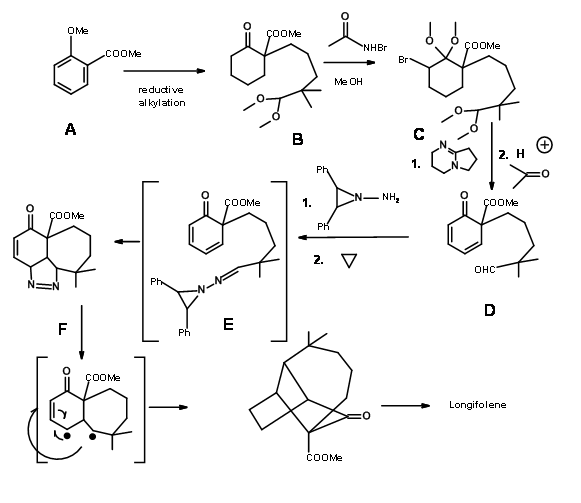
Про стратегію вставки карбену повідомили А.Г. Schutz та ін., (J. Org. Хім., 50, 915 (1985)). Ретроаналіз показаний на малюнку 7.6.
Синтетична схема показана на малюнку 7.7.
Стратегія Дільса-Альдера, зазначена у вступі до цього розділу про Лонгіфолен, була продемонстрована Fallis et.al., (рис. 7.8)
Ще одна стратегія Дільса-Альдера прийшла від Хо і Лю (рис. 7.9). Зверніть увагу на використання екзоциклічного олефіну шляхом перетворення цієї одиниці в необхідний семичленний кільцевий фрагмент.
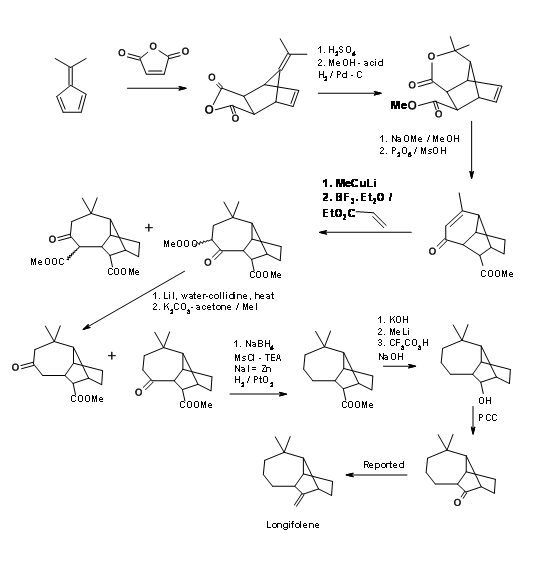
Стратегія катіонної циклізації для скелета Longifolene, про яку повідомляє школа Джонсона, має деякі цікаві особливості. На малюнку 7.10 зображена реакція циклізації, яка утворює ключовий крок в цій схемі.
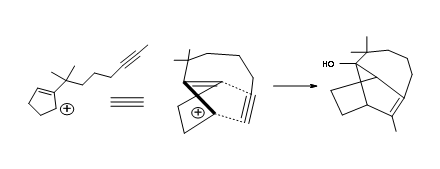
Детальний синтетичний план показаний на малюнку 7.11.
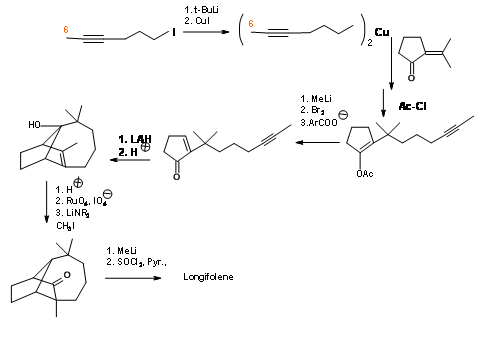
Зверніть увагу, що ця циклізація все ще залишає метильну групу на неправильному вуглеці. Небажана група —OH була видалена за допомогою комплексної реакції перенесення гідридів Льюїса. Кислота каталізована ізомеризація подвійного зв'язку супроводжується послідовністю гідроксилювання- окислення, щоб викрити карбонільну групу. Потім четвертинна метильна група була введена через., енолат. Екзоциклічний метилен був повторно введений для завершення синтезу.