6: Стратегії в (-) -синтезі ментолу
- Page ID
- 24342
(-) -Ментол є одним з найважливіших парфумерів/ароматизаторів хімічної речовини, широко використовується в фармацевтиці, косметиці, зубних пастах, жувальних гумках та туалетних приладдях. За оцінками загального виробництва близько 20,000 m.tons, природний ментол припадає приблизно 13 m.tons, решта походить від синтетичних джерел. Природне джерело - масло Mentha Arvensis - будучи нестабільним через залежність від мусону, попит на синтетичний ментол зростає. Виробничі процеси, обрані для обговорення тут, демонструють три важливі методології, що використовуються в промисловості для синтезу хіральних сполук. Короткий зміст деяких відомих процесів наведено на малюнку 6.1.
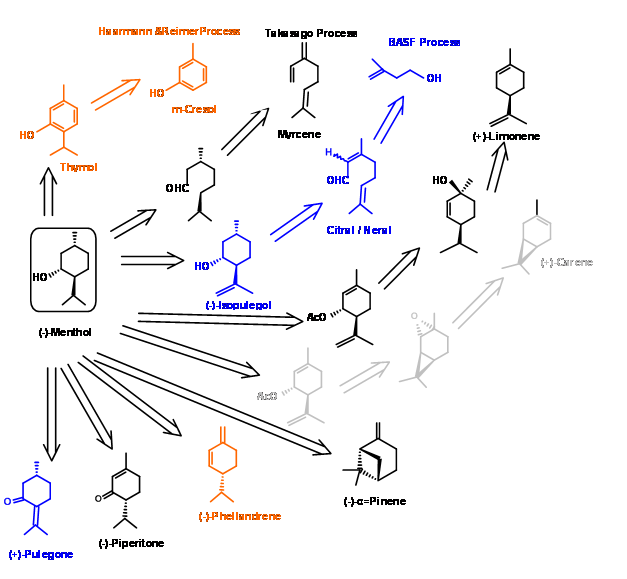
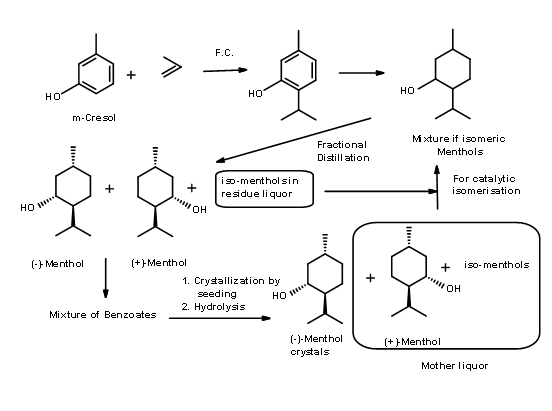
Процес Symrise (раніше відомий як Haarmann & Reimer процес) (Патент США 3,943,181 (Mar 9 1976)) - У цьому процесі (рис. 6.2), тимол синтезується з м-крезолу. Каталітичне гідрування дало суміш ментолів, з яких ментоли вперше були отримані у вигляді рацемічної суміші шляхом ретельної фракційної дистиляції. Залишкову суміш епімерізували для підвищення вмісту рацемічного ментолу за допомогою запатентованого каталітичного процесу. Проривом в процесі є дозвіл бензоатного ефіру рацемата шляхом перекристалізації шляхом процесу засівання концентрату одним чистим епімером. Матовий спирт, який зараз був багатий (+) ізомером, був перероблений, повернувши його назад до циклу дистиляції. При цьому загальний вихід (-) -ментолу становить близько 90%.
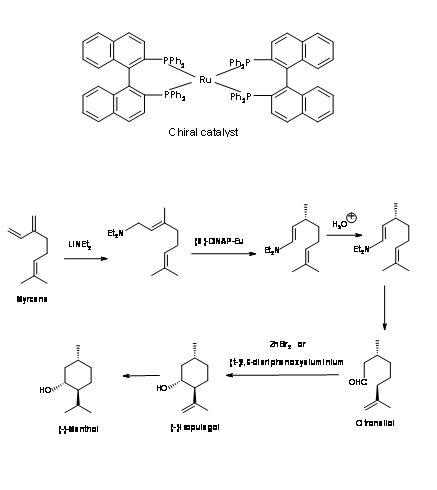
Процес Takasago: У цьому процесі (S) -DINAP каталізована ізомеризація є ключовим кроком Рис 6.3. Додавання аміду літію до мірцену дало додаткову сполуку, яка була ізомеризована за допомогою каталізатора хірального рутенію. Гідроліз одержуваного енаміну дав альдегід цитронеллал у високій енантіомерной чистоті. Це було циклічним каталізатором Льюїса. Каталітичне відновлення олефіну дало (-) -ментол1.
Процес BASF: BASF вже створив процеси синтезу серії терпенів, починаючи з бутену. Зважаючи на високий попит на (-) -ментол, вони розширили ланцюжок продуктів до (-) -ментолу. Схема синтезу продуктового ланцюжка представлена на малюнку 6.4.
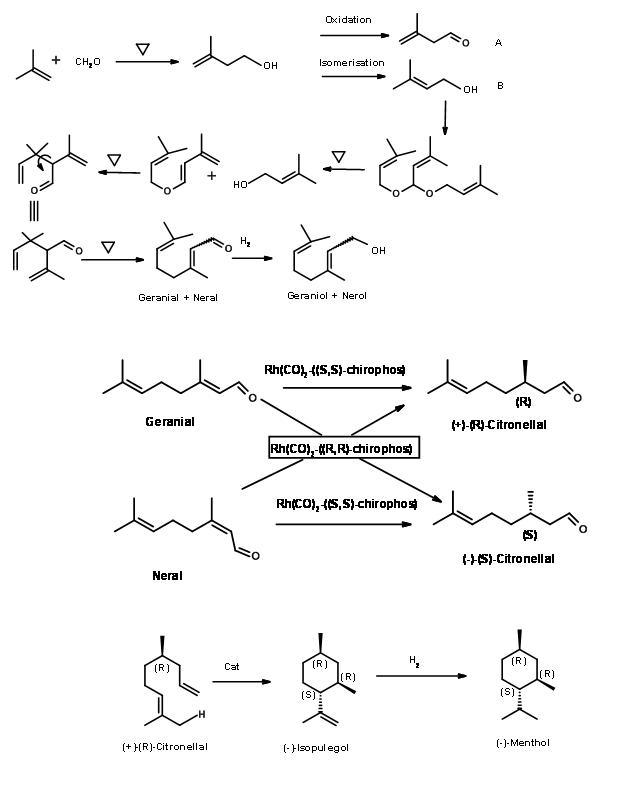
Рис 6.4
Розширення ланцюга вартості цитралів до (+) -Цитронеллаль, (-) -Ізопулегол і, нарешті, до (-) -Ментол дав ряд продуктів з доданою вартістю. Зауважимо, що ці процеси скористалися розвитком каталітичних процесів в останні роки. Деталі каталізаторів не оприлюднюються.
Посилання
- Підготовка цитралю, патент США 4288636 (09/08/1981)
- Спосіб виробництва ментолу, патент США 7709688 (05/04/2010);
- Енантіоселективне гідрування аллілових і гомолільних спиртів, J. Am. Хім. Соц., 1987, 109 (5), с. 1596—1597
- Норберт; Спосіб виробництва ізопулеголу, патент США 7550633 (23.06.2009);
- Diarylphenoxy сполуки алюмінію, патент США 7608742 (10/27/2009)
- БЕЗПЕРЕРВНИЙ ПРОЦЕС ОТРИМАННЯ МЕНТОЛУ В ЧИСТОМУ АБО ЗБАГАЧЕНОМУ ВИГЛЯДІ, патентна заявка ВОІВ WO/2009/033870 (03/19/2009).
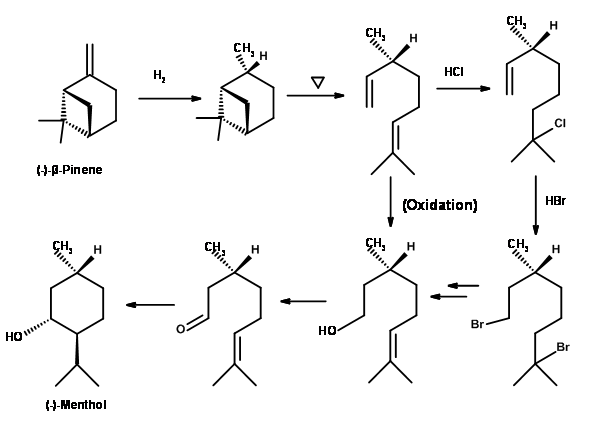
(-) -Ментол від (+) -Лімонен (рис. 6.5): Лимонен рясно доступний з шкірки цитрусових. На селективному каталітичному відновленні з Ra-Ni його можна було зменшити до (+) -1-ментену, який при епоксидації та гідролізі дав (+) -1-гідроксинеокарвоментол. Ацилювання з подальшим піролізом дало (-) -транс-мент-2-ен-1-ол в якості основного продукту. Сирий продукт був сольволізований, щоб отримати суміш піперитилактатів як аллільних продуктів міграції. Сирий продукт переганяли на цьому етапі для розділення цис- і транс-піперитолів. Незначний продукт скорочення кільця був корисним як проміжний продукт парфумів в іншому місці. Остаточне зниження було досягнуто шляхом Н2/Pd-C, щоб дати 75% виходу (-) -ментолу після фракційної дистиляції.
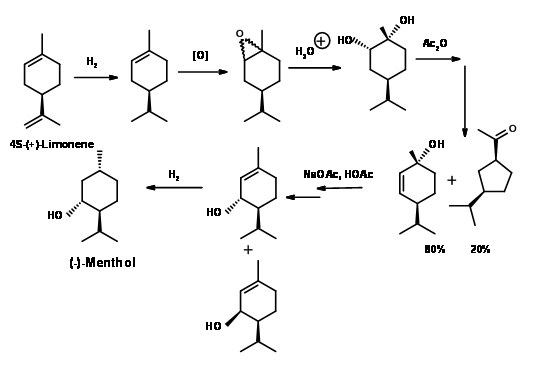
(-) -Ментол від (+) -Пулегон (рис. 6.6): Вихідний матеріал має правильну конфігурацію при С1. Проблема полягає в тому, щоб зменшити подвійний зв'язок енантіоселективно. Подвійний зв'язок спочатку відновлюється каталітичним гідруванням, щоб отримати суміш (-) -Ментон і (+) -Ізоментон. Всеекваторіальна конфігурація (-) -ментолу найкраще досягається шляхом розчинення відновлення металу. Проміжний проміжний елемент енолату протонується до термодинамічно стабільного (-) -ментолу.
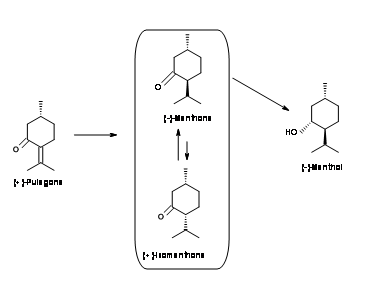
(-) -Ментол від (-) -Піперитон (рис. 6.7): Придивіться до стереохімії в асиметричному центрі (-) -піперитона. Ізопропіл знаходиться в неправильній конфігурації для (-) -ментону. Завдання тут полягає в тому, що (1) ізомеризувати цей центр і (2) енантіоселективно зменшити подвійний зв'язок. Всі спроби виробництва (-) -ментолу виробляють тільки суміші, як показано на малюнку 6.7. Звідси цей процес не був дуже успішним.
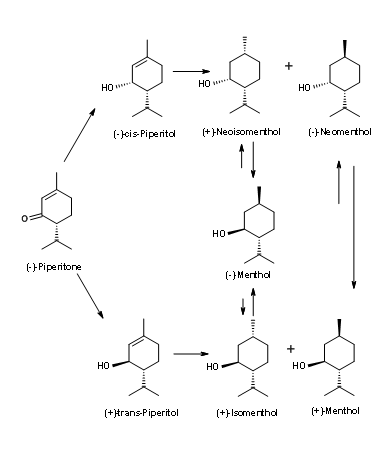
(-) -Ментол з (-) -β-пінен (рис. 6.8): (-) -β-пінен пропонує хороший шлях, оскільки необхідні структурні особливості присутні і доступні в достатній оптичній чистоті. Гідрування (-) -β-пінен дав CIS-пінан є основним продуктом. На піролізі напружена мостова кільцева система розщеплюється для отримання оптично чистого 2,6-диметил-2,7-октадієну. Він був перетворений в (+) -цитронеллол в хороших врожаях шляхом прямого окислення. По черзі більш заміщений олефін спочатку піддавався марковникову добавці HCl з подальшим антимарковніковим додаванням HBr. Реакція сольволізу забезпечується сумішшю цитронеллолів. Каталітичне окислення спирту забезпечується (+) -Цитронеллал. Це може бути перетворено на (-) -ментол відомими процедурами. Однак продукт був забруднений слідовими кількостями (+) -ментолу, що виникає з транс-пінану, що генерується на першому кроці.
(-) -Ментол від (+) -Δ-3-карен (рис. 6.9): Δ-3-карен - ще один хіральний синтон, який має необхідні структурні особливості, щоб служити вихідним матеріалом для (-) -ментолу. Каталітична ізомеризація Δ-3-карену дала (+) -Δ-2-карен. Було досліджено два різні маршрути. У першому маршруті (+) -Δ-2-Carene піролізували для розщеплення циклопропанового кільця. Отриманий дієн мав правильну стереохімію при С1 і С4. Останнє не мало значення, оскільки ця асиметрія втрачається незабаром і регенерується в процесі. Лікування некон'югованого дієну HCl та дегідрогалогенування призвели до кон'югованого дієну. Додавання HCl призвело до утворення аллілхлориду. Солволіз з оцтовою кислотою-ацетатом натрію забезпечив зміщення S N 2 ', що спричиняє аллілову перестановку. Отримані ацетати піперитолу дали (+) -цис і (-) -транс-піперитоли, які можна було б фракційно переганяти. Чисті (-) -транс-піперитоли дають (-) -ментол при гідруванні.
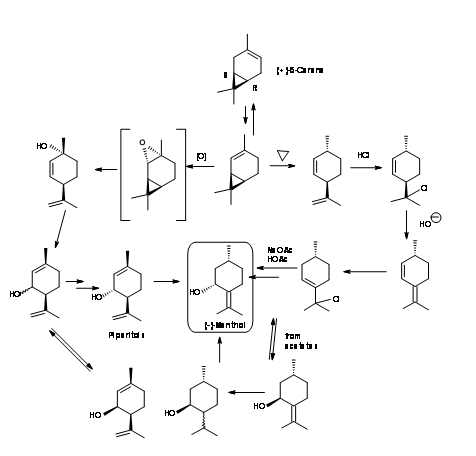
У другому шляху (+) -Δ-2-карена епоксидизували з отриманням (+) -цис-2,8-р-ментадіенолу безпосередньо. При буферизації сумішшю мурашиної кислоти з оцтовою кислотою сталася аллілова перебудова з отриманням суміші форміату і ацетату ефірів піперитилу. Відповідні спирти можна було б фракційно переганяти. Цис-ізомер може бути ізомеризований для поліпшення виходу чистого (-) -транс-піперитолу. Гідрогенація дала (-) -ментол.
Висновок: У цьому розділі ми зосередилися на розробці комерційно вигідних маршрутів для (-) -ментолу. Відзначимо, як сучасні реагенти впливали на промислові процеси.
Посилання
- Leffingwell, J.C. & R.E. Shackelford, Лаево-ментол - синтези та органолептичні властивості, Косметика і парфумерія, 89 (6), 69-89, 1974
- Хопп, Р., Ментол: його витоки, хімія, фізіологічні та токсикологічні властивості, Rec. Адв. тютюнознавство, Том 19, 3-46 (1993).