5: Стратегії диспарлюрного синтезу
- Page ID
- 24338
Циганська міль (Porthytria dispar) - серйозний шкідник лісів. У 1976 B.A. Bierl et.al., (Наука, 170,88 (1970)) виділили статевий феромон з екстрактів 78 000 кінчиків останніх двох черевних сегментів жіночої молі. Будова була закріплена як 5.1. Пізніше молекула-попередник — цис-олефін також була виділена з того ж джерела.
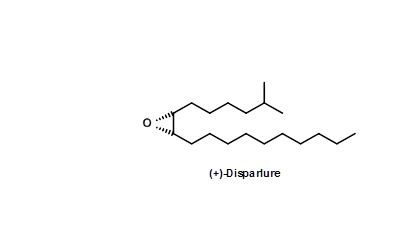
Лабораторний біоаналіз із синтетичних матеріалів показав, що всього 2 пг 5.1 було достатньо для виявлення біоактивності. Оскільки доступність молекули з природних джерел була дуже незначною навіть для проблем з'ясування структури та вивчення її передбачуваної ролі як молекули боротьби з шкідниками, був великий інтерес до ефективного синтезу цієї молекули. Деякі відключення для цієї простої молекули зображені на малюнку 5.2.
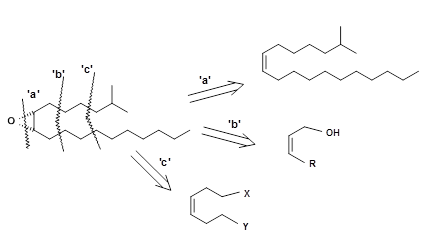
Епоксиди можуть бути виготовлені з відповідних олефінів. При цьому олефіном повинен бути Z-олефін. Коли синтез таких олефінів не є стереоспецифічним, пряме епоксидування з використанням пероксидів дасть суміш α- та β-епоксиду з обох ізомерних олефінів. Щоб уникнути подібних сумішей на останньому етапі, слід вводити селективність на ранній стадії синтезу.
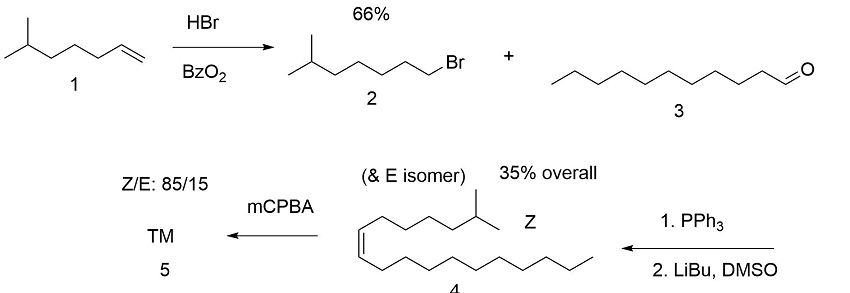
Перша спроба була спрямована на синтез відповідного олефіну та епоксидування (B.A. Bierl et.al., (Science, 170, 88 (1970)). Стереоселективність була незадовільною (рис. 5.3). Це зумовило необхідність в великому очищенні.
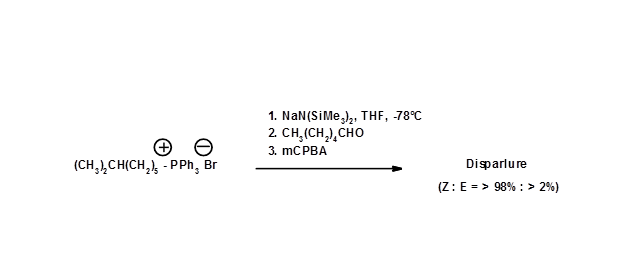
Співвідношення цис-/ транс-ізомерів у реакції олефінації Віттіга може бути змінено модифікацією реагентів та параметрів реакції. Г.Т. Бестман та ін., (Хім. Ber., 109, 3375 (1976)) змогли поліпшити синтез шляхом зміни умов реакції Віттіга (рис. 5.4).
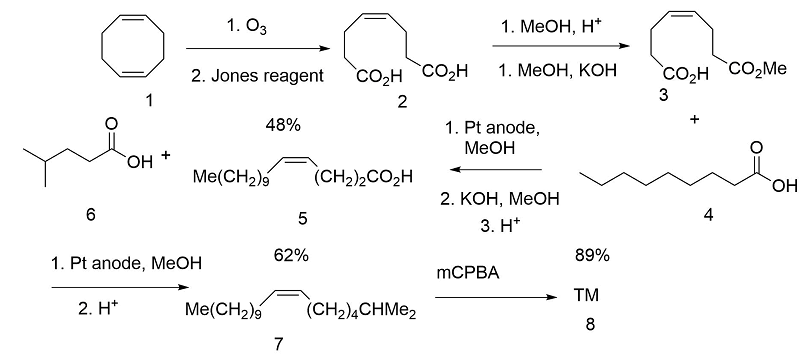
Чисті цис-олефіни можуть бути отримані шляхом каталітичного відновлення ацетиленів (Angew. Хім., Інт. Ред., 11, 60 (1972). Клуненберг та ін., (Анжев. Хім., Інт. Ред., 17, 47 (1978) скористалися цис-олефіновими фрагментами в 1,5-циклооктадієні шляхом селективного окислення одного подвійного зв'язку. Ланцюги були введені послідовним електролізом Кольбе (рис. 5.5).
Синтез оптично чистих диспарлюрів
Епоксидування олефінів дає лише рацемати, якщо етап епоксидування не передбачає асиметричного синтезу. Синтез чистих (+) - і (-) - ізомерів може бути досягнутий трьома способами.
- Дозвіл рацемата: Це може бути методом вибору, коли обидва енантіомери необхідні для досліджень SAR. Всі антиподи сполуки будуть доступні через ідентичні синтетичні шляхи.
- Асиметричний синтез відповідних проміжних продуктів: Коли бажаний лише один з антиподів, цей процес забезпечує широкий спектр синтетичних можливостей для дослідження. Коли мішенями є велика кількість тісно пов'язаних сполук, цей метод є кращим вибором.
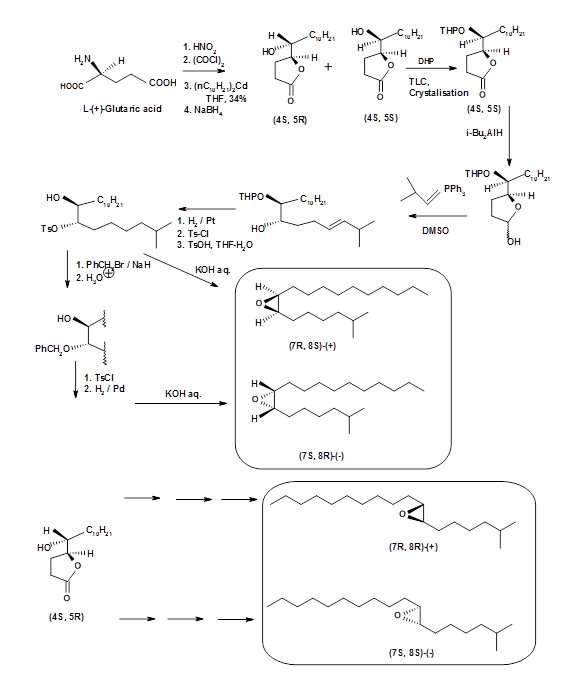
- Пошук хірального проміжного продукту з відповідного хірального пулу: Після того, як хіральна мета зрозуміла, це може бути методом вибору. У випадку з Disparlure кількість, яку можна було виділити від циганської молі, була настільки маленькою, що навіть оптичне обертання неможливо було визначити. Кілька працівників повідомили про синтез оптично чистих (+) - і (-) - Disparlure та його структурних ізомерів. Перша доповідь надійшла від S. Iwaki та ін., (J. Am. Хім. Соц., 96, 7842 (1974)). Вони почали з L- (+) -глутамінової кислоти і дозволили проміжні діастереомерні спирт-лактони методом повторної кристалізації (рис. 5.6). Їх синтез не був стереоспецифічним. Дослідження SAR показали, що цис- (+) - ізомер був найбільш ефективним.
Морі та ін., (Тет. Lett., 3953 (1976); Тетраедр, 53, 833 (1979)) незабаром послідував синтез (+) - і (-) - Диспарлюри, починаючи з L- (+) -винної кислоти (рис 5.7).
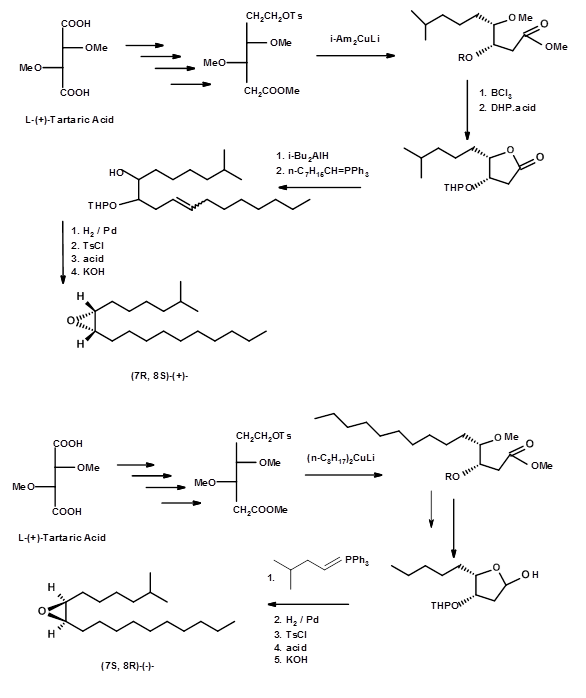
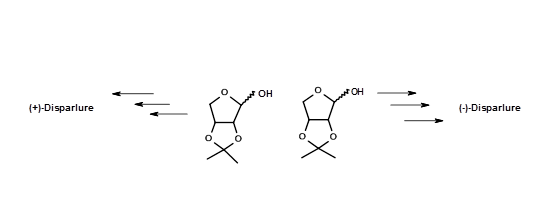
Цей синтез мав заслугу в тому, що деякі з хіральних проміжних продуктів були кристалізовані і, отже, піддаються легкому очищенню дуже чистих проміжних продуктів і чистих кінцевих продуктів. Їх проміжні продукти піддавалися критичному спектральному аналізу для оцінки їх чистоти. Таким чином, їх біоаналізи дали більш достовірні дані. Про синтез (+) - і (-) - Disparlure з іншого хірального синтону - ізопропілідену D- і L- еритрозів - повідомляв Alexandros E. Koumbis et.al., (Тетраедр Букви, 46, 4353 (2005)) (рис 5.8).
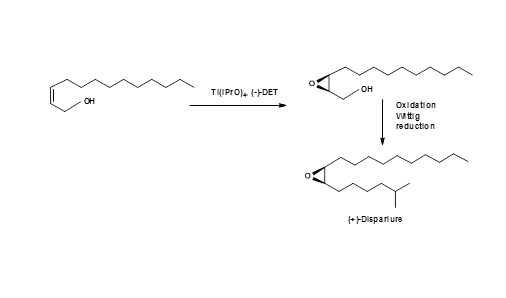
Про успішний синтез (+) - Disparlure за допомогою застосування Sharpless епоксидування повідомив Kossier B. E.. et.al., (J.Am. Хім. Соц., 103, 464 (1981)) (рис 5.9).
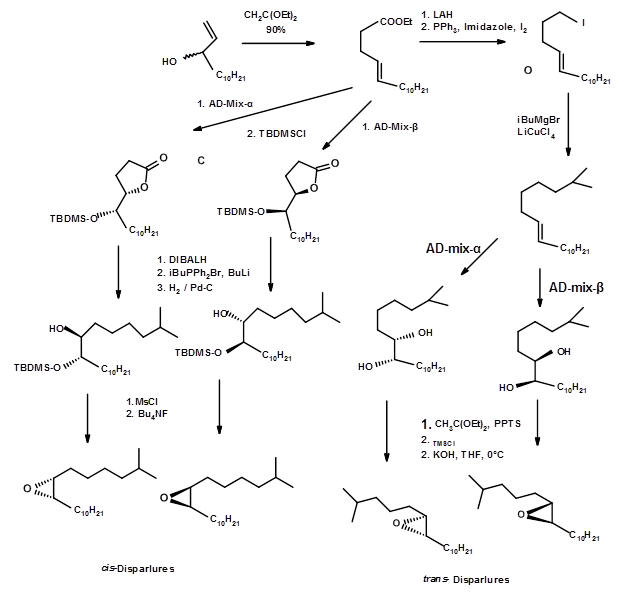
Синтез всіх чотирьох ізомерів в дуже чистому вигляді прийшов зі школи Sharpless E.B. (Тет. Летт., 6411 (1992). Використовуючи обидва агенти хірального гідроксилювання, вони повідомили про ефективний синтез всіх енантіомерів (рис. 5.10). Ефективність асиметричного синтезу становила 95% і давала 100% чистого проміжного шляхом кристалізації. Загальний процес був дуже ефективним.