4.1: Біосинтез монотерпенів- Логанін
- Page ID
- 18734
Терпени мають велику різноманітність карбонових скелетів, що характеризуються розгалуженими ланцюгами, і часто складними багатоциклічними кільцевими системами. Вони є олігомерами біологічної ізопренової одиниці, Δ 3 -ізопентенолу, який є відносно відновленим вуглеводнем, що складається з п'яти вуглеводів. Виробляється в природі з трьох молекул відносно окислених двох вуглецевих вихідних речовин, оцтової кислоти у вигляді ацетилу КоА. Вірогідним кандидатом для побічного продукту, що містить атом вуглецю, втрачений від трьох молекул оцтової кислоти при біосинтезі Δ 3 -ізопентенолу, є вуглекислий газ. Полярний аналіз передбачає більш високо окислений попередник, мевалонову кислоту, яка може бути декарбоксильована полярною фрагментацією\(\ce{CO2}\) електрофуги та гідроксидного нуклеофуга. Така фрагментація може отримати користь від термодинамічної переваги створення зв'язку C = O і виробляє легко одноразові високо окислені побічні продукти\(\ce{CO2}\) та воду. Подальший ретросинтетичний аналіз мевалонової кислоти передбачає полярне відключення до двох синтонів карбоніону оцтової кислоти, які конденсуються з ацетильним електрофілом.
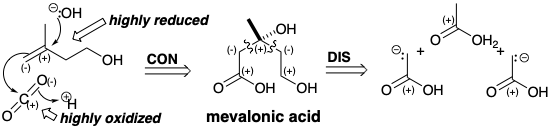
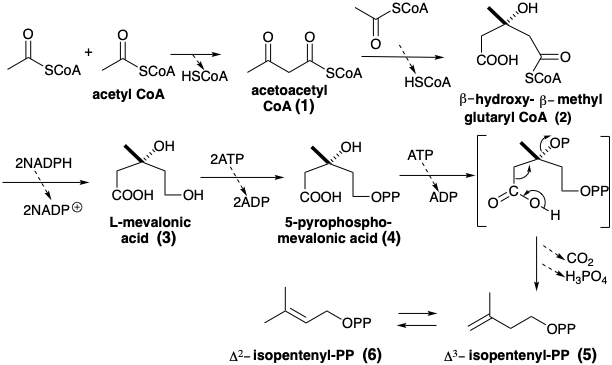
Дуже велика різноманітність ліпідів виведена в природі з олігомеризації Δ 3 -ізопентенілпірофосфату (5). Цей п'ять вуглецевих біосинтетичних будівельних блоків виробляється шляхом конденсації трьох молекул ацетилу CoA. Ацетоацетил CoA (1), що утворюється Claisen конденсації двох молекул ацетилу CoA, реагує на кетон карбонілу з другим еквівалентом ацетилу CoA як нуклеофілу. Ця конденсація є енантіоселективной. Асиметрія ферменту, гідроксиметилглутарил-КоА-синтетази, спрямовує атаку нуклеофіла ацетил КоА на одну сторону електрофілу прохірального ацетоацетилу CoA. Виріб симетричне. Проте конденсація супроводжується енантіоселективним гідролізом ефіру CoA-Sh, одержуваного з ацетильної групи. Потім монотіоефір 2 зменшується шляхом гідридної атаки на більш електрофільний тіоефір карбонілу, щоб дати L-мевалонову кислоту (3). Фосфорилювання 3 призводить, через 5-монофосфат і 5-пірофосфат, до нестійкого проміжного фосфорильованого при гідроксилі С- 3. Цей третинний фосфат легко піддається декарбоксиляційної елімінації, щоб дати Δ 3 -ізопентеніл пірофосфат, який легко ізомеризується до Δ 2 -ізопентилпірофосфату.
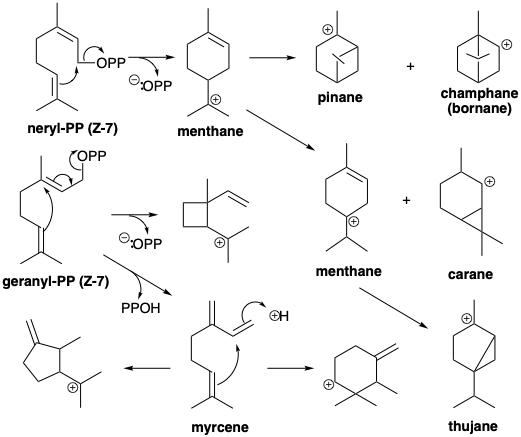
Димер від голови до хвоста, геранілпірофосфат (Е-7), утворюється додаванням аллілового електрофілу 6 до кінцевого олефіну 5, що супроводжується втратою протонів. Отриманий десять вуглецю аллілового пірофосфату Е-7 легко алкілує другу молекулу 5, щоб дати тример, п'ятнадцять вуглецю аллілового пірофосфату фарнезилпірофосфату (Е-8). Монотерпени - це сполуки С10, біогенетично отримані з геранілпірофосфату (Е-7), його Z-ізомеру, неріл-пірофосфату (Z-7), або з циклопропілдимера, хризанмілпірофосфату (9), який утворюється безпосередньо з двох молекул Δ 2 -ізопентенілпірофосфат. Ізопренові одиниці часто помітні вбудовані в скелети терпенів. Однак деякі терпени, наприклад похідні катіону сантолінілу, не складаються повністю з інтактних одиниць ізопрену внаслідок перебудови під час їх біосинтезу (Vide infra). Вони називаються нерегулярними терпенами.
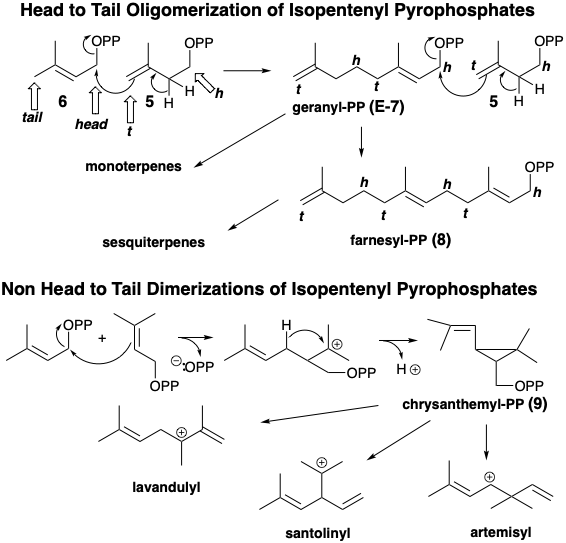
Внутрішньомолекулярна нуклеофільна атака C = C π-зв'язком на електрофільному пірофосфаті генерує різні ізомерні карбокатіонні проміжні продукти, такі як ментан, пінан, каран, камфан або туян іони карбенію.
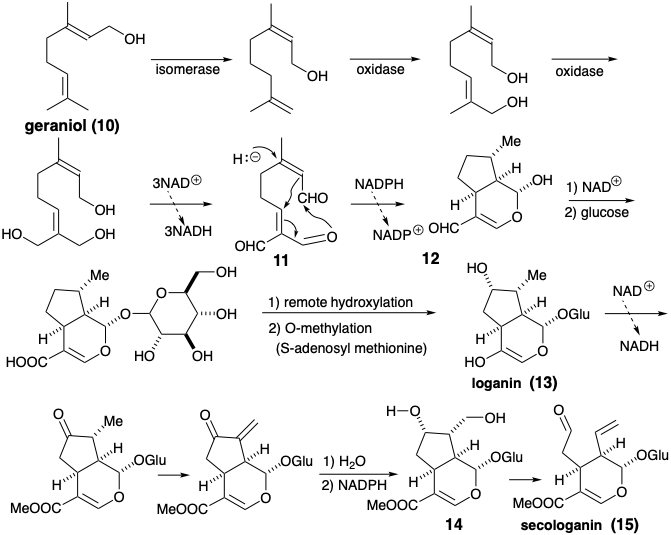
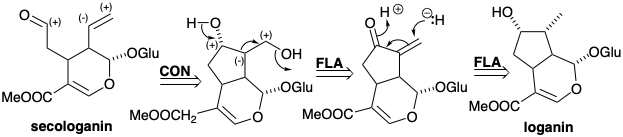
Монотерпеновий логанін є біосинтетичним попередником секологаніну, природного продукту, терпеноїдне походження якого неочевидне. Секологанін, ізопренові одиниці якого не є неушкодженими, виводиться біосинтетично шляхом полярного розщеплення циклопентанового кільця логаніну, що експлуатує полярну активацію, що забезпечується циклопентановим гідроксильним замінником.
Полярний аналіз логаніну показує, що гідроксильний замінник не є важливим для полегшення генерації циклопентанового кільця шляхом формування полярного зв'язку С-С, оскільки адекватна функціональність розташована поблизу ключового зв'язку. У біосинтез логаніна ця гідроксильна група вводиться в кінці синтезу дистанційним окисленням. Дигідропіран є просто похідним 1,5-діальдегіду, структура якого спрощується полярним роз'єднанням кільцевого зв'язку C-C, розташованого між двома приголосними функціональними групами. Цей вивих являє собою ретро-доповнення Майкла. Реквізити нуклеофіл може генеруватися депротонацією насиченого попередника. Альтернативним попередником цього нуклеофіла, який бере участь в біосинтезі, є ненасичений альдегід. Таким чином, кон'югатне додавання гідриду до a, b-ненасиченого альдегіду забезпечує нуклеофіл, який буде Майклом алкілірованним. Високо окислений субстрат циклізації отримують з гераніолу множинними аліловими окисленнями, а гераніол є димером двох попередників ізопентенолу, Δ 2 і Δ 3 -ізопентенолу.
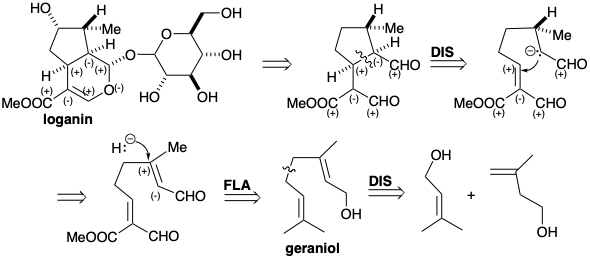
Логанін (13), глюкозид (змішаний ацеталь глюкози та алкоголю) монотерпену, є ключовим проміжним продуктом, який забезпечує секологанін (14), безпосередній попередник нетриптамінної частини коринанту, аспідосперми, ібоги, іпекакуанхи та хінхони груп індольні алколоїди (див. Главу 7). Логанін отримують з гераніолу (10), який спочатку окислюється до тріальдегіду (11). Редуктивна циклізація від 11 до 12 супроводжується подальшими окисленнями. Гідроксилоганін (14) дає секологанін (15) шляхом розщеплення Ретро-Прінса. Походження секологаніну з ізопреноїдних попередників не відразу очевидно при побіжному огляді його структури.