6.2: Реакції кетонів
- Page ID
- 21053
Енантіоселективне зменшення подвійного зв'язку C = O в органічному синтезі має важливе застосування в синтезі багатьох натуральних продуктів, а також фармацевтичних продуктів. Лекція охоплює репрезентативні приклади каталізованих металів реакцій. Реакції з використанням CBS та ферментів охоплюються іншими модулями цього курсу. Часто використовувані хіральні ліганди для каталізованих металом енантіоселективних реакцій відновлення кетонів перераховані в схемі\(\PageIndex{1}\).
6.2.1 Реакції α-кето амідів
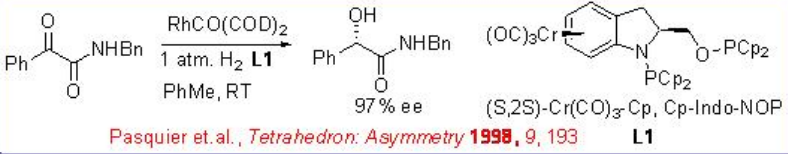
Досліджено асиметричне гідрування α -кето-ефірів декількома родієвими каталізаторами. Нейтральні родієві каталізатори з хіральними лігандами, такими як Cr (CO) 3 -Cp, CP-індо-NOP демонструють чудову енантіоселективність і реакційну здатність при гідруванні амідів (Схема\(\PageIndex{2}\)).
6.2.2 Реакції β - Кето ефірів
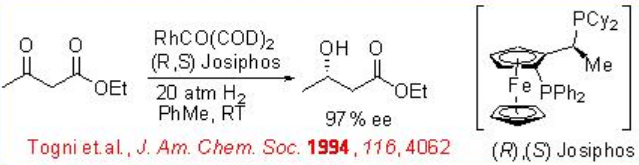
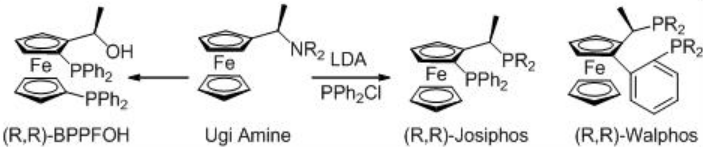
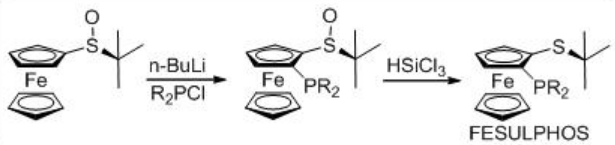
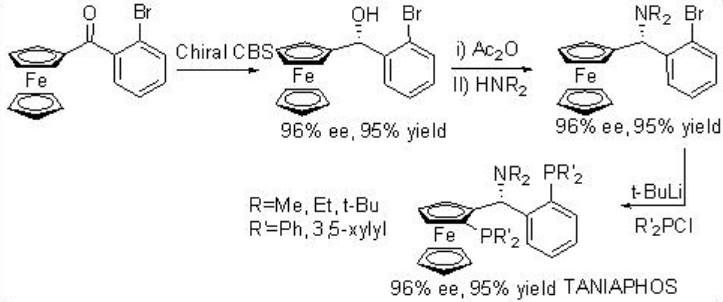
Асиметричне гідрування β -кето-ефірів широко вивчалося з використанням хіральних рутенієвих каталізаторів. Однак досліджено лише декілька прикладів, аналогічних реакції, що каталізується родієм (схема 3). Rh- (R, S) -Josiphos комплекс забезпечує ефективний каталізатор для асиметричного гідрування етилу 3-оксобутаноату, що забезпечує відповідний β-гідроксиефір в 97% е. Вищезазначені ліганди сімейства Йосифос, такі як хіральні Walphos, Joshiphos, BPPFOH, TRAP і PIGIPHOS ліганди можуть бути легко синтезовані з комерційно доступного аміну Угі (Схема\(\PageIndex{4}\) -\(\PageIndex{6}\)).
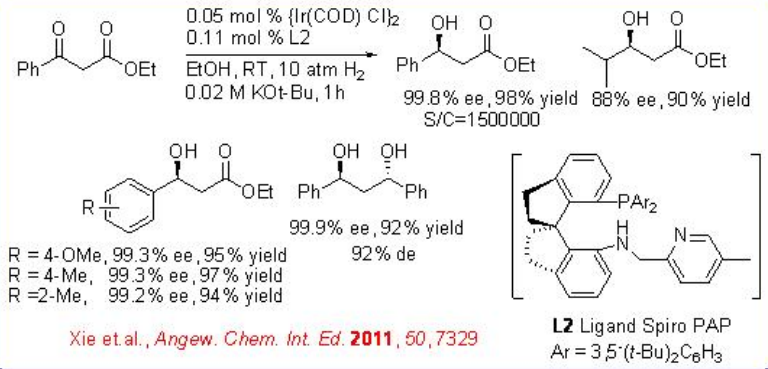
Як ефективний каталізатор для асиметричного гідрування β-арильних β-кетоефірів (схема\(\PageIndex{7}\)) використано іридій/спіро PAP. Реакція забезпечує легкодоступний метод синтезу β-гідроксиефірів з високою енантіоселективністю до 99,8% її та високими Tons до 1230000.
6.2.3 Реакції ароматичних кетонів
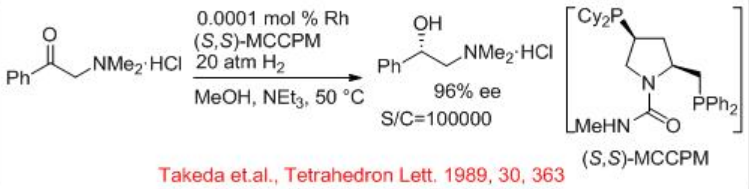
Амінокетони та їх гідрохлоридні солі можуть бути ефективно гідрогенізовані каталізаторами хірального родію (схема\(\PageIndex{8}\)). Родієві прекаталізатори в поєднанні з хіральними фосфорними лігандами (S, S) - MCCPM забезпечують чудову енантіоселективність та реакційну здатність для асиметричного гідрування солей α, β та γ -алкіламінокетонів гідрохлориду з S/C = 100000.
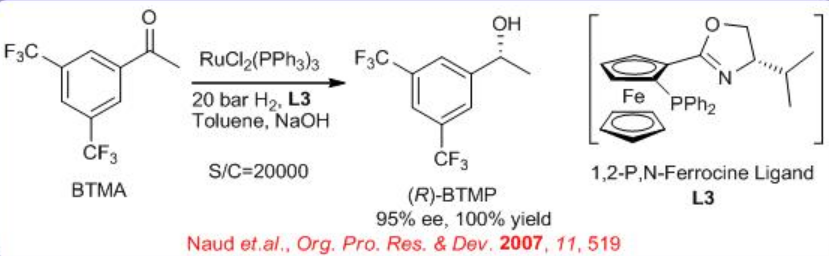
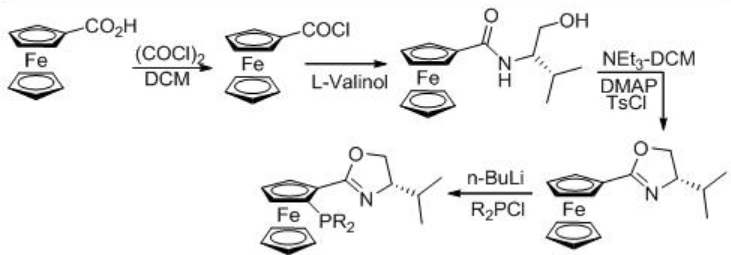
Енантіоселективне гідрування 3,5-бістрифторметилацетофенону (БТМА) може здійснюватися за допомогою комплексу RU/фосфін-оксазолін (схема\(\PageIndex{9}\)). Реакція сумісна зі шкалою 140 кг при 20 бар і 25° C зі співвідношенням S/C 20000. Синтез ліганду показаний на схемі\(\PageIndex{10}\).
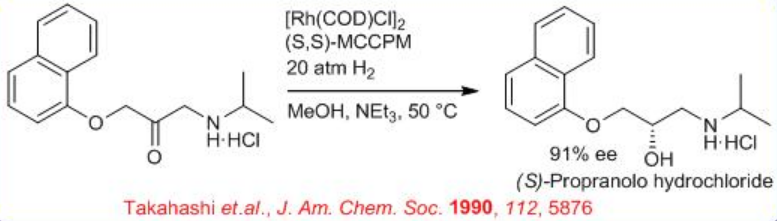
Енантіоселективне гідрування амінокетонів широко застосовується для синтезу хіральних препаратів та фармацевтичних препаратів (Схема\(\PageIndex{11}\)). Наприклад, пряме енантіоселективне гідрування 3-арилокси-2-оксо-1-пропіламіну призводить до 1-аміно-3-арилокси-2-пропанолу з використанням 0,01 моль% нейтрального комплексу Rh- (S, S) -MCCPM. Хіральний продукт 1-аміно-3-арилокси-2-пропанол служить β-адреноблокуючими агентами. (S) -Пропранолол отримують в 90,8% е з відповідного α -амінокетону.
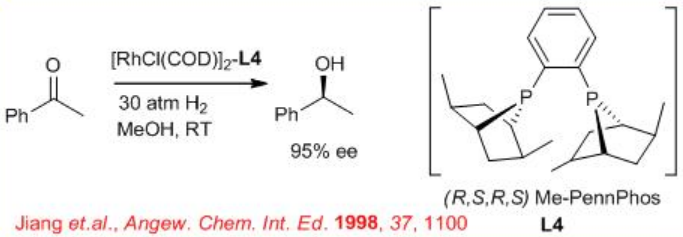
6.2.4 Реакції аліфатичних кетонів
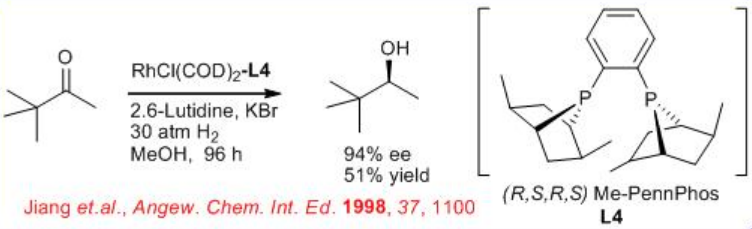
Асиметричне гідрування простих аліфатичних кетонів залишається складною проблемою. Це пов'язано з труднощами в розробці відповідного хірального каталізатора, який буде легко диференціювати між двоалкільними замінниками кетону. Отримано перспективні результати асиметричного гідрування аліфатичних кетонів з використанням комплексу (R, S, R, S) -PennPhos- Rh у поєднанні з 2,6-лютидином і KBr. Наприклад, реакція трет-бутилметилкетону відбувається з 94% е. Аналогічним чином ізопропіл-, н-бутил - і циклогексілметилкетони можуть бути зменшені з 85% ee, 75% ee і 92% ee відповідно.
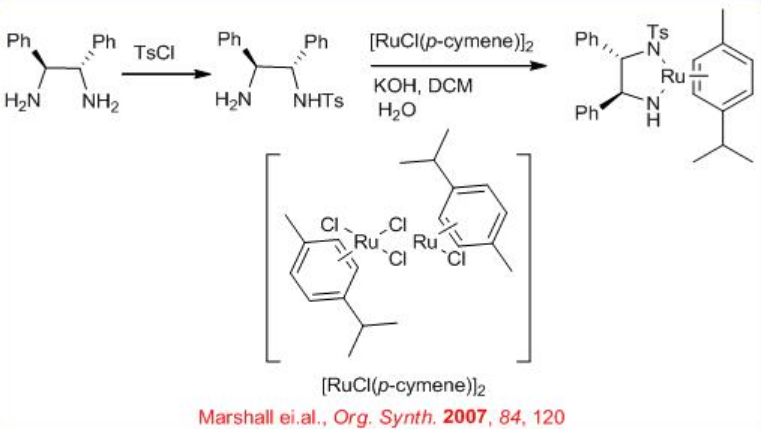
Хіральний ру-дифосфін/діамін, отриманий з хірального BINAP, DPEN (дифенілетилендіамін) та інданолу ефект енантіоселективного гідрування певних аміно-або амідокетонів за допомогою нехелатного механізму без взаємодії між Ru та азотом або киснем (Схема\(\PageIndex{14}\)). Діаміновий каталізатор може бути синтезований з хірального 1,2- дифенилетилендіаміну (схема\(\PageIndex{15}\)).
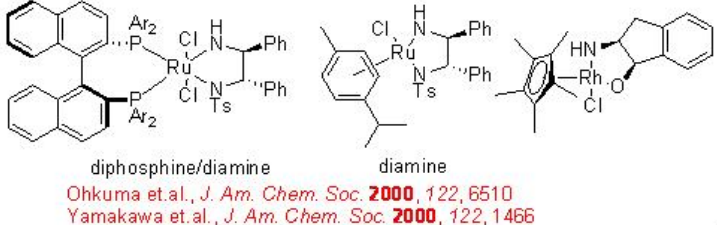
Ці каталізатори були використані для асиметричного синтезу різних важливих фармацевтичних препаратів, включаючи (R) -денопамін, агоніст β 1-рецепторів, антидепресант (R) -флуоксетин, антипсихотичний BMS 181100 і (S) - дулоксетин (схема\(\PageIndex{16}\)).
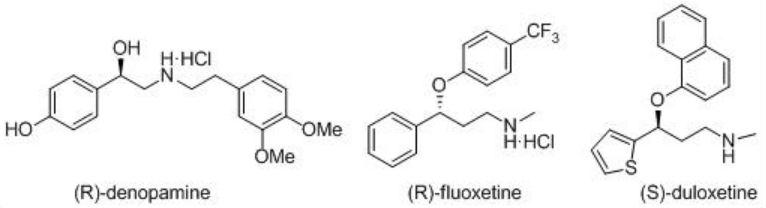
Несиметричні бензофенони також можуть бути гідрогенізовані з високим співвідношенням S/C до 20000 без надмірного зниження (схема\(\PageIndex{17}\)). Енантіоселективне гідрування деяких орто-заміщених бензофенонів призводить до несиметрично заміщених бензогідролів, що дозволяє зручно синтезувати анти- холінергічні та антигістамінні (S) -орфенадрін і антигістамінні (R) -необенодин.
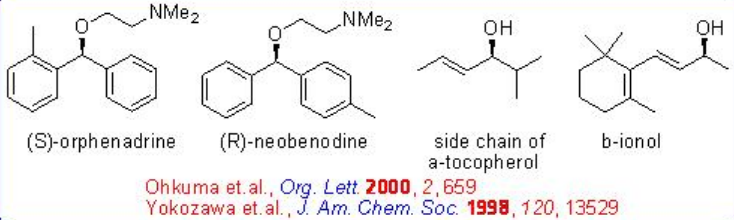
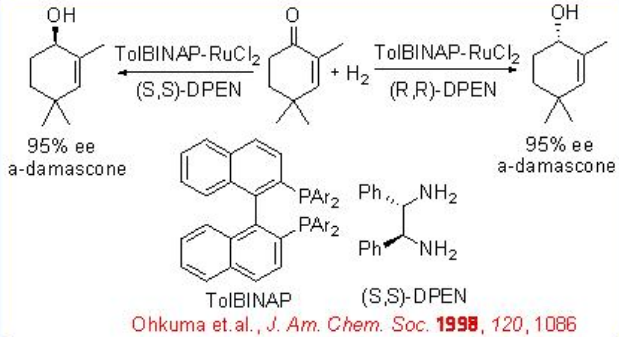
Асиметричне гідрування простого кетону, як правило, досягається шляхом комбінованого використання (S) -BINAP та (S) -1,2-дифенілетилендіаміну. Однак реакцію 2,4,4-триметил-2-циклогексенону можна ефективно проводити з рацемічним RuCl 2 [-тол-бінап] - і хіральним ДПЕН з до> 95% ee (Схема\(\PageIndex{18}\)).