9.5: Гідратація - оксимерація-демеркурація
- Page ID
- 22847
Мета навчання
- застосовувати принципи регіоселективності та стереоселективності до реакцій приєднання алкенів
- прогнозувати продукти, вказати реагенти та визначити найбільш ефективну реакцію для гідратації алкенів (кислотна каталізована гідратація; або оксимерція/демеркурація; або гідроборація/окислення)
Вступ
Кислотно-каталізована гідратація алкенів обмежена карбокатной стабільністю. Карбокатіонная перестановка може відбутися з утворенням більш стабільного іона, як показано на прикладі нижче.

Гідратація алкену за допомогою шляху реакції оксимерації-демеркурації надійно виробляє продукт Марковникова без карбокатной перестановки, як показано на прикладі нижче.

Оксимерція-Демеркурація - це двоступеневий шлях, який використовується для виробництва спиртів.
Механізм оксимерації-демеркурації
Цей механізм аналогічний попереднім реакціям електрофільного приєднання. Основна відмінність полягає в тому, що іонний міст ртуті стабілізує проміжний проміжний продукт карбокату, так що він не може переставити. Метали електропозитивні. Ртуть несе частковий позитивний заряд в ацетатному комплексі і є електрофілом. Під час першого кроку цього механізму електрони пі утворюють зв'язок з ртуттю, тоді як одинока пара на ртуті одночасно зв'язується з іншим вініловим вуглецем, створюючи міст іонів ртуті. Іон ртуті утворюється в поєднанні з втратою ацетатного іона. Іон ртуті стабілізує карбокацію, щоб він не перебудовувався. На другому етапі цього механізму молекула води реагує з найбільш заміщеним вуглецем, щоб відкрити міст іонів ртуті. Третім кроком цього механізму є перенесення протонів в молекулу води розчинника для нейтралізації продукту додавання. Четвертим етапом шляху реакції є зменшення проміжного вмісту ртуті органо-ртуті з борогідридом натрію в основних умовах. Механізм четвертого кроку виходить за рамки першого року органічної хімії.
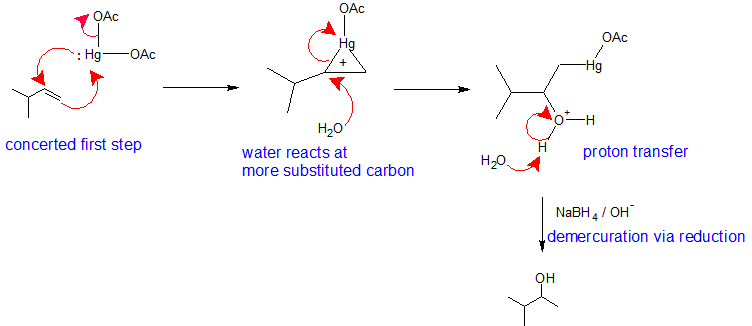
Зауважте, що в цілому механізм оксимеркурації - демеркурації слідує Регіоселективності Марковникова з групою ОН, приєднаною до найбільш заміщеного вуглецю, а Н приєднаний до найменш заміщеного вуглецю. Реакція корисна, оскільки сильні кислоти не потрібні, а карбокатіонні перебудови уникаються, оскільки немає стриманих карбокатіонних проміжних форм.
Вправа
1. Покажіть, як приготувати 3-метил2-пентанол з 3-метил-1-пентена.
Примітка: Питання 2-5 не показали воду, присутню в розчині сірчаної кислоти, і вказали на другий етап нейтралізації. Деякі автори просто пишуть H +/H 2 O як один крок.
2. Намалюйте структуру лінії зв'язку для виробу.
.bmp)
3. Намалюйте структуру лінії зв'язку для виробу. Як впливає циклопропанова група на реакцію?

4. Намалюйте структуру лінії зв'язку для виробу. (Підказка: Чим відрізняється ця проблема?)

5. Намалюйте структуру лінії зв'язку для виробу (ів). Вкажіть будь-які зміни, а також основний продукт:

6. У кожному конкретному випадку прогнозуйте продукт (и) цих реагентів оксимеркурації.

7. Запропонуйте алкен, який був реагентом для кожного з цих продуктів оксимеркурації.

- Відповідь
-
1.

2. Ця реакція - електрофільна гідратація.

3. Відповідь - додаткові побічні продукти, але основний продукт сформований все той же (продукт показаний). Залежно від використовуваних температур циклопропан може відкритися в прямий ланцюг, що робить малоймовірним, що основний продукт сформується (після реакції навряд чи 3º вуглецю залишиться таким).

4. Гідридний зсув фактично відбувається з верхньої частини 1-метилциклопентану туди, де утворився карбокат.
.bmp)
5. На першому малюнку, показаному нижче, відбувається зсув алкілів, але можливий зсув гідридів (який відбувається швидше). Чому не відбувається зсув гідридів? Відповідь полягає в тому, що алкільний зсув призводить до більш стабільного продукту. Існує помітна кількість побічного продукту, який утворюється там, де знаходяться дві метильні групи, але основний продукт, показаний нижче, все ще є найбільш значущим через гіперкон'югацію, яка відбувається, перебуваючи між двома циклогексанами.
6.

7.
.png)
Посилання
- Vollhardt, K.Peter C. Структура і функції органічної хімії. Нью-Йорк: В.Х. Фрімен, 2007.
- Сміт, Майкл Б., і Джеррі Марч. Розширені реакції, механізми та структура органічної хімії березня (передова органічна хімія березня). Нью-Йорк: Вілі-міжнауковий, 2007 2007.
- Родерик П. Квирк, Роберт Леа, Редуктивна демеркурація гекс-5-еніл-1-ртутного броміду гідридами металів. Перестановка, ізотопні ефекти, і механізм, J Am. Хім. Соц. , 1976, 98 (19), с. 5973—5978.
Дописувачі та атрибуція
- Template:ContribKennepohl
- Lance Peery (UCD), Duyen Dao-Tran (UCD)
- Template:ContribSoderberg
- Template:ContribClark
- Template:ContribFarmer
