5.10: Вільно-радикальна галогенація алканів
- Page ID
- 23379
Алкани (найосновніші з усіх органічних сполук) зазнають дуже мало реакцій. Однією з таких реакцій є галогенізація, або заміна одного водню на алкан на один галоген з утворенням галоалкана. Ця реакція дуже важлива в органічній хімії, оскільки вона відкриває шлюз для подальших хімічних реакцій.
Вступ
Хоча реакцій, можливих з алканами, мало, існує багато реакцій, які включають галоалкани. Для того щоб краще зрозуміти механізм (докладно розглянемо покроковий процес, за допомогою якого відбувається реакція), ми уважно вивчимо хлорування метану. При змішуванні метану (СН 4) і хлору (Cl 2) при відсутності світла при кімнатній температурі нічого не відбувається. Однак якщо умови змінені, так що або реакція протікає при високих температурах (позначається Δ), або відбувається ультрафіолетове опромінення, утворюється продукт - хлорметан (СН 3 Cl).
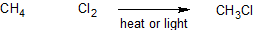
Енергетика
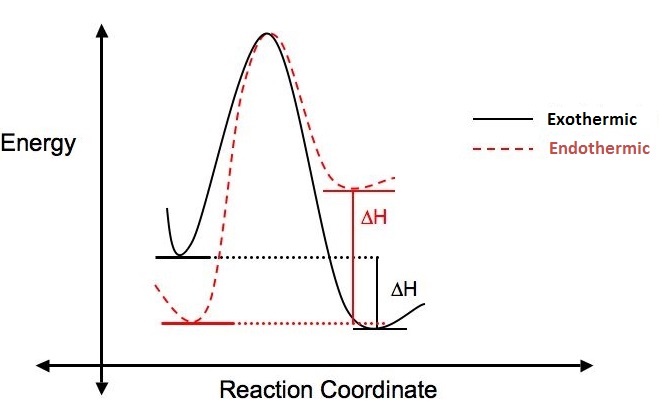
Чому виникає така реакція? Чи сприятлива реакція? Спосіб відповісти на ці питання - подивитися на зміну ентальпії (\(\Delta{H}\)), яка виникає, коли відбувається реакція.
ΔH = (Енергія, введена в реакцію) - (Енергія, що видається від реакції)
Якщо в реакцію вкладено більше енергії, ніж віддається, ΔH позитивний, реакція ендотермічна і не енергетично сприятлива. Якщо в реакції виділяється більше енергії, ніж було введено, ΔH негативний, реакція, як кажуть, екзотермічна і вважається сприятливою. На малюнку нижче ілюструється різниця між ендотермічними і екзотермічними реакціями.
ΔH також можна обчислити за допомогою енергій дисоціації зв'язку (ΔH°):
\[\Delta{H} = \sum \Delta{H^°} \text{ of bonds broken} - \sum \Delta{H^°} \text{ of bonds formed}\]
Давайте розглянемо наш конкретний приклад хлорування метану, щоб визначити, ендотермічний він чи екзотермічний:
.jpg)
Так як, ΔH для хлорування метану негативний, реакція екзотермічна. Енергетично ця реакція сприятлива. Для того щоб краще зрозуміти цю реакцію, нам потрібно подивитися на механізм (детальний крок за кроком поглянути на реакцію, яка показує, як вона відбувається), за допомогою якого відбувається реакція.
Радикальний ланцюговий механізм
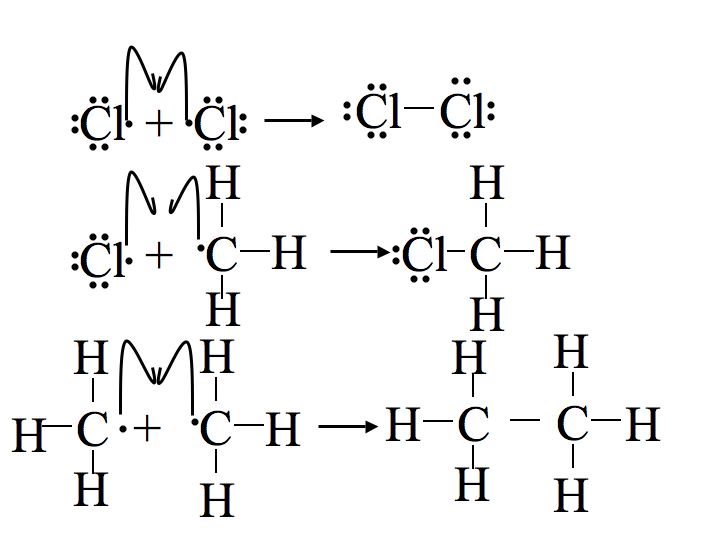
Реакція протікає через радикальний ланцюговий механізм. Радикальний ланцюговий механізм характеризується трьома етапами: ініціація, поширення і припинення. Ініціація вимагає введення енергії, але після цього реакція самоокупна. Перший крок поширення використовує один із продуктів від ініціації, а другий етап поширення робить ще один, таким чином цикл може тривати до невизначеного часу.
Крок 1: Ініціація
Ініціація розриває зв'язок між молекулою хлору (Cl 2). Щоб цей крок відбувся, енергія повинна бути покладена, цей крок енергетично не сприятливий. Після цього етапу реакція може відбуватися безперервно (до тих пір, поки забезпечують реагенти) без введення більшої кількості енергії. Важливо відзначити, що ця частина механізму не може відбуватися без деякого зовнішнього надходження енергії, через світло або тепло.
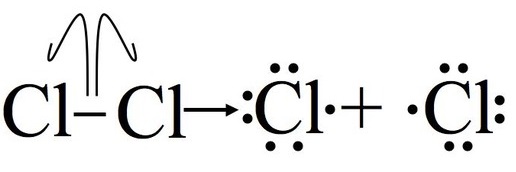
Крок 2: Розмноження
Наступні два кроки в механізмі називаються ступенями поширення. На першому етапі розповсюдження радикал хлору поєднується з воднем на метані. Це дає соляну кислоту (HCl, неорганічний продукт цієї реакції) і метиловий радикал. На другому етапі поширення використовується більше вихідного матеріалу хлору (Cl 2), один з атомів хлору стає радикалом, а інший поєднується з метиловим радикалом.
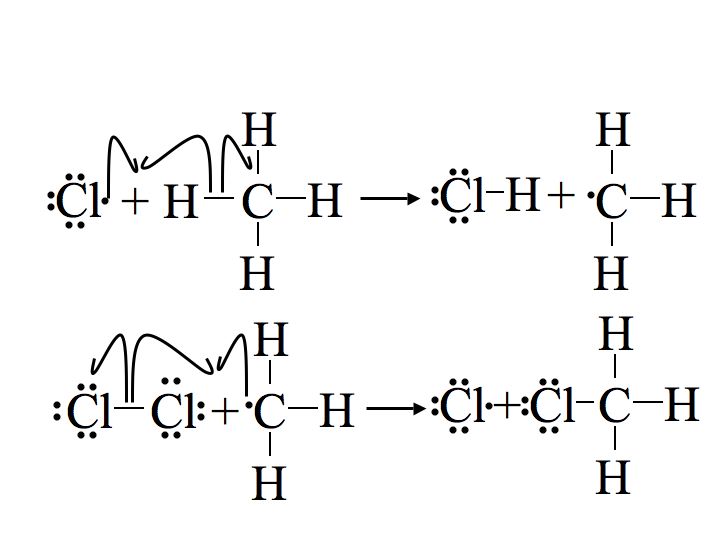
Перший етап поширення ендотермічний, тобто він приймає тепло (вимагає 2 ккал/моль) і не є енергетично сприятливим. На відміну від цього, другий етап розмноження екзотермічний, вивільняючи 27 ккал/моль. Після початку реакції екзотермічна енергія, що виділяється з другого етапу поширення, забезпечує енергію активації для першого етапу поширення, створюючи циклічну ланцюгову реакцію за принципом Ле Шательє до закінчення.
.gif)
Крок 3: Припинення
На етапах припинення всі інші радикали об'єднуються (всіма можливими способами), утворюючи більше продукту (CH 3 Cl), більше реагенту (Cl 2) і навіть комбінації двох метильних радикалів, утворюючи побічний продукт етану (CH 3 CH 3).
Обмеження хлорування
Хлорування метану або будь-якого іншого алкана не обов'язково припиняється після одного хлорування. Це може бути дуже важко отримати монозаміщений хлорметан. Замість ді-, три- і навіть тетра-хлорометани утворюються. Одним із способів уникнути цієї проблеми є використання набагато більшої концентрації метану або іншого алкану в порівнянні з хлоридом. Це зменшує ймовірність того, що радикал хлору потрапляє в хлорметан і знову запускає механізм, щоб утворити дихлорметан. За допомогою цього методу контролю співвідношення продуктів можна мати відносну величину контролю над продуктом.
Вправи
- Інші сполуки, крім хлору та метану, можуть реагувати за допомогою вільнорадикальної галогенації. Випишіть повний механізм монобромізації етану.
- Поясніть, як енергетично несприятливий перший крок поширення може продовжувати відбуватися без введення енергії із зовнішнього джерела.
- Який крок радикального ланцюгового механізму вимагає зовнішньої енергії? Що можна використовувати в якості цієї енергії?
- Скористайтеся таблицею, наданою нижче, щоб розрахувати зміну ентальпії для монобромізації етану.
| З'єднання | Енергія дисоціації облігацій (ккал/моль) |
| СН 3 СН 2 -Н | 101 |
| СН 3 СН 2 -Бр | 70 |
| H-Br | 87 |
| Бр 2 | 46 |
Рішення
1.
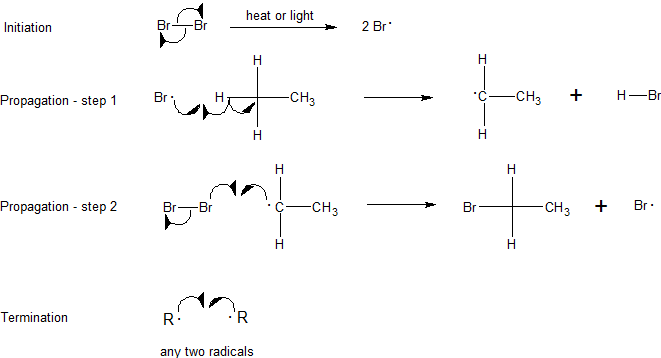
2. Екзотермічна енергія, що виділяється з другого етапу поширення, забезпечує енергію активації для першого етапу поширення, створюючи циклічну ланцюгову реакцію за принципом Ле Шательє до закінчення.
3. Етап ініціації вимагає енергії від тепла до вогню. Для максимальної фотоефективності довжина хвилі світла корелюється з гомолітично розщепленою зв'язком.
4. 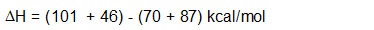
Посилання
- Матияшевський, Кшиштоф, Войцех Якубовський, Ке Мін, Вей Тан, Джінью Хуан, Вейд Браунекер та Микола Васильович Царевський. «Зменшення концентрації каталізатора в радікальній полімеризації переносу атомів з відновниками». Наука 72 (1930): 379-90.
- Філліпс, Френсіс С. «# Дослідження хімічних властивостей газів.» Дослідження хімічних властивостей газів 17 (1893): 149-236.
Зовнішні посилання
- Відео механізму: http://www.jbpub.com/organic-online/movies/chlormet.htm
- Вікіпедія радикального ланцюгового механізму: uk.wikipedia.org/wiki/free_Radical_галогенація
- Вікіпедія принципу Ле Шательє: ua.wikipedia.org/wiki/le_chatelier%27s_Principe #Concentration
Автори та атрибуція
- Крістен Келлі та Брітт Фаркухарсон