5.9: Реактивні проміжні продукти - карбоніони та вуглецеві кислоти
- Page ID
- 23402
Карбаніони
Карбаніон - це аніон, в якому вуглець має нерозділену пару електронів і несе негативний заряд зазвичай з трьома замісниками на загальну суму вісім валентних електронів. [1] Карбаніон існує в тригональній пірамідальній геометрії. Формально карбоніон є сполученою основою вуглецевої кислоти.
\[\ce{R_3C-H + B^- \rightarrow R_3C^- + H-B}\]
де B позначає базу. Карбаніон є одним з декількох реактивних проміжних продуктів в органічній хімії.
Карбаніон - це нуклеофіл, стабільність і реактивність якого визначаються декількома факторами:
- Індуктивний ефект. Електронегативні атоми, прилеглі до заряду, стабілізують заряд;
- Гібридизація атома, що несе заряд. Чим більше s-характер атома, що несе заряд, тим стійкіший аніон;
- Ступінь відмінювання аніона. Резонансні ефекти можуть стабілізувати аніон. Особливо це актуально, коли аніон стабілізується в результаті ароматності.
Карбаніон є реактивним проміжним продуктом і зустрічається в органічній хімії, наприклад, в реакції елімінації E1cB та в металоорганічної хімії, наприклад, реакції Гріньяра або в хімії алкілу літію. Однак стабільні вуглеці існують. У 1984 році Олмстед представив літієву коронкову ефірну сіль трифенілметилкарбонату з трифенілметану, н-бутилітію і 12-краун-4 при низьких температурах: [2]
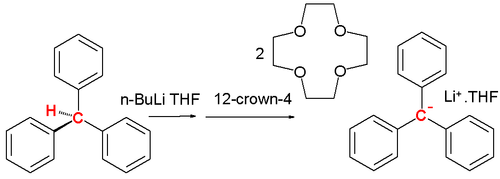
Додавання н-бутилітію до трифенілметану в ТГФ при низьких температурах з подальшим 12-крайно-4 призводить до червоного розчину, а сольовий комплекс випадає в осад при −20° С. Довжина центрального зв'язку С-С становить 145 пм з феніловим кільцем, що рухається під середнім кутом 31,2°. Ця форма пропелера менш виражена з тетраметиламмонієвим протидією. [3] Одним із інструментів для виявлення карбіонів у розчині є протонний ЯМР. [4] Спектр циклопентадієну в ДМСО показує чотири вінілові протони при 6,5 проміле та два протони метиленового моста при 3 ppm, тоді як циклопентадієніловий аніон має одиночний резонанс при 5,50 проміле.
Вуглецеві кислоти
Будь-яка молекула, що містить С-Н, може втратити протон, що утворює карбон. Звідси будь-який вуглеводневий, що містить C-H зв'язки, можна вважати кислотою з відповідним значенням pKA. Метан, звичайно, не є кислотою у своєму класичному значенні, але його розрахунковий pKA становить 56. Порівняйте це з оцтовою кислотою з РКа 4,76. Ті ж фактори, що визначають стабільність карбоніона, визначають і порядок в рКа в вуглецевих кислотах. Ці значення визначаються для сполук або у воді, щоб порівняти їх зі звичайними кислотами, індіметилсульфоксидом, в яких розчинна більшість вуглецевих кислот і їх аніонів, або в газовій фазі. При ДМСО вікно кислотності розчинених речовин обмежується власним рКа 35,5.
| найменування | формула | структурна формула | пКа |
|---|---|---|---|
| Метан | СН 4 |  |
~ 56 |
| Етан | С 2 Ч 6 |  |
~ 50 |
| анізол | С 7 Ч 8 О |  |
~ 49 |
| Циклопентан | З 5 Ч 10 |  |
~ 45 |
| Пропен | С 3 Ч 6 |  |
~ 44 |
| Бензол | С 6 Ч 6 |  |
~ 43 |
| Толуол | С 6 Н 5 СН 3 |  |
~ 43 |
| Диметилсульфоксид | (СН 3) 2 ТАК |  |
35.5 |
| Дифенілметан | С 13 Ч 12 |  |
32.3 |
| Анілін | С 6 Н 5 Н 2 |  |
30.6 |
| Трифенілметан | С 19 Ч 16 |  |
30.6 |
| Ксантен | С 13 Ч 10 О |  |
30 |
| Етанол | З 2 Ч 5 ОН |  |
29.8 |
| фенілацетилен | С 8 Ч 6 |  |
28.8 |
| Тіоксантен | З 13 Ч 10 С |  |
28.6 |
| Ацетон | С 3 Ч 6 О |  |
26.5 |
| ацетилен | С 2 Н 2 |  |
25 |
| Бензоксазол | С 7 Ч 5 НІ |  |
24.4 |
| Флуорен | С 13 Ч 10 |  |
22.6 |
| Інден | C 9 Ч 8 |  |
20.1 |
| Циклопентадієн | З 5 Ч 6 |  |
18 |
| Малононітрил | С 3 Н 2 Н 2 |  |
11.2 |
| Ціаністий водень | HCN |  |
9.2 |
| ацетилацетон | З 5 Ч 8 З 2 |  |
8.95 |
| Димедон | З 8 Ч 12 З 2 |  |
5.23 |
| Кислота мельдрума | З 6 Ч 8 З 4 |  |
4.97 |
| оцтова кислота | СН 3 СООН |  |
4.76 |
| Барбітурова кислота | С 4 Н 2 О 3 (Н) 2 |  |
4.01 |
| тринітрометан | НС (№ 23) |  |
0,17 |
| Фульмінова кислота | ХЧНО |  |
-1.07 |
| Карборан суперкислота | ГЧБ 11 Кл 11 |  |
-9 |
Зверніть увагу, що аніони, що утворюються при іонізації оцтової кислоти, етанолу або аніліну, не є карбоніями.
Починаючи з метану в таблиці 1, кислотність підвищується:
- коли аніон є ароматичним, або тому, що доданий електрон призводить до того, що аніон стає ароматичним (як у індену та циклопентадієну), або тому, що негативний заряд на вуглець може бути делокалізований над кількома вже ароматичними кільцями (як у трифенілметані або суперкислоти карборану).
- коли карбоніон оточений сильно електронегативними групами, шляхом часткової нейтралізації негативного заряду (як у малонітрилу).
- коли карбоніон знаходиться відразу поруч з карбонільної групою. α-протони карбонільних груп кислі, оскільки негативний заряд в енолаті може частково розподілятися в атомі кисню. Кислота мельдрума та барбітурова кислота, історично названі кислотами, насправді є лактоном і лактамом відповідно, але їх кислі вуглецеві протони роблять їх кислими. Кислотність карбонільних сполук є важливою рушійною силою в багатьох органічних реакціях, таких як реакція альдола.
хіральні карбоніони
З молекулярною геометрією для карбоніону, описаного як тригональна піраміда, питання полягає в тому, чи можуть карбоніони проявляти хіральність, оскільки якщо бар'єр активації для інверсії цієї геометрії занадто низький, будь-яка спроба введення хіральності закінчиться інракемізацією, подібною до інверсії азоту. Однак існують вагомі докази того, що карбоніони дійсно можуть бути хіральними, наприклад, у дослідженнях, проведених з певними органолітієвими сполуками.
Перші в історії докази існування хіральних органолітієвих сполук були отримані в 1950 році. Реакція хірального 2-йодооктану з сек-бутилітієм у петролейному ефірі при −70° C з подальшою реакцією з сухим льодом, що отримувала переважно рацемічну 2-метилмасляну кислоту, а також кількість оптично активної 2-метілоктанової кислоти, яка могла утворитися лише з аналогічно оптично активного 2-метилгептилітію з атом вуглецю, пов'язаний з літієм карбоніоном: [6]
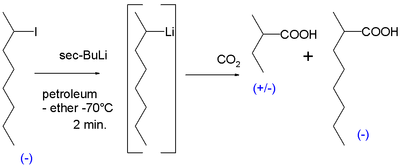
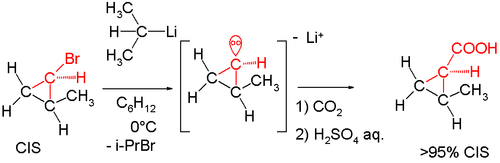
При нагріванні реакції до 0 °С оптична активність втрачається. Більше доказів послідувало в 1960-х роках. Проведено реакцію цис-ізомеру 2-метилциклопропілброміду з сек-бутилітієм знову з подальшим карбоксилюванням сухим льодом з отриманням цис-2-метилциклопропілкарбонової кислоти. Утворення транс-ізомеру вказувало б на те, що проміжний карбоніон був нестійким [7].
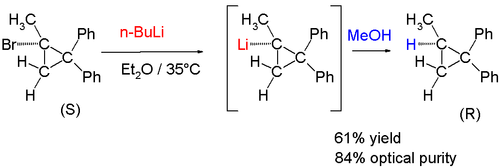
Таким же чином реакція (+) - (S) -l-бром-l-метил-2,2-дифенілциклопропану з н-бутилітієм з подальшим гасінням метанолом призвела до отримання продукту із збереженням конфігурації: [8]
До недавньої дати відносяться хіральні метилітієві сполуки: [9]
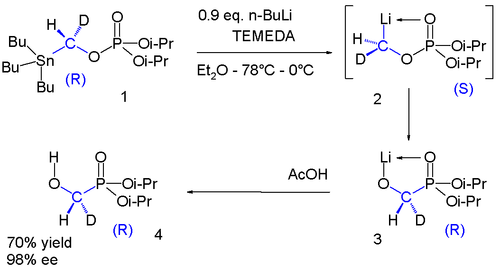
Фосфат 1 містить хіральну групу з воднем і замісником дейтерію. Станиловая група замінена літієм на проміжну 2, яка піддається фосфатно-фосфоранної перестановці на фосфоран 3, який при реакції з оцтовою кислотою даєспирт 4. Знову в діапазоні від -78 °С до 0 °С хіральність зберігається в цій послідовності реакцій [10].
Історія
Карбаніонова структура вперше з'явилася в реакційному механізмі конденсації бензоїну, як правильно запропонували Кларк і Лапворт в 1907 році. [11] У 1904 році Шленк підготував PH3C-NME4+ в пошуках п'ятивалентного азоту (зтетраметиламмонію хлориду і Ph3Cna) [12], а в 1914 році він продемонстрував як триарилметилові радикали можуть бути зведені до вуглецю лужними металами. [13] Словосполучення карбоніон було введено Уоллісом і Адамсом в 1933 році як негативно заряджений аналог іона карбонію [14] [15]
Зовнішні посилання
- Велика база даних значень PkA Бордвелла за адресою www.chem.wisc.edu Посилання
- Велика база даних значень PkA Бордуелла за адресою daecr1.harvard.edu Посилання
Посилання
- Органічна хімія - Роберт Торнтон Моррісон, Роберт Нілсон Бойд
- Виділення та рентгенівські структури літієвих коронкових ефірних солей вільних феніл-карбоаніонів [ChPh2] - і [CpH3] - Мерилін М.Олмстед, Філіп П. Пауер; Дж. Хім. Соц.; 1985; 107 (7); 2174-2175. доі: 10.1021/я00293а059
- Твердіше, Шорд (2002). «Ранні «вільні» карбоніони Шленка». Хімія - Європейський журнал 8 (14): 3229—3232. дої:10.1002/1521-3765 (20020715) 8:14 <3229::AID-CHEM3229>3.0.CO; 2-3.
- Простий і зручний метод генерації та ЯМР спостереження стабільних карбоніонів. Хамід Касмай Журнал хімічної освіти • Том 76 № 6 червня 1999
- Рівноважні кислотності в розчині диметилсульфоксиду Frederick G. Bordwell Acc. Хім. Рез.; 1988; 21 (12) стор 456 - 463; дої:10.1021/ар00156а004
- ФОРМУВАННЯ ОПТИЧНО АКТИВНОГО 1-МЕТИЛГЕПТИЛІТІЮ Robert L. Letsinger J. Am. Хім. Соц.; 1950; 72 (10) стор 4842 - 4842; дої:10.1021/я01166а538
- Конфігураційна стабільність цис- та транс-2-метилциклопропілітію та деякі спостереження за стереохімією їх реакцій з бромом та вуглекислим газом Дугласом Епплквістом та Аланом Петерсоном Дж. Хім. Соц.; 1961; 83 (4) стор. 862 - 865; дої: 10.1021/я01465a030
- Циклопропани. ХВ. Оптична стабільність 1-метил-2,2-дифенілциклопропілітію H.M. Walborsky, F. J Impastato та А.Е. Янг Дж. Хім. Соц.; 1964; 86 (16) с. 3283 - 3288; дої: 10.1021/я01070a017
- Отримання хіральних -окси-[ 2Н1] метилітіїв 99% її та визначення їх конфігураційної стійкості Дагмар Капеллер, Роланд Барт, Курт Мерейтер та Фрідріх Хаммершмідт А.м. Хім. Соц.; 2007; 129 (4) стор. 914 - 923; (Стаття) дої: 10.1021/ja066183s
- Енантіоселективність, визначена методом ЯМР-спектроскопії після дериватизації кислотою Мошера
- Кларк, Р.В.; Лапворт, А. (1907). «ЛХВ.? Розширення синтезу бензоїну». Журнал Хімічного товариства, транзакції 91: 694. doi: 10.1039/CT9079100694.
- Шленк, В.; Вайкель, Т.; Герценштейн, А. «Ueber трифенілметил і аналог трифенілметилів в дифенілрейх. [Цвейт Міттхайлунг про «Триарилметил».]». Юстус Лібіх Аннален дер Хемі 372: 1. день: 10.1002/jlac.19103720102.
- Шленк, В.; Маркус, Е. (1914). «Über Metalladditinen і фрі організовує Радікале. (Про триарилметил. XII.)». Беріхте дер Дойчен хімічний гезелшафт 47 (2): 1664. doi: 10.1002/cber.19140470256.
- Уолліс, Е.; Адамс, Ф.Х. (1933). «Просторова конфігурація валентностей у триковалентних вуглецевих сполуках». Журнал Американського хімічного товариства 55 (9): 3838. doi: 10.1021/ja01336a068.
- Тідвелл, Т.Т. (1997). «Перше століття фізичної органічної хімії: пролог». Чиста та прикладна хімія 69 (2): 211—214. doi: 10.1351/pac199769020211. edi