1.9: Електронегативність та полярність зв'язку (огляд)
- Page ID
- 22844
Мета навчання
- Визначити полярні зв'язки та сполуки
Електронегативність - це міра тенденції атома притягувати зв'язкову пару електронів. Шкала Паулінга є найбільш часто використовуваною. Фтору (найбільш електронегативному елементу) присвоюється значення 4,0, а значення варіюються до цезію та францію, які є найменш електронегативними при 0,7.
Патерни електронегативності в Періодичній таблиці
Електронегативність визначається як здатність атома в конкретній молекулі притягувати електрони до себе. Чим більше значення, тим більша привабливість для електронів.
Тенденції електронегативності протягом періоду
Позитивно заряджені протони в ядрі притягують негативно заряджені електрони. Зі збільшенням кількості протонів в ядрі електронегативність або тяжіння будуть збільшуватися. Тому електронегативність зростає зліва направо поспіль в таблиці Менделєєва. Цей ефект справедливий лише для рядка в періодичній таблиці, оскільки тяжіння між зарядами швидко падає з відстанню. На графіку показані електронегативності від натрію до хлору (ігноруючи аргон, оскільки він не утворює зв'язків).
Тенденції електронегативності в групі
У міру того, як ви йдете вниз по групі, електронегативність знижується. (Якщо він збільшується до фтору, він повинен зменшуватися, коли ви йдете вниз.) На графіку показані закономірності електронегативності в групах 1 і 7.
Пояснення закономірностей в електронегативності
Тяжіння, яке відчуває сполучна пара електронів для конкретного ядра, залежить від:
- кількість протонів в ядрі;
- віддаленість від ядра;
- величина скринінгу внутрішніми електронами.
Чому електронегативність збільшується протягом певного періоду?
Розглянемо натрій на початку періоду 3 і хлор в кінці (ігноруючи благородний газ, аргон). Подумайте про хлорид натрію так, ніби він був ковалентно пов'язаний.
Як натрій, так і хлор мають свої сполучні електрони на рівні 3. Електронна пара екранується від обох ядер електронами 1s, 2s і 2p, але ядро хлору має в ньому ще 6 протонів. Не дивно, що електронна пара тягнеться так далеко до хлору, що утворюються іони. Електронегативність збільшується протягом певного періоду, оскільки кількість зарядів на ядрі збільшується. Що притягує зв'язуючу пару електронів сильніше.
Чому електронегативність падає, коли ви йдете вниз по групі?
Коли ви йдете вниз по групі, електронегативність зменшується, оскільки зв'язкова пара електронів все більше віддаляється від тяжіння ядра. Розглянемо молекули фтористого водню і хлористого водню:
Сполучна пара екранується від ядра фтору тільки електронами 1s 2. У хлорному корпусі він екранований всіма електронами 1s 2 2s 2 2p 6. У кожному випадку йде сітчаста витяжка з центру фтору або хлору +7. Але фтор має сполучну пару на рівні 2, а не на рівні 3, як це в хлорі. Якщо він знаходиться ближче до ядра, тяжіння більше.
Дипольні моменти виникають, коли відбувається поділ заряду. Вони можуть виникати між двома іонами в іонному зв'язку або між атомами в ковалентному зв'язку; дипольні моменти виникають внаслідок відмінностей в електронегативності. Чим більше різниця в електронегативності, тим більше дипольний момент. Відстань між поділом заряду також є вирішальним фактором розміру дипольного моменту. Дипольний момент - це міра полярності молекули.
Полярність Бонда та дипольний момент
Атоми з відмінностями в електронегативності будуть ділити електрони неоднаково. Спільні електрони ковалентного зв'язку міцніше утримуються на більш електронегативному елементі, що створює частковий негативний заряд, в той час як менш електронегативний елемент має частковий позитивний заряд,. Чим більше різниця в електронегативності між двома атомами, тим більш полярна зв'язок. Щоб вважатися полярним зв'язком, різниця в електронегативності повинна бути >0,4 за шкалою Паулінга. Оскільки два електричних часткових заряду мають протилежний знак і рівну величину і розділені відстанню, встановлюється диполь. Дипольний момент вимірюється в дебайських одиницях, що дорівнює відстані між зарядами, помноженої на заряд (1 дебай дорівнює 3,34 х 10 -30 кулон-метрів).
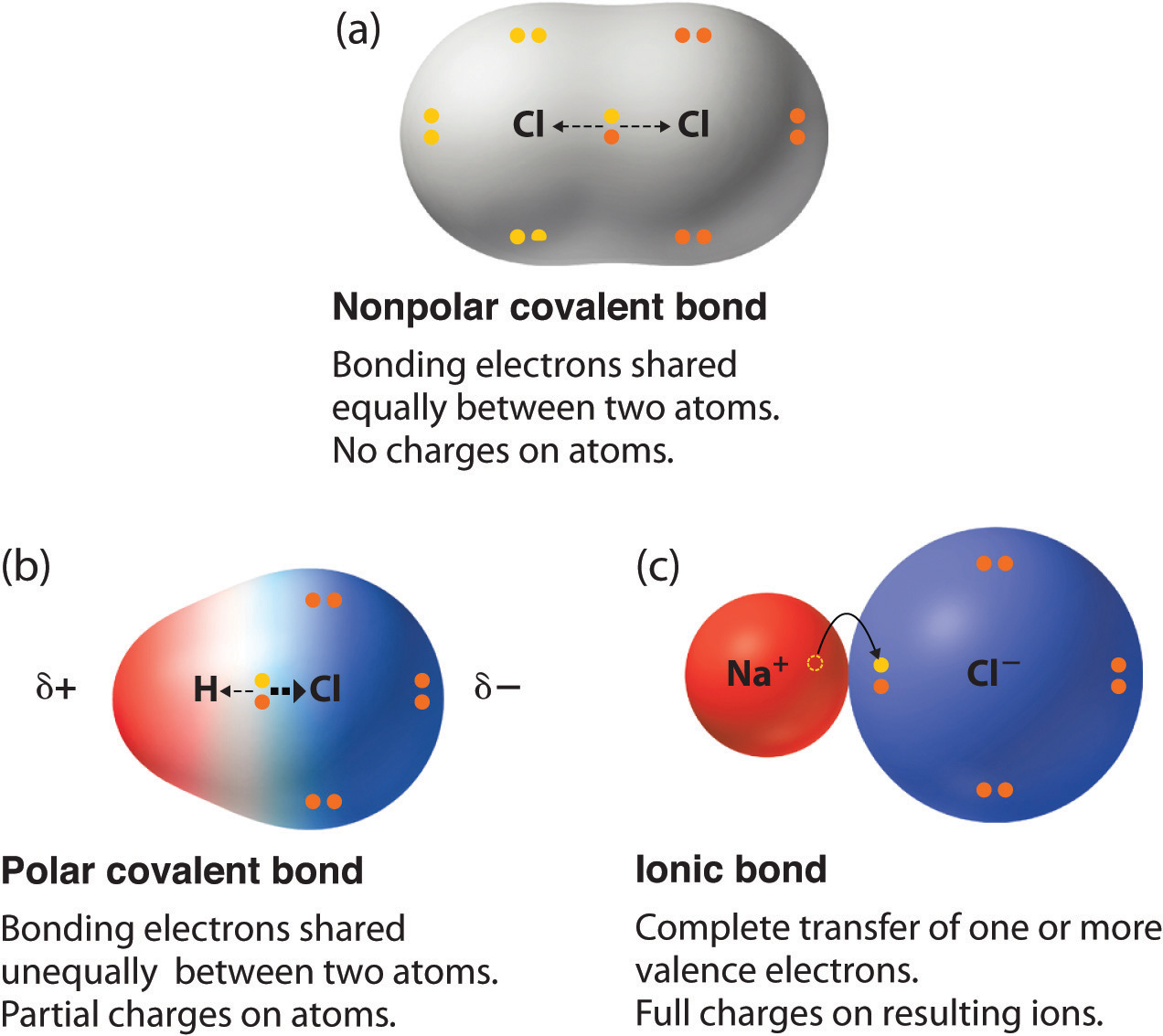
Полярність і структура молекул
Форма молекули І полярність її зв'язків. Молекула, яка містить полярні зв'язки, може не мати загальної полярності, залежно від її форми. Просте визначення того, чи є складна молекула полярною чи ні, залежить від того, чи перекриваються її загальні центри позитивних і негативних зарядів. Якщо ці центри лежать в одній точці простору, то молекула не має загальної полярності (і неполярна).
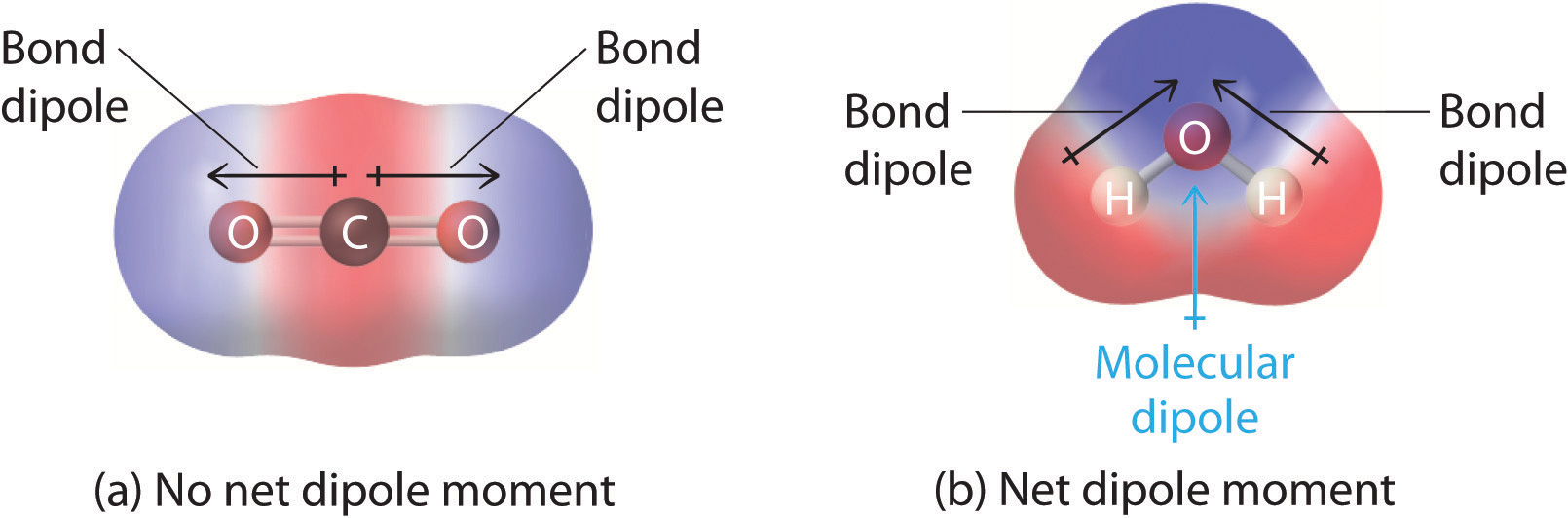
Якщо молекула повністю симетрична, то вектори дипольних моментів на кожній молекулі скасують один одного, роблячи молекулу неполярною. Молекула може бути полярною лише в тому випадку, якщо структура цієї молекули не симетрична.
Хорошим прикладом неполярної молекули, яка містить полярні зв'язки, є вуглекислий газ. Це лінійна молекула, а зв'язки C = O є, по суті, полярними. Центральний вуглець матиме чистий позитивний заряд, а два зовнішніх кисню - чистий негативний заряд. Однак, оскільки молекула лінійна, ці два диполя зв'язку скасовують один одного (тобто векторне додавання диполів дорівнює нулю). А загальна молекула не має диполя (μ = 0.
Хоча полярний зв'язок є необхідною умовою для того, щоб молекула мала диполь, не всі молекули з полярними зв'язками виявляють диполі