1.4: Електронні конфігурації та електронні орбітальні діаграми (огляд)
- Page ID
- 22777
Мета навчання
Малюйте, інтерпретуйте та перетворюйте між структурами Льюїса (Kekule), конденсованих та ліній зв'язку
Примітка: Огляд загальної хімії в розділах 1.3 - 1.6 інтегрований у вищезазначену ціль навчання з органічної хімії в розділах 1.7 та 1.8.
Електронна конфігурація атома являє собою представлення розташування електронів, розподілених між орбітальними оболонками і підоболонками. Зазвичай електронна конфігурація використовується для опису орбіталів атома в його основному стані, але вона також може бути використана для представлення атома, який іонізувався в катіон або аніон, компенсуючи втрату або посилення електронів на їх наступних орбіталах. Багато фізико-хімічні властивості елементів можуть бути співвіднесені з їх унікальними електронними конфігураціями. Валентні електрони, електрони в самій зовнішній оболонці, є визначальним фактором для унікальної хімії елемента.
Вступ
Перш ніж віднести електрони атома на орбіталі, потрібно ознайомитися з основними поняттями електронних конфігурацій. Кожен елемент Періодичної таблиці складається з атомів, які складаються з протонів, нейтронів та електронів. Електрони проявляють негативний заряд і знаходяться навколо ядра атома в електронних орбіталах, що визначаються як обсяг простору, в якому електрон може бути знайдений в межах 95% ймовірності. Чотири різних типи орбіталів (s, p, d і f) мають різну форму, і одна орбіталь може вмістити максимум два електрони. Орбіталі p, d і f мають різні підрівні, таким чином, можуть утримувати більше електронів.
Як зазначено, електронна конфігурація кожного елемента унікальна для його положення на таблиці Менделєєва. Рівень енергії визначається періодом і кількість електронів задається атомним номером елемента. Орбіталі на різних енергетичних рівнях схожі один на одного, але займають різні площі в просторі. Орбітальна та 2s орбітальна обидва мають характеристики s орбіти (радіальні вузли, сферичні об'ємні ймовірності, можуть утримувати лише два електрони тощо), але, оскільки вони зустрічаються на різних рівнях енергії, вони займають різні простори навколо ядра. Кожна орбіталь може бути представлена певними блоками таблиці Менделєєва. S-блок - це область лужних металів, включаючи гелій (групи 1 і 2), d-блок - перехідні метали (групи 3 до 12), p-блок є основними груповими елементами з груп 13 до 18, а f-блок - лантаноїди та актиніди ряду.
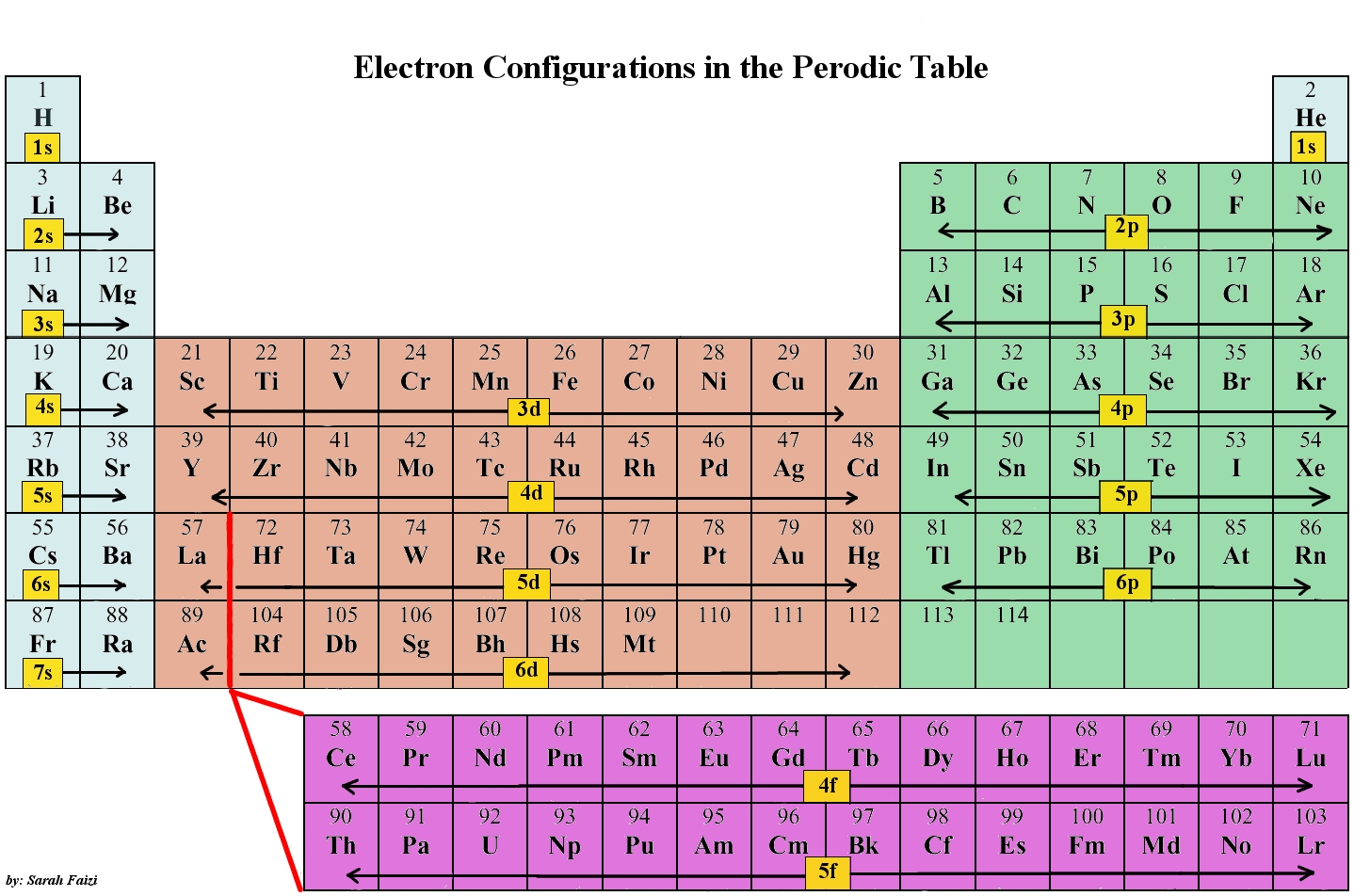
Використання таблиці Менделєєва для визначення електронних конфігурацій атомів є ключовим, але також майте на увазі, що існують певні правила, яких слід дотримуватися при призначенні електронів різним орбіталям. Періодична таблиця є неймовірно корисним інструментом у написанні електронних конфігурацій. Для отримання додаткової інформації про те, як пов'язані електронні конфігурації та періодична таблиця, відвідайте Модуль «Підключення електронів до періодичної таблиці».
Правила призначення електронних орбіталей
Заняття орбіталів
Електрони заповнюють орбіталі таким чином, щоб мінімізувати енергію атома. Тому електрони в атомі заповнюють основні енергетичні рівні в порядку збільшення енергії (електрони йдуть далі від ядра). Порядок заповнення рівнів виглядає наступним чином:
1с, 2с, 2р, 3с, 3р, 4с, 3д, 4р, 5с, 4д, 5р, 6с, 4ф, 5д, 6р, 6р, 7с, 5ф, 6д, і 7р
Один із способів запам'ятати цю закономірність, мабуть, найпростіший, - звернутися до таблиці Менделєєва і запам'ятати, куди падає кожен орбітальний блок, щоб логічно вивести цю закономірність. Інший спосіб - скласти таблицю, подібну до наведеної нижче, і за допомогою вертикальних ліній визначити, які підоболонки відповідають один одному.

Принцип виключення Паулі
Принцип виключення Паулі стверджує, що жоден з двох електронів не може мати однакових чотирьох квантових чисел. Перші три (n, l і m l) можуть бути однаковими, але четверте квантове число має бути іншим. Одна орбіталь може утримувати максимум два електрони, які повинні мати протилежні спини; інакше вони мали б однакові чотири квантові числа, що заборонено. Один електрон обертається вгору (m s = +1/2), а інший обертається вниз (m s = -1/2). Це говорить нам про те, що кожна підоболонка має подвійні електрони на орбіталі. Підоболонка s має 1 орбіталь, яка може вмістити до 2 електронів, p підоболонка має 3 орбіталі, які можуть утримувати до 6 електронів, d підоболонка має 5 орбіталів, які утримують до 10 електронів, а підоболонка f має 7 орбіталів з 14 електронами.
Приклад 1: Водень і гелій
Перші три квантові числа електрона - n=1, l=0, m l =0. Лише два електрони можуть відповідати цим, які були б або m s = -1/2 або m s = +1/2. Як ми вже знаємо з наших досліджень квантових чисел і електронних орбіталей, можна зробити висновок, що ці чотири квантові числа відносяться до підоболонки 1s. Якщо задано лише одне з значень m s, то ми мали б 1s 1 (позначаючи водень), якщо обидва дані, ми мали б 1s 2 (позначаючи гелій). Візуально це буде представлено у вигляді:
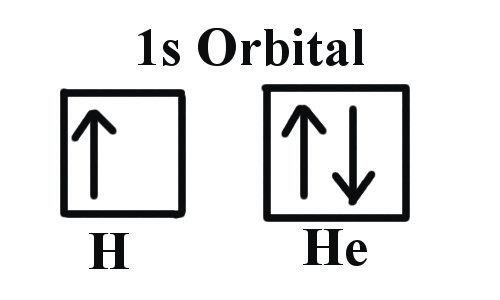
Як показано, підоболонка 1s може утримувати лише два електрони і при заповненні електрони мають протилежні спини.
Правило Гунда
При призначенні електронів на орбіталі кожен електрон спочатку заповнить всі орбіталі подібною енергією (також називають виродженою) перед сполученням з іншим електроном в напівзаповненій орбіталі. Атоми в наземних станах, як правило, мають якомога більше непарних електронів. Візуалізуючи ці процеси, подумайте про те, як електрони проявляють таку ж поведінку, як ті самі полюси на магніті, якби вони вступили в контакт; оскільки негативно заряджені електрони заповнюють орбіталі, вони спочатку намагаються отримати якомога далі один від одного, перш ніж мати пару.
Приклад 2: Кисень і азот
Якщо ми подивимося на правильну електронну конфігурацію атома азоту (Z = 7), дуже важливого елемента в біології рослин: 1s 2 2s 2 2p 3
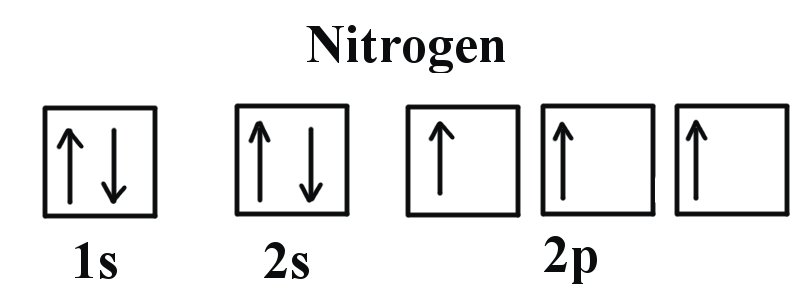
Ми можемо чітко бачити, що p орбіталі наполовину заповнені, оскільки є три електрони та три орбіталі p. Це тому, що Правило Гунда стверджує, що три електрони в підоболонці 2p спочатку заповнять всі порожні орбіталі перед заповненням орбіталів електронами в них. Якщо ми подивимося на елемент після азоту в той же період, Кисень (Z = 8) його електронна конфігурація становить: 1s 2 2s 2 2p 4 (для атома).
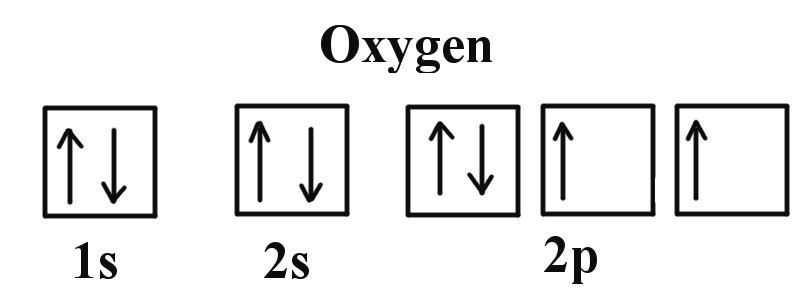
Кисень має на один електрон більше, ніж азоту, і оскільки орбіталі всі наполовину заповнені, електрон повинен з'єднатись.
Процес Ауфбау
Aufbau походить від німецького слова «aufbauen», що означає «будувати». При написанні електронних конфігурацій орбіталі будуються від атома до атома. При написанні електронної конфігурації для атома орбіталі заповнюються в порядку збільшення атомного номера. Однак є деякі винятки з цього правила.
Приклад 3: елементи 3-го ряду
Дотримуючись шаблону через період від B (Z=5) до Ne (Z=10), кількість електронів збільшується і підоболонки заповнюються. Цей приклад фокусується на підоболонці p, яка заповнює від бору до неону.
- B (Z = 5) конфігурація: 1s 2 2s 2 2p 1
- Конфігурація C (Z = 6): 1s 2 2s 2 2p 2
- N (Z = 7) конфігурація: 1s 2 2s 2 2p 3
- O (Z = 8) конфігурація: 1s 2 2s 2 2p 4
- F (Z = 9) конфігурація: 1s 2 2s 2 2p 5
- Нова (Z = 10) конфігурація: 1s 2 2s 2 2p 6
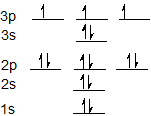
E приклад
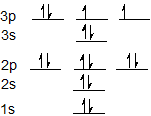
Електронна конфігурація для сірки становить 1s 2 2s 2 2p 6 3 s 2 3p 4 і може бути представлена за допомогою орбітальної діаграми нижче.
Вправи
Напишіть електронну конфігурацію фосфору і намалюйте орбітальну діаграму.
Рішення:
Конфігурація електронів для фосфору становить 1s 2, 2s, 2, 2p, 6 3 с. 2 3p 3 і орбітальна діаграма намальована нижче.