1.2: Принципи атомної структури (огляд)
- Page ID
- 22750
Мета навчання
- Використовуйте та застосовуйте мову атомної структури (атомний номер, масове число, ізотопи)
Точна фізична природа атомів нарешті виникла в результаті серії елегантних експериментів, проведених між 1895 і 1915 роками. Найбільш помітним з цих досягнень став знаменитий експеримент Ернеста Резерфорда з розсіювання альфа-променів 1911 року, який встановив, що
- Майже вся маса атома міститься в крихітному (і тому надзвичайно щільному) ядрі, яке несе позитивний електричний заряд, значення якого ідентифікує кожен елемент і відоме як атомний номер елемента.
- Майже весь обсяг атома складається з порожнього простору, в якому проживають електрони, основні носії негативного електричного заряду. Надзвичайно мала маса електрона (1/1840 маса водневого ядра) змушує його вести себе як квантова частинка, а це означає, що його розташування в будь-який момент неможливо вказати; найкраще, що ми можемо зробити, це описати його поведінку з точки зору ймовірності його прояву в будь-якій точці простору. Загальноприйнято (але дещо оманливе) описувати обсяг простору, в якому електрони атома мають значну ймовірність бути виявленими як електронна хмара. Останній не має певної зовнішньої межі, так само як і атом. Радіус атома повинен бути визначений довільно, наприклад, межа, в якій електрон може бути знайдений з 95% ймовірністю. Атомні радіуси зазвичай становлять 30-300 вечора.
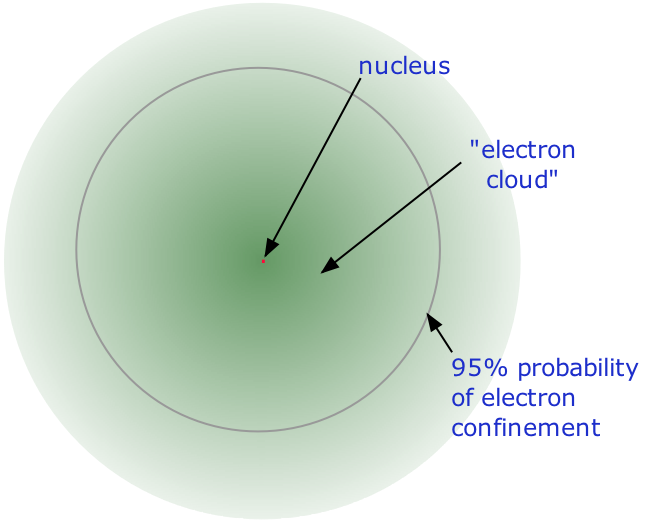
Саме ядро складається з двох видів частинок. Протони є носіями позитивного електричного заряду в ядрі; протонний заряд точно такий же, як і електронний заряд, але протилежного знака. Це означає, що в будь-якому [електрично нейтральному] атомі кількість протонів в ядрі (часто його називають ядерним зарядом) врівноважується однаковою кількістю електронів поза ядром. Інша ядерна частка - це нейтрон. Як випливає з назви, ця частинка не несе електричного заряду. Маса його майже така ж, як і у протона. Більшість ядер містять приблизно однакові числа нейтронів і протонів, тому можна сказати, що ці дві частинки разом складають майже всю масу атома.
Оскільки електрони атома контактують із зовнішнім світом, можна втратити один або кілька електронів або додати деякі нові. Отриманий електрично заряджений атом називається іоном.
Елементи
На сьогоднішній день виявлено близько 115 різних елементів; за визначенням кожен хімічно унікальний. Щоб зрозуміти, чому вони унікальні, потрібно розібратися в будові атома (фундаментальної, окремої частинки елемента) і характеристиках його складових. Атоми складаються з електронів, протонів і нейтронів. Хоча це надмірне спрощення, яке ігнорує інші субатомні частинки, які були виявлені, цього достатньо для обговорення хімічних принципів. Деякі властивості цих субатомних частинок зведені в таблицю\(\PageIndex{1}\), яка ілюструє три важливі моменти:
- Електрони та протони мають електричні заряди, однакові за величиною, але протилежні за знаком. Відносні заряди −1 і +1 присвоюються електрону і протону відповідно.
- Нейтрони мають приблизно таку ж масу, як протони, але без заряду. Вони електрично нейтральні.
- Маса протона або нейтрона приблизно в 1836 разів перевищує масу електрона. Протони і нейтрони складають основну частину маси атомів.
Відкриття електрона і протона мало вирішальне значення для розробки сучасної моделі атома і забезпечує відмінне тематичне дослідження в застосуванні наукового методу. Насправді з'ясування структури атома - одна з найбільших детективів в історії науки.
| Частинка | Маса (г) | Атомна маса (amu) | Електричний заряд (кулони) | Відносний заряд |
|---|---|---|---|---|
| електрон | \(9.109 \times 10^{-28}\) | 0,0005486 | −1,602 × 10 −19 | −1 |
| протона | \(1.673 \times 10^{-24}\) | 1 007276 | +1,602 × 10 −19 | +1 |
| нейтрон | \(1.675 \times 10^{-24}\) | 1,008665 | 0 | 0 |
У більшості випадків символи елементів походять безпосередньо від назви кожного елемента, наприклад C для вуглецю, U для урану, Ca для кальцію та Po для полонію. Елементи також були названі за їх властивості [такі як радій (Ra) за його радіоактивність], для рідної країни вченого (s), який їх відкрив [полоній (Po) для Польщі], для іменитих вчених [курій (Cm) для Кюрі], для богів і богинь [селен (Se) для грецької богині Місяця, Селена], і з інших поетичних чи історичних причин. Деякі символи, що використовуються для елементів, які були відомі з античності, походять від історичних назв, які більше не використовуються; залишаються лише символи для позначення їх походження. Прикладами є Fe для заліза, від латинського ferrum; Na для натрію, від латинського natrium; і W для вольфраму, від німецького вольфраму. Приклади наведені в таблиці\(\PageIndex{2}\).
| Елемент | Символ | деривація | Значення |
|---|---|---|---|
| сурму | Сб | стібіум | Латинська означає «mark» |
| мідь | Cu | міді | від Cyprium, латинська назва острова Кіпр, основного джерела мідної руди в Римській імперії |
| золото | Au | аурум | Латинська означає «золото» |
| залізо | Fe | залізо | Латинська означає «залізо» |
| свинець | Пб | схил | Латинська означає «важкий» |
| ртуті | Hg | водраргирум | Латинська означає «рідке срібло» |
| калій | К | калій | від арабської al-qili, «луг» |
| срібло | Ag | Argentum | Латинська означає «срібло» |
| натрію | Na | натрій | Латинська означає «натрій» |
| олово | Сн | олова | Латинська означає «олово» |
| вольфраму | Ш | вольфрам | Німецьким для «вовчого каменю», тому що він заважав виплавці олова і вважалося, що пожирає олово |
Нагадаємо, що ядра більшості атомів містять нейтрони, а також протони. На відміну від протонів, кількість нейтронів не є абсолютно фіксованим для більшості елементів. Атоми, які мають однакову кількість протонів, а значить і однаковий атомний номер, але різну кількість нейтронів, називаються ізотопами. Всі ізотопи елемента мають однакову кількість протонів і електронів, а значить, вони демонструють однакову хімію. Ізотопи елемента відрізняються тільки своєю атомною масою, яка задається числом маси (А), сумою чисел протонів і нейтронів.
Елемент вуглець (С) має атомний номер 6, а це означає, що всі нейтральні атоми вуглецю містять 6 протонів і 6 електронів. У типовому зразку вуглецевмісного матеріалу 98,89% атомів вуглецю також містять 6 нейтронів, тому кожен має масове число 12. Ізотоп будь-якого елемента може бути однозначно представлений як\(^A_Z X\), де X - атомний символ елемента. Таким чином, ізотоп вуглецю, який має 6 нейтронів\(_6^{12} C\). Індексит, що вказує на атомний номер, насправді надлишковий, оскільки атомний символ вже однозначно вказує Z. отже,\(_6^{12} C\) частіше пишеться як 12 C, що читається як «вуглець-12». Тим не менш, значення Z зазвичай включається в позначення для ядерних реакцій, оскільки ці реакції включають зміни в Z.
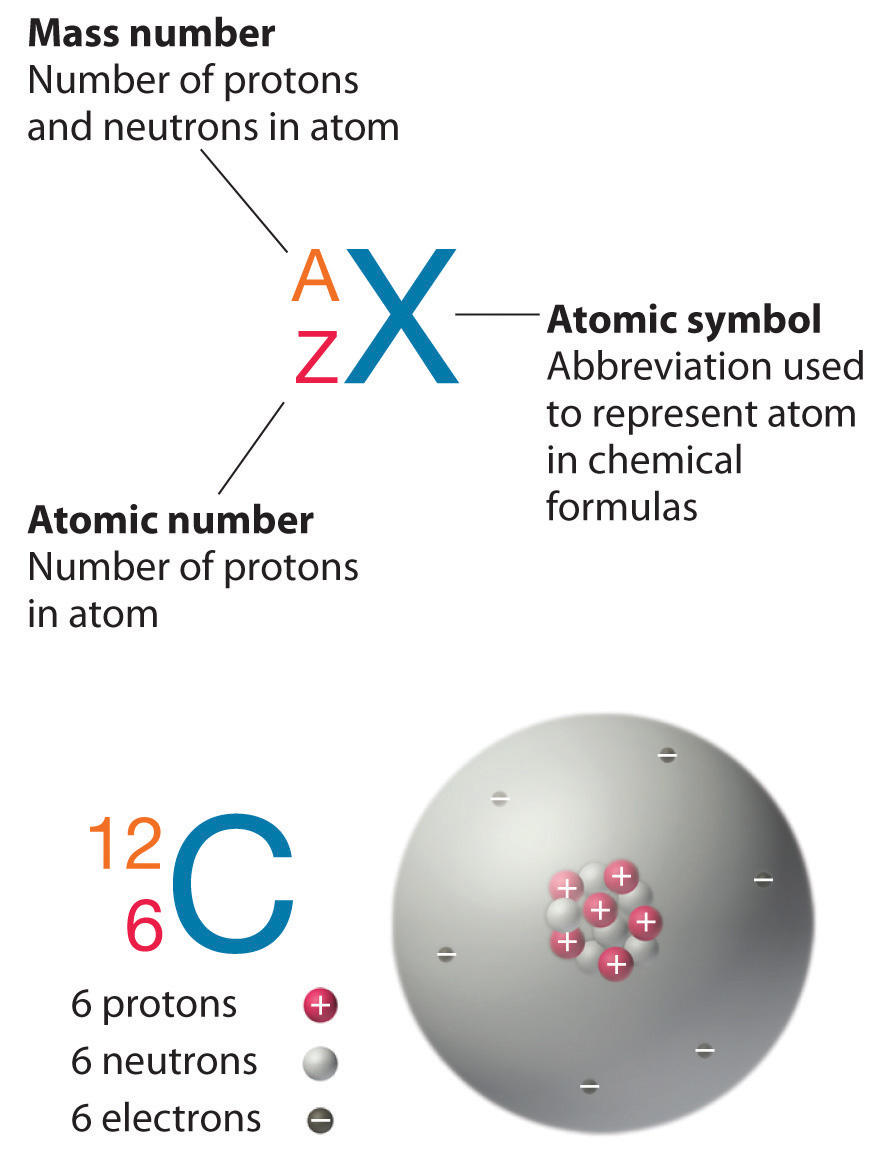
Крім того\(^{12}C\), типовий зразок вуглецю містить 1,11%\(_6^{13} C\) (13 С), з 7 нейтронами і 6 протонами, і слід\(_6^{14} C\) (14 С), з 8 нейтронами і 6 протонами. Однак ядро 14 С не є стабільним, але зазнає повільного радіоактивного розпаду, що є основою методики датування вуглець-14, використовуваної в археології. Багато елементів, крім вуглецю, мають більше одного стабільного ізотопу; олово, наприклад, має 10 ізотопів. Властивості деяких поширених ізотопів наведені в табл.\(\PageIndex{3}\).
| Елемент | Символ | Атомна маса (amu) | Ізотоп Масове число | Ізотопні маси (аму) | Відсоток достатку (%) |
|---|---|---|---|---|---|
| водню | Ч | 1.0079 | 1 | 1,007825 | 99.9855 |
| 2 | 2.014102 | 0.0115 | |||
| бор | Б | 10.81 | 10 | 10.012937 | 19.91 |
| 11 | 11.009305 | 80.09 | |||
| вуглець | C | 12.011 | 12 | 12 (визначено) | 99.89 |
| 13 | 13.00355 | 1.11 | |||
| кисень | O | 15.9994 | 16 | 15.99 4915 | 99.757 |
| 17 | 16.999132 | 0,0378 | |||
| 18 | 17.999161 | 0,205 | |||
| залізо | Fe | 55.845 | 54 | 53 939611 | 5.82 |
| 56 | 55.934938 | 91.66 | |||
| 57 | 56.935394 | 2.19 | |||
| 58 | 57,933 276 | 0,33 | |||
| уран | У | 238.03 | 234 | 234.040952 | 0,0054 |
| 235 | 235.043930 | 0,7204 | |||
| 238 | 238.050788 | 99.274 |
Джерела ізотопних даних: G. Audi et al., Ядерна фізика A 729 (2003): 337—676; J. C. Kotz і K.F. Purcell, Хімія та хімічна реакційна здатність, 2-е видання, 1991.
Приклад\(\PageIndex{1}\)
Елемент з трьома стабільними ізотопами має 82 протони. Окремі ізотопи містять 124, 125 і 126 нейтронів. Визначте елемент і напишіть символи для ізотопів.
Задано: кількість протонів і нейтронів
Запитано: елемент і атомний символ
Стратегія:
- Зверніться до таблиці Менделєєва і використовуйте кількість протонів для ідентифікації елемента.
- Обчисліть масове число кожного ізотопу, склавши разом числа протонів і нейтронів.
- Дайте символ кожного ізотопу з масовим числом у вигляді верхнього індексу та кількістю протонів як індекс, обидва записані зліва від символу елемента.
Рішення:
A Елемент з 82 протонами (атомний номер 82) - свинець: Pb.
B Для першого ізотопу A = 82 протони+124 нейтрони = 206. Аналогічно, А = 82 + 125 = 207 і А = 82 + 126 = 208 для другого і третього ізотопів відповідно. Символами для цих ізотопів є\(^{206}_{82}Pb\)\(^{207}_{82}Pb\), і\(^{208}_{82}Pb\), які зазвичай скорочуються як\(^{206}Pb\)\(^{207}Pb\), і\(^{208}Pb\).
Вправа\(\PageIndex{1}\)
Визначте елемент з 35 протонами і напишіть символи для його ізотопів з 44 і 46 нейтронами.
- Відповідь
-
\(\ce{^{79}_{35}Br}\)і\(\ce{^{81}_{35}Br}\) або, частіше,\(\ce{^{79}Br}\) і\(\ce{^{81}Br}\).
Резюме
Атом складається з дискретних частинок, які керують його хімічною та фізичною поведінкою. Кожен атом елемента містить однакову кількість протонів, що є атомним номером (Z). Нейтральні атоми мають однакову кількість електронів і протонів. Атоми елемента, що містять різну кількість нейтронів, називаються ізотопами. Кожен ізотоп даного елемента має однаковий атомний номер, але різне масове число (A), яке є сумою чисел протонів і нейтронів. Відносні маси атомів повідомляються за допомогою атомної одиниці маси (amu), яка визначається як одна дванадцята маси одного атома вуглецю-12, з 6 протонами, 6 нейтронами та 6 електронами.