9.6: Порівняння сірки з киснем
- Page ID
- 17854
Розмір
Таблиця\(\PageIndex{1}\) узагальнює порівняльні розміри кисню і сірки.
| Елемент | Атомний радіус (Å) | Ковалентний радіус (Å) | Іонний радіус (Å) | Радіус ван дер Ваал (Å) |
| Кисень | 0,48 | 0.66 | 1.40 | 1.52 |
| Сірка | 0,88 | 1.05 | 1.84 | 1.80 |
Електронегативність
Сірка менш електронегативна, ніж кисень (2,4 і 3,5 відповідно) і як наслідок зв'язки з сіркою менш полярні, ніж відповідні зв'язки з киснем. Один істотний результат полягає в тому, що при менш полярному зв'язку S-H подальше водневе зв'язування слабкіше, ніж спостерігається з O-H аналогами. Подальшим наслідком нижньої електронегативності є те, що зв'язок S-O полярна.
Утворені облігації
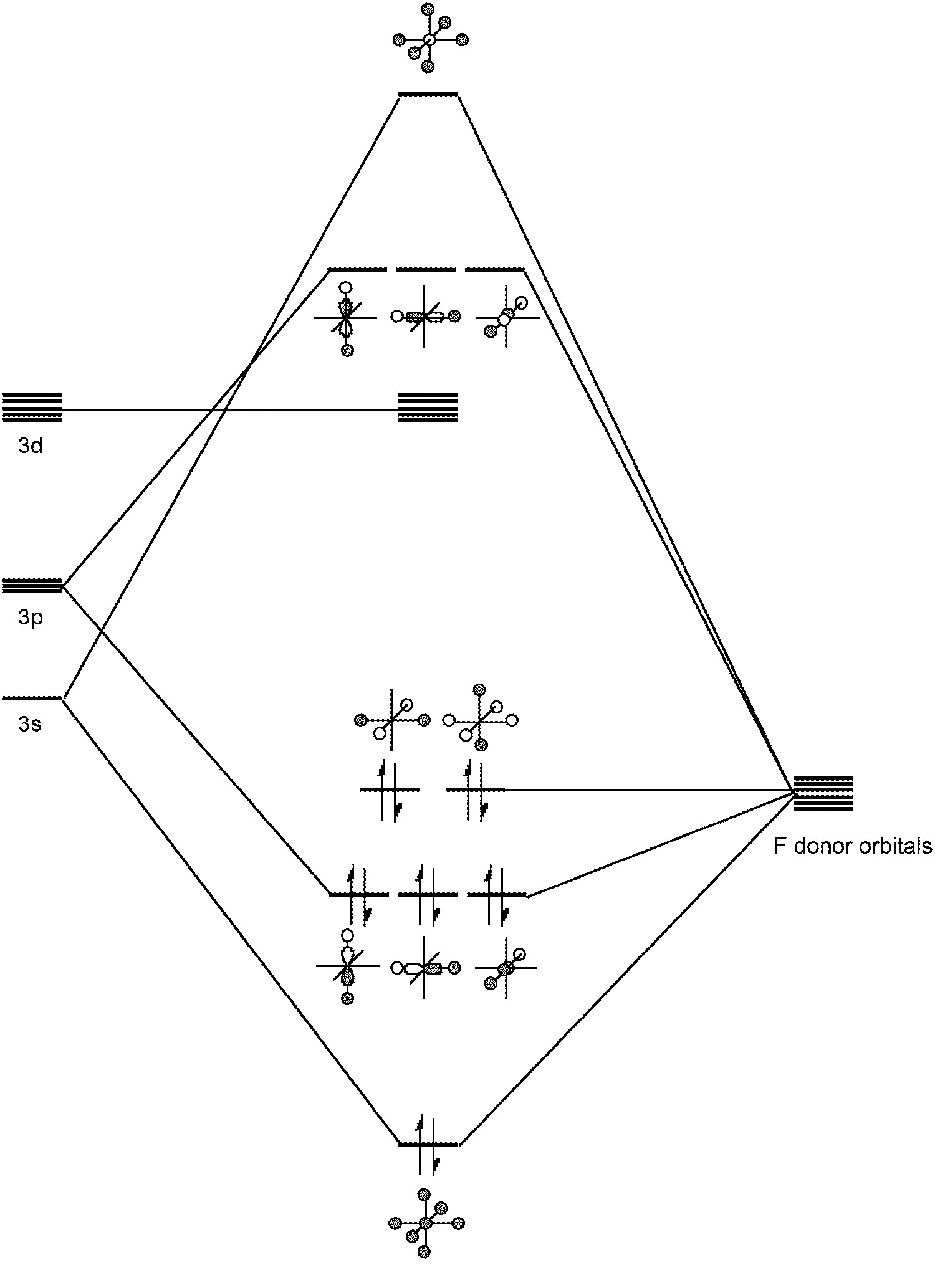
Сірка утворює цілий ряд типів склеювання. Як і у випадку з киснем, переважає ступінь окислення -2. Наприклад, сірка утворює аналоги ефірів, тобто тіоефіри R-S-R. Однак, на відміну від кисню, сірка може утворювати більше двох ковалентних (недавальних) зв'язків, тобто в таких сполуках, як SF 4 і SF 6.
Такі гіпервалентні сполуки спочатку вважалися обумовленими включенням орбіталів з низькою енергією d в гібриди (наприклад, sp 3 d 2 для SF 6); однак краща картина передбачає поєднання s і p Ортбіталі в склеюванні (рис.\(\PageIndex{1}\)). Будь-яке залучення орбіталів d обмежується поляризацією p орбіталів, а не прямим гідридизацією. У зв'язку з цим SF 6 представляє архетипічну гіпервалентну молекулу. Нарешті, сірка може утворювати кілька зв'язків, наприклад, Me 2 S=O.
Катенація
Катенація визначається як здатність хімічного елемента утворювати довгу ланцюгоподібну структуру за допомогою ряду ковалентних зв'язків. Ступінь катенації кисню обмежується озоном (O 3) та пероксидами (наприклад, R-O-O-R). На відміну від цього, хімія сірки багата утворенням множинних S-S-зв'язків.
Хоча елементарна сірка існує як двоатомна молекула (тобто S 2) у газовій фазі при високих температурах, пари сірки складаються з суміші олігомерів (S 3 до S 8) як рівноваги, залежної від температури. У твердому стані домінує утворення Sn, а сірка існує як діапазон поліморфів, в яких розширений зв'язок S-S відбувається або в кільцях від 6 до 20 атомів (наприклад, рис.\(\PageIndex{2}\)) або ланцюгах (катенасірка).

Більш високий рівень катенації сірки обумовлений більшою міцністю зв'язку S-S (226 кДж/моль) порівняно з O-O зв'язком (142 кДж/моль). Загалом, очікується, що гомолептична міцність зв'язку зменшиться в період Періодичної таблиці. Причина несподіваної слабкості зв'язку O-O полягає в тому, що електронегативні атоми кисню відштовхують один одного і тим самим послаблюють зв'язок.
