9.4: Перекис водню
- Page ID
- 17837
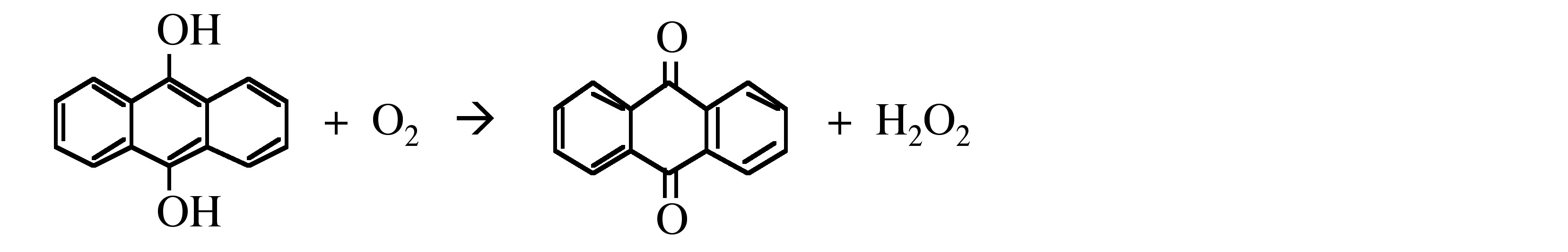
Перекис водню (H 2 O 2) - дуже блідо-блакитна рідина, але виявляється безбарвною в розведеному розчині. Його готують шляхом окислення антрахінолу (показано нижче). Перекис водню екстрагують водою з розчину антрахінону і 20 - 40% розчин очищають шляхом екстракції розчинником. Альтернативний процес включає окислення ізопропанолу або в парній, або в рідкій фазі при 100° C і приблизно 15 атм, (9.4.1). Вироби відокремлюються шляхом фракційної перегонки.
\[ \rm Me_2C(H)OH + O_2 \rightarrow Me_2C(OOH)OH \rightarrow Me_2\text{C=O} + H_2O_2\]
У газовій фазі H 2 O 2 приймає конформацію Gauche (рис.\(\PageIndex{1}\)), але існує лише низький бар'єр для обертання навколо зв'язку O-O.

Перекис водню - рідина при стандартній температурі і тиску (25° C, 1 атм) завдяки наявності міцного водневого зв'язку, подібного до виявленого у воді. Насправді діапазон рідини для H 2 O 2 (Mp = -0.43° C, Bp = 150.2° C) насправді ширший, ніж вода, і він трохи більш в'язкий, ніж вода. Перекис водню має щільність 1,44 г/см 3, і в 10 6 разів менше основної, ніж вода.
Як і у випадку з водою, H 2 O 2 є хорошим розчинником через свою полярну природу та широкий діапазон температур рідини, однак, він небезпечний у чистому стані завдяки легкому (ΔH = -99 кДж/моль) автоматичного розкладання, (9.4.2), а також сильною окислювальною природою.
\[ \rm 2 H_2O_2 \rightarrow 2 H_2O + O_2\]
Перекис водню зазвичай продається у вигляді 3 - 12% розчину для домашнього використання; однак лабораторні та певні промислові застосування вимагають 30% -них розчинів.
Примітка
Перекис водню слід зберігати в прохолодному, сухому, добре провітрюваному приміщенні і подалі від будь-яких легкозаймистих або горючих речовин. Його слід зберігати в контейнері, що складається з нереактивних матеріалів, таких як нержавіюча сталь або скло (інші матеріали, включаючи деякі пластмаси та алюмінієві сплави, також можуть бути придатними). Оскільки він швидко руйнується під впливом світла, його слід зберігати в непрозорому контейнері, а фармацевтичні склади зазвичай поставляються у коричневих пляшках, які фільтрують світло.
Водні розчини слабокислі (К = 1,5 х 10 -12), (9,4,3). Однак не відбувається обміну атомами кисню між H 2 O 2 і H 2 O в рідкій фазі.
\[ \rm H_2O_2 + H_2O \rightleftharpoons HO_2^- + H_3O^+\]
Як і очікувалося, перекис водню є сильним окислювачем (9.4.4), однак він також може діяти як відновник (9.4.5).
\[ \rm H_2O_3 + 2 HI \rightarrow I_2 + 2 H_2O \]
\[ \rm 5 H_2O_2 + 2 MnO_4 + 6 H^+ \rightarrow 2 Mn^{2+} + 8 H_2O + 5 O_2 \uparrow \]
