7.4: Азотні сполуки вуглецю
- Page ID
- 17999
Існує безліч органічних сполук, що містять вуглецево-азотні зв'язки, включаючи: аміни, іміни та нітрили. Однак тут мова йде про найпростіших вуглецево-азотних сполуках.
Ціаноген
Ціаноген, (CN) 2, можна вважати найменшим молекулярним фрагментом, що містить вуглець і азот (рис.\(\PageIndex{1}\) А). Хімія реакції ціаногену пов'язана з хімією галогенів, тобто F 2, Cl 2 тощо Отже, ціаноген називається псевдогалогеном.

Як показано в таблиці\(\PageIndex{1}\), зв'язок у ціаногені узгоджується з локалізацією π-зв'язку між вуглецем і азотом, враховуючи подібність відстані зв'язку C-N у ціаногенах і ацетонітрилі. Однак чітко існує певна π-делокалізація, пов'язана з відстанню C-C, враховуючи його скорочення порівняно з етаном.
| З'єднання | Формула | Відстань зв'язку C-C (Å) | Відстань зв'язку C-N (Å) |
| Ціаноген | (СН) 2 | 1.393 | 1.163 |
| Ціаністий водень | HCN | - | 1.154 |
| ацетонітрил | СН 3 СН | 1.46 | 1.16 |
| Етан | С 2 Ч 6 | 1.535 | - |
| Етилен | С 2 Ч 4 | 1,339 | - |
Ціаноген виробляється реакцією суміші ціаніду і хлориду ртуті, (7.4.1).
\[ \text{Hg(CN)}_2 \text{ + HgCl}_2 \rightarrow \text{(CN)}_2 \text{ + 2 Hg + Cl}_2\]
Як варіант, при розкладанні нестійкого ціаніду міді (II), утвореного з солей міді (II) з ціанідом 1 групи, (7.4.2), виходить ціаногени, (7.4.3).
\[ \text{CuSO}_4\text{ + 2 KCN} \rightarrow \text{Cu(CN)}_2\text{ + K}_2\text{SO}_4\]
\[\text{2 Cu(CN)}_2 \rightarrow \text{(CN)}_2 \text{ + 2 CuCN}\]
Ціаноген - це легкозаймистий газ (Mp = -28° C і Bp = -21° C), який виробляє друге гаряче полум'я природного полум'я (після субнітриду вуглецю, C 4 N 2) з температурою понад 4525° C при спалюванні в кисні. Нагрівання ціаногену при відсутності кисню призводить до самополімеризації.

Гідроліз ціаногену призводить додатково через потрійні зв'язки вуглець-азот та утворення оксаміду. Розщеплення зв'язку С-С відбувається в присутності основи (наприклад, КОН), з утворенням ціанідних (CN -) і ціанатних (CNO -) солей, (7.4.4).

\[ \text{(CN)}_2\text{ + 2 OH}^- \rightarrow \text{CN}^-\text{ + CNO}^- \text{ + H}_2\text{O}\]
диціаноацетилен
Диціаноацетилен (також відомий як субнітрид вуглецю або за назвою IUPAC, бут-2-інединітрил) має структуру, показану на малюнку\(\PageIndex{1}\) b, і може розглядатися як ацетилен, замінений диціанаїдом.
При кімнатній температурі диціаноацетилен є прозорою рідиною, однак твердий диціаноацетилен був виявлений в атмосфері Титану (найбільшого місяця планети Сатурн) методом інфрачервоної спектроскопії. Диціаноацетилен є ентропною вибуховою речовиною, що дає вуглецевий порошок і газ азоту. У присутності кисню горить яскравим синьо-білим полум'ям при температурі 4990 °С.
Ціаністий водень
Ціаністий водень (HCN) - безбарвний, сильно отруйний газ (Mp = -13,5° C і Bp = 25,6° C). Завдяки своєму оригінальному виділенню з прусського блакитного (гідратований ферроціанід заліза) ціанаїд водню також відомий під назвою синильної кислоти.
Синтез ціаністого водню здійснюється комерційно шляхом часткового окислення метану в присутності аміаку (7.4.5) з використанням платинового каталізатора. Тепло для активації реакції отримується від часткового згоряння метану та аміаку. Отриманий водний розчин сушать дистильованим з п'ятиоксиду фосфору (P 2 O 5) з отриманням безводного ціаністого водню.
\[ \text{2 CH}_4 \text{ + 3 O}_2\text{ + 2 NH}_3 \rightarrow \text{ 2 HCN + 6 H}_2\text{O}\]
Ціаністий водень може утворюватися і при відсутності кисню (7.4.6); однак в цьому випадку реакція повинна нагріватися зовні.
\[ \text{CH}_4 \text{ + NH}_3 \rightarrow \text{ HCN + 3 H}_2 \]
Невеликі кількості ціаністого водню для лабораторного застосування можуть бути отримані реакцією кислоти з сіллю ціаніду (або калієм, або натрієм), (7.4.7).
\[\text{KCN + H}^+ \rightarrow \text{HCN + K}^+\]
Структура ціаністого водню показана на малюнку\(\PageIndex{2}\) разом з його ізомерною формою, ізоціанідом водню (HNC). У той час як ціаністий водень присутній в ямах багатьох фруктів і утворюється палаючою моллю та деякими багатоніжками, ізоціанід водню міститься лише в міжзоряному просторі. Однак постулюється, що поряд з HCN, HNC є важливим будівельним блоком для амінокислот і, отже, життя.

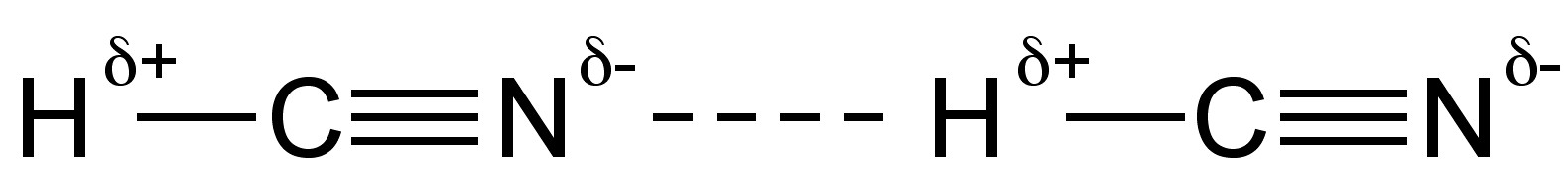
У рідкому стані ціаністий водень утворює міцні водневі зв'язки (рис.\(\PageIndex{3}\)). Ціаністий водень є хорошим розчинником для полярних сполук завдяки високій діелектричній проникності (r) та високому дипольному моменту (2,98 D).
У водному розчині ціаністий водень є слабкою кислотою, (7.4.7), і відомо кілька солей. Однак HCN також реагує з водою, щоб дати формід амонію через формамід, (7.4.8).
\[ \text{HCN + H}_2\text{O} \rightleftharpoons \text{H}_3\text{O}^+ \text{ + CN}^- \]
\[ \text{HCN + H}_2\text{O} \rightarrow \text{HC(O)NH}_2 \xrightarrow{\text{H}_2\text{O}} \text{HCO}_2^- \text{ + NH}_4^+\]
Подібно до відношення ціаногену до галогенів, ціанідний аніон (CN -) вважається псевдогалогенідом (тобто F -, Cl - тощо), і як такий утворює багато координаційних сполук, наприклад, [Fe (CN) 6] 3- і [Ag (CN) 2 ] -.
Вбивство, страта та Голокост
Ціаністий водень є смертельним для людини через пригнічення ферменту цитохрому с оксидази іоном ціаніду (CN -), що призводить до зупинки клітинного дихання. Концентрація 300 мг/м 3 вб'є протягом 10 хвилин, тоді як 3200 мг/м 3 (приблизно 3500 проміле) буде смертельною приблизно через 1 хвилину.
Симптоми отруєння ціанідом виявляються схожими на інфаркт і це призвело до того, що він є отрутою вибору як для вигаданих вбивств таємничих письменників, так і для колишнього КДБ (Конітет державної безпеки або Комітету державної безпеки) і його попередника СМЕРШ ( від скорочення smert shpionam означає смерть шпигунам) в реальному житті. Ймовірно, найвідомішим використанням ціаніду водню для вбивства стало використання розпилювача туману агентом КДБ Богданом Сташинським для вбивства українського політичного письменника та антикомуніста Льва Ребета у 1957 році, а згодом у 1959 році — українського товариша Степана Бандери. В обох випадках намір полягав у тому, щоб викликати зупинку серця і зробити так, ніби жертва померла від серцевого нападу.
Без сумніву, найбільш горезвісне використання ціаністого водню - у вигляді продукту Zyklon B, який спочатку розроблявся як інсектицид. Доктор Вальтер Хердт виявив, що ціаністий водень може поглинатися на такі субстрати, як абсорбуючі гранули (наприклад, кремнезем), волокна або діатомову землю (рис.\(\PageIndex{4}\)). Будучи стабільним у герметичному контейнері, після відкриття виділяється ціаністий водень. «B» в торговому найменуванні походить від німецької назви синильної кислоти (загальна назва ціаністого водню), тобто Blausäure означає блакитну кислоту.

Перше оптове використання Zyklon B було фактично в США, де його використовували ще в 1929 році для дезінфекції вантажних поїздів та тканин мексиканських іммігрантів, що в'їжджають до США. Перше використання Zyklon B в концтаборах під час Другої світової війни було з аналогічною метою (зокрема, для делусації для боротьби з тифом); однак для його використання як інсектициду Zyklon B містив попереджувальний одорант. Навмисне виготовлення Zyklon B без одоранту призвело до того, що матеріал був використаний на групі з 250 циганських дітей в концтаборі Бухенвальд на початку 1940 року. Згодом у вересні 1940 року в Освенцимі було вбито аналогічну кількість хворих польських військовополонених і 600 радянських військовополонених (рис.\(\PageIndex{5}\)). Після того, як ці жахливі випробування були проведені, систематичне вбивство мільйонів людей, включаючи євреїв, циган та гомосексуалістів, було здійснено за допомогою Zyklon B в Освенцімі, Майданеку, Заксенгаузені та одному з таборів операції Рейнхард. Цілком доречно, що багато архітекторів Голокосту самі загинули від ціаніду, в тому числі: Адольф Гітлер (крім кулі), Джозеф Гебблс, Герман Герінг, Генріх Гіммлер.

Незважаючи на жах, пов'язаний із застосуванням ціаністого водню для Голокосту, він був використаний 11 штатами США для смертної кари (рис.\(\PageIndex{6}\)). Арізона, Меріленд та Міссурі зберігають газову камеру як вторинний спосіб виконання, хоча вони мають смертельну ін'єкцію як основний метод. Гранули ціаністого калію (KCN) поміщаються в відсік безпосередньо під стільцем в газовій камері. Потім засудженого прив'язують до крісла, а герметичну камеру герметизують. Потім концентровану сірчану кислоту (H 2 SO 4) виливають по трубці на гранули ціаніду з утворенням ціаністого водню (7.4.7). Виконання газовою камерою особливо неприємно для свідків страти через фізичні реакції, виставлені в процесі вмирання, в тому числі: судоми і надмірне слинотеча.

Бібліографія
- Дж. Ву та Н.Дж. Еванс, Астрофія. Дж., 2003, 592, L79.
