7.3: Вуглецеві наноматеріали
- Page ID
- 18000
Фуллерени та нанотрубки
Вступ
Хоча наноматеріали були відомі протягом багатьох років до доповіді C 60, область нанорозмірної науки, безсумнівно, була заснована на цьому насіннєвому відкритті. Частиною причини цього вибуху в нанохімії є те, що, хоча вуглецеві матеріали варіюються від чітко визначених молекул нано розміру (тобто C 60) до трубок довжиною в сотні мікрон, вони не виявляють нестабільності інших наноматеріалів внаслідок дуже високих бар'єрів активації до їх структурної перестановки. Як наслідок, вони дуже стабільні навіть у своїх нефункціоналізованих формах. Незважаючи на такий діапазон вуглецевих наноматеріалів, вони демонструють загальну хімію реакцій: хімію органічної хімії.
Невідомий раніше аллотроп вуглецю: C 60, був відкритий в 1985 році, а в 1996 році Керл, Крото і Смоллі були удостоєні Нобелівської премії з хімії за відкриття. Іншими аллотропами вуглецю є графіт (sp 2) і алмаз (sp 3). C 60, широко відомий як «buckyball» або «Buckminsterfullerene», має сферичну форму, що складається з високо пірамідалізованих атомів вуглецю sp 2. Варіант C 60 часто порівнюють з типовим футбольним футболом, отже, бакібол. Однак, як не дивно, цей термін зазвичай використовується для вищих похідних. Фуллерени схожі за структурою листа на графіт, але вони містять п'ятикутні (або іноді гептагональні) кільця, які перешкоджають площинному аркушу. Незвичайна структура С 60 призвела до введення нового класу молекул, відомих як фулерени, які зараз становлять третій алотроп вуглецю. Фуллерени зазвичай визначаються як «будь-який із класу замкнутих порожнистих ароматичних вуглецевих сполук, які складаються з дванадцяти п'ятикутних та різних чисел гексагональних граней».
Кількість атомів вуглецю в фулерені коливається від C 60 до C 70, C 76 і вище. Фуллерени вищого порядку включають вуглецеві нанотрубки, які можна описати як фулерени, які були розтягнуті вздовж осі обертання, утворюючи трубку. Як наслідок відмінностей у хімії фулеренів, таких як C 60 та C 70, порівняно з нанотрубками, вони будуть розглянуті окремо тут. Крім того, були також повідомлення про нанороги та нановолокна, однак вони можуть розглядатися як варіації на загальну тему. Слід зазначити, що було показано, що фулерени та нанотрубки знаходяться у полум'ї, що утворюється при спалюванні вуглеводнів. На жаль, ці природні сорти можуть бути дуже нерегулярними за розміром і якістю, а також утворюватися в сумішах, що робить їх непридатними як для досліджень, так і для промислового застосування.
Фуллерени
Вуглець-60 (С 60), мабуть, найбільш вивчений індивідуальний тип наноматеріалу. Сферична форма С 60 побудована з дванадцяти п'ятикутників і двадцяти шестикутників і нагадує футбольний м'яч (рис\(\PageIndex{1}\). Наступним стабільним вищим фулереном є C 70 (рис.\(\PageIndex{1}\) b), який має форму регбі або американського футболу. Прогресування вищих фулеренів триває в послідовності С 74, С 76, С 78 і т.д. структурна залежність між кожним передбачає додавання шести членних кілець. Математично (і хімічно) два принципи визначають існування стійкого фулерена, тобто теореми Ейлера і ізольованого правила п'ятикутника (IPR). Теорема Ейлера стверджує, що для закриття кожної сферичної мережі потрібні n (n ≥ 2) шестикутників та 12 п'ятикутників, тоді як IPR говорить, що два п'ятикутники не можуть бути пов'язані безпосередньо один з одним, оскільки дестабілізація викликана двома сусідніми п'ятикутниками.

Хоча фулерени складаються з вуглецю sp 2 аналогічно графіту, фулерени розчинні в різних загальних органічних розчинниках. Завдяки своїй гідрофобній природі фулерени найбільш розчинні в CS 2 (C 60 = 7,9 мг/мл) і толуолі (C 60 = 2,8 мг/мл). Хоча фулерени мають кон'юговану систему, їх ароматичність відрізняється від бензолу, який має всі C-C зв'язки однакової довжини, в фулеренах існують два різних класи зв'язків. Більш короткі зв'язки знаходяться на стиках двох шестикутників ([6, 6] зв'язків) і довших зв'язків на стиках шестикутника і п'ятикутника ([5,6] зв'язків). Ця різниця в склеюванні відповідає за деяку спостережувану реактивність фулеренів.
синтез фулеренів
Перше спостереження фулеренів було в експериментах з молекулярним пучком в Університеті Райса. Наступні дослідження показали, що C 60 було відносно легко виробляти грами фулеренів. Хоча синтез є відносно простим очищення фулерену залишається проблемою і визначає комерційну ціну фуллерена. Перший спосіб отримання вимірюваних кількостей фулеренів використовував лазерне випаровування вуглецю в інертній атмосфері, але при цьому утворюються мікроскопічні кількості фулеренів. Лабораторні ваги фулерену отримують шляхом випаровування вуглецевих стрижнів в гелієвій атмосфері. Комерційне виробництво зазвичай використовує просту дугу змінного або постійного струму. Фуллерени в зібраній чорній сажі витягуються в толуолі і очищаються рідинною хроматографією. Пурпурний C 60 спочатку відривається від колонки, а потім червоний C 70 та інші вищі фулерени. Незважаючи на те, що механізм вуглецевої дуги відрізняється від механізму резистивно нагрітого вуглецевого стрижня (оскільки він включає плазму), тиск He для оптимального утворення C 60 дуже схожий.
Співвідношення між масою фулеренів і загальною масою вуглецевої сажі визначає вихід фулерену. Урожайність, що визначається поглинанням ультрафіолетового випромінювання, становить приблизно 40%, 10-15% та 15% у лазерних, електричних дугових та сонячних процесах. Цікаво, що техніка лазерної абляції має як найвищу врожайність, так і найнижчу продуктивність, і, отже, масштабування до більшої потужності є дорогим. Таким чином, комерційне виробництво фулерену є складним завданням. Перший у світі завод з виробництва фулерену з комп'ютерним управлінням зараз працює в MER Corporation, яка стала піонером першого комерційного виробництва фулерену та фулерену.
Ендоедричні фулерени
Ендоедричні фулерени - це фулерени, які включили у свою внутрішню сферу атоми, іони або кластери. Ендоедричні фулерени, як правило, поділяються на дві групи: ендоедричні металофуллерени та неметалеві леговані фулерени. Перші ендоедричні металофуллерени називалися La @C 60. Знак @ в назві відображає поняття маленької молекули, захопленої всередині оболонки.
Легування фулеренів металами відбувається in-situ під час синтезу фулерену в дуговому реакторі або за допомогою лазерного випаровування. Широкий спектр металів були укладені всередині фулерена, тобто Sc, Y, La, Ce, Ba, Sr, K, U, Zr, і Hf. На жаль, синтез ендоедричних металофулеренів є неспецифічним, оскільки крім високого виходу незаповнених фулеренів отримують сполуки з різними розмірами клітин (наприклад, La @C 60 або La @C 82). Характеристика ендоедричних металофуллеренів полягає в тому, що електрони передаватимуться від атома металу до клітини фулерену і що атом металу займає положення поза центром в клітці. Розмір передачі заряду не завжди просто визначити, але він зазвичай становить від 2 до 3 одиниць (наприклад, La 2 @C 80), але може досягати 6 електронів (наприклад, Sc 3 N @C 80). Ці аніонні фулеренові клітини є дуже стабільними молекулами і не мають реактивності, пов'язаної зі звичайними порожніми фулеренами (див. Нижче). Цей недолік реактивності використовується в методі очищення ендоедричних металофуллеренів від порожніх фулеренів.
Ендоедричні He @C 60 і Ne @C 60 утворюються, коли C 60 піддається тиску близько 3 бар відповідних благородних газів. За цих умов можна було допировать 1 в кожні 650 000 С 60 клітинок атомом гелію. Ендоедричні комплекси з He, Ne, Ar, Kr і Xe, а також численні аддукти з'єднання He @C 60 також були доведені з робочим тиском 3000 барів і включенням до 0,1% благородних газів. Виділення N @C 60, N @C 70 і P @C 60 дуже незвично і на відміну від похідних металів не відбувається перенесення заряду атома пніктиду в центрі до атомів вуглецю клітини.
Хімічно функціоналізовані фулерени
Хоча фулерени мають кон'юговану ароматичну систему, всі вуглеці є четвертинними (тобто не містять водню), що призводить до того, що багато характерних реакцій заміщення плоских ароматичних речовин неможливими. Таким чином, існує всього два типи хімічних перетворень: окислювально-відновні реакції і реакції приєднання. З них реакції приєднання мають найбільшу синтетичну цінність. Ще однією чудовою особливістю хімії додавання фулерену є термодиміка процесу. Оскільки атоми вуглецю sp 2 в фуллерені парамідалізовані, існує значна енергія деформації. Наприклад, енергія деформації в С 60 становить близько 8 ккал/моль, що становить 80% від його теплоти утворення. Таким чином, полегшення цієї енергії деформації, що призводить до sp 3 гібридизованих атомів С, є основною рушійною силою для реакцій додавання (рис.\(\PageIndex{2}\)). Як наслідок, більшість доповнень до фуллеренів є екзотермічними реакціями.

Циклічні дослідження вольтамметрії (CV) показують, що C 60 може відновлюватися і окислюватися оборотно до 6 електронів з процесами перенесення одного електронів. Фулеридні аніони можуть генеруватися електрохімічним методом, а потім використовуватися для синтезу ковалентних похідних органофулерену. Лужні метали можуть хімічно зменшувати фулерен в розчині і твердому стані з утворенням М х С 60 (х = 3 - 6). C 60 також може бути зменшений менш електропозитивними металами, такими як ртуть, утворюючи C 60 - і C 60 2-. Крім того, солі також можуть синтезуватися з органічними молекулами, наприклад [TDAE +] [C 60 -] має цікаву електронну та магнітну поведінку.
Геометричний та електронний аналіз передбачив, що фулерен веде себе в прямому ефірі з електробідним кон'югованим поліолефіном. Дійсно С 60 і С 70 проходять цілий ряд нуклеофільних реакцій з вуглецем, азотом, фосфором і кисневими нуклеофілами. C60 легко реагує з органолітієвими сполуками та Гріньяра з утворенням алкільних, фенільних або алканільфулеренів. Можливо, найбільш широко використовуваними доповненнями до фулерену є реакція Бінгеля (рис.\(\PageIndex{3}\)), де вуглецевий нуклеофіл, що генерується депротонацією α-гало малонатних ефірів або кетонів, додають для утворення продукту циклопропанації. Ефіри α-гало та кетони також можуть генеруватися in situ з I 2 або CbR 4 та слабкою основою як 1,8-діазабіцикло [5.4.0] unde-7ene (DBU). Реакція Бінгеля вважається одним з найбільш універсальних і ефективних методів функціоналізації С 60.

Циклододавання - ще один потужний інструмент для функціоналізації фулеренів, зокрема через його селективність з зв'язками 6,6, обмежуючи можливі ізомери (рис.\(\PageIndex{4}\)). Діенофільна особливість [6,6] подвійних зв'язків С 60 дозволяє молекулі проходити різні реакції циклоприєднання, в яких моноаддукти можуть генеруватися з високою врожайністю. Кращими дослідженнями циклоаддинових реакцій фулерену є [3+2] добавки з діазопохідними та азометинілідами (реакції Прато). У цій реакції азометинові іліди можуть генеруватися in situ від конденсації α-амінокислот з альдегідами або кетонами, які виробляють 1,3 диполя для подальшої реакції з C 60 в хороших врожаях (рис.\(\PageIndex{5}\)). Сотні корисних будівельних блоків були створені цими двома методами. Реакції Прато також успішно застосовуються до вуглецевих нанотрубок.
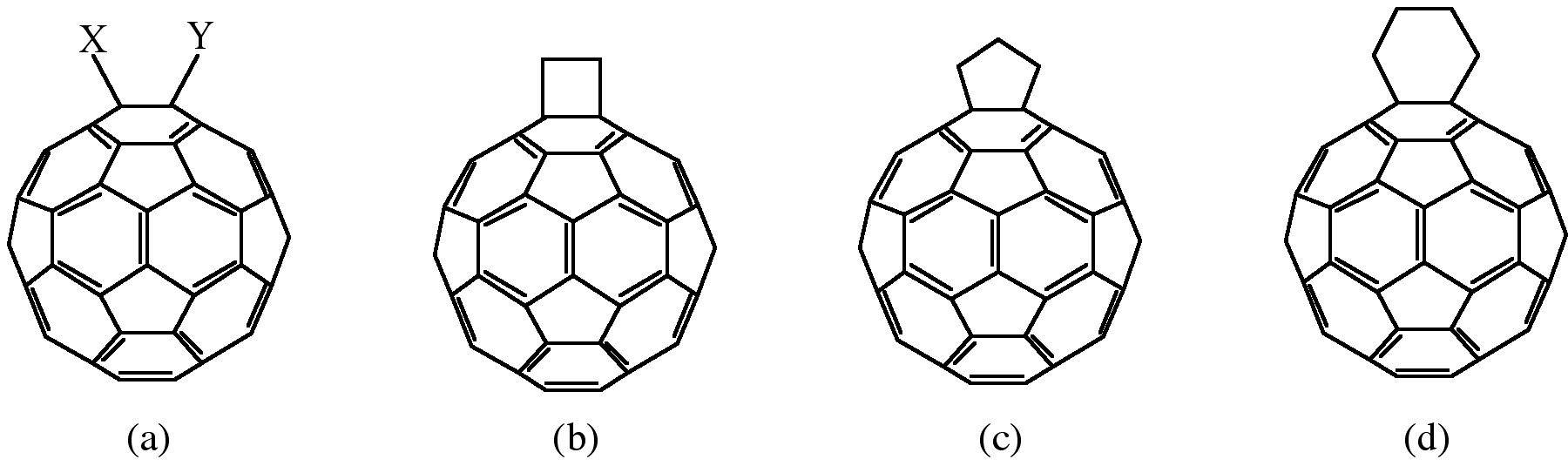

Окислення фулеренів, таких як C 60, викликає все більший інтерес щодо застосування у фотоелектричних пристроях, біологічних системах та можливій рекультивації фулеренів. Окислення C 60 до C 60 O n (n = 1, 2) може здійснюватися шляхом фотоокислення, озонолізу та епоксидування. При кожному з цих методів існує межа ізольованого оксигенізованого продукту, C 60 O n з n < 3. Високо оксигенізовані фулерени, C 60 O n з 3 ≤ n ≤ 9, були отримані каталітичним окисленням C 60 з ReMeo 3/H 2 O 2.
Вуглецеві нанотрубки
Ключовий прорив у вуглецевій нанохімії стався в 1993 році з доповіддю голкоподібних трубок, виготовлених виключно з вуглецю. Цей матеріал став називатися вуглецевими нанотрубками (CNT). Існує кілька видів нанотрубок. Першим відкриттям стали багатостінні труби (MWNT), що нагадують багато труб, вкладених один в одного. Незабаром після того, як MWNT були виявлені одностінні нанотрубки (SWNT) спостерігалися. Одностінні труби нагадують єдину трубу, яка потенційно закрита на кожному кінці. Властивості одностінних та багатостінних труб, як правило, однакові, хоча вважається, що одностінні труби мають чудову механічну міцність та тепло- та електропровідність; їх також складніше виготовити.
Одностінні вуглецеві нанотрубки (SWNT) - це за визначенням фулеренові матеріали. Їх структура складається з графенового листа, згорнутого в трубку і укритого половиною фулереном (рис.\(\PageIndex{6}\)). Атоми вуглецю в SWNT, як і в фулерені, є sp2 гібридизованими. Структура нанотрубки аналогічна взяття цього графенового листа і згортання його в безшовний циліндр. Різні типи SWNT визначаються їх діаметром та хиральністю. Більшість використовуваних в даний час одностінних вуглецевих нанотрубок були синтезовані методом імпульсного лазерного випаровування, однак все частіше SWNT отримують пароподібним рідким твердим каталізованим ростом.

Фізичні властивості SWNT зробили їх надзвичайно привабливим матеріалом для виготовлення нанопристроїв. Показано, що SWNT сильніші за сталь, оскільки оцінки модуля Юнга наближаються до 1 Tpa. Їх електропровідність порівнянна з міддю з передбаченням щільності струму до 10 13 А/см 2 і питомим опором до 0,34 х 10 -4 Ом. см при кімнатній температурі. Нарешті, вони мають високу теплопровідність (3000 - 6000 Втм/К).
Електронні властивості певної структури SWNT засновані на її хіральності або скручування в структурі трубки, яка визначається її значенням n, m. Значення n і m визначають хіральність, або «скручування» нанотрубки. Хіральність в свою чергу впливає на провідність нанотрубки, її щільність, структуру решітки та інші властивості. SWNT вважається металевим, якщо значення n-m ділиться на три. В іншому випадку нанотрубка напівпровідникова. Зовнішнє середовище також впливає на провідність трубки, таким чином молекули, такі як O 2 і NH 3, можуть змінювати загальну провідність трубки, тоді як наявність металів, як було показано, значно впливає на оптико-електронні властивості SWNT.
Багатостінні вуглецеві нанотрубки (MWNT) варіюються від двостінних НТ, через багатостінні НТ (рис.\(\PageIndex{7}\)) до вуглецевих нановолокон. Вуглецеві нановолокна є крайніми багатостінними трубами (рис.\(\PageIndex{8}\)), і вони товщі і довше, ніж SWNTs або MWNTs, мають поперечний переріз приблизно. 500 Å 2 і знаходяться між 10 до 100 мкм в довжину. Вони широко використовуються при будівництві високоміцних композитів.


Синтез вуглецевих нанотрубок
Був розроблений ряд методологій для отримання нанотрубок у значних кількостях, включаючи дуговий розряд, лазерну абляцію, окис вуглецю високого тиску (HipCo) та ріст твердої рідини пари (VLS). Всі ці процеси протікають у вакуумі або при низькому тиску з технологічними газами, хоча зростання VLS може відбуватися і при атмосферному тиску. Цими методами можна синтезувати великі кількості нанотрубок; досягнення в каталізі та безперервних ростових процесах роблять SWNT більш комерційно життєздатними.
Перше спостереження за нанотрубками було в вуглецевій сажі, що утворилася під час виробництва фулеренів дугового розряду. Високі температури, викликані розрядом, призвели до піднесення вуглецю, що міститься в негативному електроді, і CNT осідають на протилежному електроді. Труби, вироблені цим методом, спочатку представляли собою багатостінні труби (ММНТ). Однак з додаванням кобальту до випарованого вуглецю можна вирощувати одностінні нанотрубки. Цей метод виробляє суміш компонентів і вимагає подальшого очищення для відділення CNT від сажі і залишкових каталітичних металів. Отримання CNT з високим виходом залежить від рівномірності плазмової дуги, і температури осаду, що утворюється на вуглецевому електроді.
Більш високий вихід і чистоту SWNT можна отримати за допомогою двоімпульсного лазера. SWNTs можна вирощувати з виходом 50% шляхом прямого випаровування графітового стрижня, легованого Co/Ni, потужним лазером в трубчастої печі, що працює при 1200° С. Матеріал, отриманий цим методом, виглядає як мат з «канатів» діаметром 10 - 20 нм і довжиною до 100 мкм і більше. Кожна мотузка складається з пучка SWNTS, вирівняних по загальній осі. Змінюючи параметри процесу, такі як склад каталізатора та температура росту, середній діаметр нанотрубки та розподіл розмірів можуть бути змінені. Хоча дуговий розряд і лазерна вапоризація в даний час є основними методами отримання невеликих кількостей високоякісних SWNT, обидва методи страждають від недоліків. Перший полягає в тому, що вони передбачають випаровування джерела вуглецю, що робить масштабування на промисловому рівні складним і енергетично дорогим. Друге питання стосується того, що методи вапоризації вирощують SWNT у сильно заплутаних формах, змішаних з небажаними формами вуглецю та/або видів металів. Вироблені таким чином SWNT важко очистити, маніпулювати та збирати для побудови архітектури нанотрубних пристроїв для практичного застосування.
Для подолання деяких труднощів цих високоенергетичних процесів був розроблений метод хімічного каталізу, при якому використовується вуглеводнева сировина в поєднанні з металевим каталізатором. Каталізатор, як правило, але не обмежується залізом, колбальтом або залізом/молібденом, він нагрівається в умовах відновлення в присутності відповідної вуглецевої сировини, наприклад, етилену. Цей метод може бути використаний як для SWNT, так і для MWNT; формування кожного контролюється ідентичністю каталізатора і умовами реакції. Зручний лабораторний масштабний апарат доступний від Nanotech Innovations, Inc., для синтезу високорівномірного, послідовного дослідницького зразка, який використовує попередньо зважений каталізатор/ампули джерела вуглецю. Ця система дозволяє 200 мг зразків MWNT бути підготовлені для дослідження та тестування. Використання СО як вихідної сировини замість вуглеводню призвело до розробки процедури синтезу СНТ під високим тиском монооксиду вуглецю (HiPCo). За допомогою цього методу можна виробляти грамові кількості SWNT, на жаль, зусилля масштабувати за межі цього не мали повного успіху.
Спочатку розроблений для дрібномасштабних досліджень активності каталізатора, зростання парів рідких твердих речовин (VLS) нанотрубок був високо вивчений, а зараз показує перспективність для масштабного виробництва нанотрубок. Останні підходи передбачали використання чітко визначених наночастинок або молекулярних попередників, і багато різних перехідних металів були використані, але залізо, нікель та кобальт залишаються в центрі уваги більшості досліджень. Нанотрубки ростуть на місцях металевого каталізатора; вуглецевмісний газ розбивається на поверхні частинки каталізатора, а вуглець транспортується до країв частинки, де утворює нанотрубку. Довжина трубки, вирощеної в поверхнево-підтримуваних каталізаторних системах VLS, здається, залежить від орієнтації зростаючої трубки з поверхнею. Правильно регулюючи поверхневу концентрацію і агрегацію частинок каталізатора, можна синтезувати вертикально вирівняні вуглецеві нанотрубки, тобто як килим перпендикулярно підкладці.
З різних засобів для синтезу нанотрубок хімічні процеси показують найбільшу перспективу для осадження промислових масштабів з точки зору співвідношення ціна/одиниця. Є додаткові переваги росту VLS, який на відміну від інших методів здатний вирощувати нанотрубки безпосередньо на потрібному субстраті. Місця зростання контролюються ретельним осадженням каталізатора. Крім того, не було розроблено жодних інших методів росту для отримання вертикально вирівняних SWNT.
Хімічна функціоналізація вуглецевих нанотрубок
Обмеження використання вуглецевих нанотрубок у будь-яких практичних застосуваннях полягала в його розчинності; наприклад, SWNT не мають розчинності в більшості розчинників через агрегацію трубок. Агрегація/канатування нанотрубок відбувається в результаті високої енергії зв'язку ван дер Ваальса близько 500 еВ на мм контакту трубки. Ван дер Ваальса сила між трубками настільки велика, що потрібно величезна енергія, щоб розірвати їх, що робить його дуже, щоб зробити комбінацію нанотрубок з іншими матеріалами, такими як у композитних додатках. Функціоналізація нанотрубок, тобто приєднання «хімічних функціональних груп» забезпечує шлях подолання цих бар'єрів. Функціоналізація може покращити розчинність, а також технологічність, і була використана для вирівнювання властивостей нанотрубок з властивостями інших матеріалів. Найяскравішим прикладом цього є здатність солюбілізувати нанотрубки в різних розчинниках, включаючи воду. При обговоренні функціоналізації важливо розрізняти ковалентну та нековалентну функціоналізацію.
Сучасні методи солюбілізації нанотрубок без ковалентної функціоналізації включають високоароматичні розчинники, суперкислоти, полімери або поверхнево-активні речовини. Нековалентна «функціоналізація», як правило, стосується концепції супрамолекулярних взаємодій між SWNT та деякими макромолекулами в результаті різних сил адсорбції, таких як взаємодії ван дер Ваальса та π-укладання. Хімічне видоутворення самої нанотрубки не змінюється в результаті взаємодії. На відміну від цього, ковалентна функціоналізація спирається на хімічну реакцію на боковині або кінці SWNT. Як і слід було очікувати, високе співвідношення сторін нанотрубок означає, що функціоналізація боковини набагато важливіша за функціоналізацію ковпачка. Пряма ковалентна функціоналізація боковини пов'язана зі зміною гібридизації від sp 2 до sp 2 і одночасною втратою кон'югації. Альтернативний підхід до ковалентної функціоналізації передбачає реакцію дефектів, присутніх (або породжених) у структурі нанотрубки. Місцями дефекту можуть бути відкриті торці і отвори в боковині, а також нерівності п'ятикутника і гептагону в шестигранному графеновому каркасі (часто пов'язані з вигинами в трубах). Всі ці функціоналізації є екзоедричними дериватизаціями. Враховуючи порожнисту структуру нанотрубок, можлива ендоедрична функціоналізація SWNT, тобто заповнення трубок атомами або малими молекулами. Важливо зазначити, що методи ковалентної функціоналізації мають одну спільну проблему: екстенсивна ковалентна функціоналізація змінює властивості SWNT, порушуючи безперервну π—систему SWNT.
Різні області застосування нанотрубок вимагають різних, специфічних модифікацій для досягнення бажаних фізико-хімічних властивостей нанотрубок. У зв'язку з цим ковалентна функціоналізація забезпечує більш високий ступінь тонкої настройки хімії і фізики SWNT, ніж нековалентна функціоналізація. До сих пір для досягнення функціоналізації нанотрубок застосовувалися найрізноманітніші методи (рис.\(\PageIndex{9}\)).

Беручи хімію, розроблену для C 60, SWNTs можуть бути функціоналізовані за допомогою 1,3 диполярного додавання азометинових лідів. Функціоналізовані SWNT розчинні в більшості поширених органічних розчинників. Метод функціоналізації азометініліду також використовувався для очищення SWNT. В електрохімічних умовах солі аріл-діазонію реагують з SWNT для досягнення функціоналізованих SWNT, в якості альтернативи іони діазонію можуть генеруватися in-situ з відповідного аніліну, тоді як реакція без розчинників забезпечує найкращий шанс для масштабної функціоналізації таким чином. У кожному з цих методів можна контролювати кількість функціоналізації на трубці, змінюючи час реакції та використовувані реагенти; можлива функціоналізація до 1 групи на кожні 10 - 25 атомів вуглецю.
Органічна функціоналізація за допомогою алкілгалогенідів, радикального шляху, на трубках, оброблених літієм у рідкому аміаку, пропонує простий та гнучкий шлях до ряду функціональних груп. У цій реакції функціоналізація відбувається на кожні 17 вуглець. Найбільший успіх був знайдений, коли пробірки додецилірованние. Ці пробірки розчинні в хлороформі, ДМФ і ТГФ.
Додавання кисневих фрагментів до боковин SWNT може бути досягнуто шляхом обробки кислотним або вологим окисленням повітря, а також озонолізом. Пряме епоксидування SWNT може здійснюватися шляхом прямої реакції з пероксидним реагентом, або каталітично. Каталітичне деепоксидування (рис.\(\PageIndex{10}\)) дозволяє проводити кількісний аналіз епоксиду бокової стінки і призвело до дивовижного результату, що раніше передбачувані «чисті» SWNT насправді містять приблизно 1 кисень на 250 атомів вуглецю.
Одним з найпростіших маршрутів функціоналізації та корисним синтоном для подальших перетворень є фторування SWNT з використанням елементарного фтору. Важливо, що співвідношення C: F до 2:1 можна досягти без порушення трубчастої структури. Фторовані SWNT (F-SWNTs) виявилися набагато більш розчинними, ніж незаймані SWNT в спиртах (1 мг/мл в iso -пропанолі), ДМФ та інших обраних органічних розчинниках. Скануюча тунельна мікроскопія (СТМ) показала, що фтор утворюється смугами приблизно 20 нм, в той час як розрахунки з використанням ДФТ виявили, що додавання 1,2 є більш енергетично кращим, ніж 1,4 додавання, що було підтверджено твердим станом 13 С ЯМР. F-SWNTS виробляють високогнучкі синтези, а подальша розробка була виконана з органо-літієм, реагентами Гріньяра та амінами.
Функціоналізовані нанотрубки можуть характеризуватися різними методами, такими як атомно-силова мікроскопія (АСМ), просвічувальна електронна мікроскопія (ТЕМ), УФ-спектроскопія та спектроскопія комбінаційного випромінювання. Зміни в спектрі комбінаційного випромінювання зразка нанотрубки можуть вказувати на те, чи відбулася функціоналізація. Незаймані трубки демонструють дві чіткі смуги. Ними є радіальний режим дихання (230 см -1) і тангенціальний режим (1590 см -1). При функціоналізації нова смуга, яка називається смугою розладу, з'являється приблизно в 1350 см -1. Ця смуга приписується sp 3 -гібридизованим вуглецям в трубці. На жаль, при наявності значного режиму D узгоджується з функціоналізацією боковини, а відносна інтенсивність режиму D (розлад) проти тангенціального режиму G (1550 — 1600 см -1) часто використовується як міра рівня заміщення. Однак показано, що раман є ненадійним методом визначення ступеня функціоналізації, оскільки відносна інтенсивність діапазону D також є функцією розподілу замісників та концентрації. Останні дослідження показують, що твердотільний 13 С ЯМР, можливо, є єдиним остаточним методом демонстрації ковалентного приєднання певних функціональних груп.
Покриття вуглецевими нанотрубками: створення неорганічних наноструктур
Фулерени, нанотрубки та нановолокна являють собою відповідні субстрати для посіву інших матеріалів, таких як оксиди та інші мінерали, а також напівпровідники. У зв'язку з цим вуглецевий наноматеріал виступає як насіннєва точка для зростання, а також метод визначення незвичайних пропорцій. Наприклад, кремнеземні волокна можуть бути отримані низкою методів, але тільки за допомогою покриття SWNT можуть бути отримані нановолокна кремнезему довжиною мікрон з десятками нанометрів в діаметрі.
У той час як C 60 сам по собі не легко посівний ріст неорганічних матеріалів, рідка фаза осадження оксидів, таких як кремнезем, в присутності фуллеренолу, C 60 (OH) n, призводить до утворення однорідних оксидних сфер. Здається, фуллеренол діє як реагент, так і фізична точка для подальшого росту оксиду, і це C 60, або сукупність C 60, який присутній всередині сферичної частинки. Додавання фуллеренолу змінює морфологію і кристалічну фазу CaCo 3 осаджує з водного розчину, в результаті чого утворюються сферичні ознаки, 5-кутні квіткові скупчення та трикутні кристали на відміну від звичайних ромбічних кристалів. Крім того, спостерігається метастабільна ватеритная фаза з додаванням C 60 (OH) n.
Як зазначалося вище, окремі SWNT можуть бути отримані в розчині при укладенні в циліндричну міцелу відповідної поверхнево-активної речовини. Ці індивідуалізовані нанотрубки можуть бути покриті цілим рядом неорганічних матеріалів. Осадження рідкої фази (LPD), як видається, має значні переваги перед іншими методами, такими як включення поверхнево-активних SWNT у прекерамічну матрицю, in situ зростання SWNT в оксидній матриці та золь-гель методи. Основна перевага зростання LPD полягає в тому, що окремі SWNT можуть бути покриті, а не пучками або мотузками. Наприклад, SWNT були покриті кремнеземом шляхом осадження рідкої фази (LPD) з використанням розчину кремнію/H 2 SiF 6 та стабілізованого поверхнево-активною речовиною розчину SWNTs. Товщина покриття залежить від концентрації реакційної суміші і часу реакції. Ядро SWNT можна видалити термолізом в умовах окислення, щоб залишити кремнезему нановолокно. Цікаво відзначити, що використання поверхнево-активної речовини є контрпродуктивним при використанні MWNT та VGF, в цьому випадку поверхнева активація нанотрубки пропонує відповідне ініціювання росту. Попереднє окислення MWNT або VGF дозволяє наносити рівномірні покриття. Покриті SWNT, MWNTs та VGF можуть згодом реагувати з відповідними поверхневими реагентами для додання змішуваності у водних розчині, гуарових гелі та органічних матрицях. Окрім простих оксидів, нанотрубки з покриттям були підготовлені з мінералами, такими як карбонати та напівпровідники.
Бібліографія
- С. М. Бачило, М.С. Страно, К. Кіттрелл, Р.Х. Хауге, Р.Е. Смоллі, і Р.Б. Вайсман, Наука, 2002, 298, 2361.
- Д. С. Бетюн, К.Х. Кланг, М.С. ДеВріс, Г. Горман, Р. Савой, Дж. Васкес, і Р. Бейерс, Природа, 1993, 363, 605.
- J, Дж. Бреге, C. Галлауей, і А.Р. Баррон, J. Phys. Хім., С, 2007, 111, 17812.
- Дж. Дайк і Дж.М. Тур, Джей Ам. Хім. Соц. , 2003, 125, 1156.
- Z. Ge, Дж. Дюшан, Т. Кай, H. W Гібсон, і H. C. Дорн, J. Am. Хім. Соц. , 2005, 127, 16292.
- Л.А. Гіріфалько, М.Ходак, і Р.С. Лі, Фіз. Преподобний Б, 2000, 62, 13104.
- Т.Го, П.Ніколаєв, А.Г. Рінцлер, Д. Томанек, Д. Т. Кольбер, і Р.Е. Смоллі, Дж. Phys. Хім. , 1995, 99, 10694.
- Дж. Хафнер, М.Дж. Броніковський, Б.Р. Азаміан, П. Миколаїв, А.Г. Рінцлер, Д. Т. Кольбер, К.А. Сміт, і Р. Е. Фіз. Летт. , 1998, 296, 195.
- Хірш А.А., Анжев. Хім. Int. Ред. , 2002, 40, 4002.
- Іджіма і Т.Ічіхасі, Природа, 1993, 363, 603.
- Джаррі, Е.А. Вітсітт, і А.Р. Баррон, Дж. Матер. Наук. , 2007, 42, 7381.
- Х. В. Крото, Дж. Хіт, С.К. О'Брайен, Р.Ф. Керл, і Р.Е. Смоллі, Природа, 1985, 318, 162.
- Ф. Лян, А.К. Садана, А. Піра, Дж. Чаттопадхьяй, Z. Gu, Р.Х. H. H. і W. Billups, Нано Летт. , 2004, 4, 1257.
- Д. Огрин і А.Р. Баррон, Дж. Мол. Кіт. В: Хім. , 2006, 244, 267.
- Д.Огрін, Дж. Чаттопадхьяй, А.К. Садана, Е. Біллупс, і А.Р. Баррон, Дж. Хім. Соц. , 2006, 128, 11322.
- Смоллі Р.Е., Док. Хім. Рез., 1992, 25, 98.
- М. Дж. Трейсі, Т. Еббесен, і Дж. М. Гібсон, Природа, 1996, 381, 678.
- Вітсітт і А.Р. Баррон, Нано Летт. , 2003, 3, 775.
- Ян і А.Р. Баррон, Chem. Комун. , 2004, 2884.
- Л.Цзен, Л.Б. Алемані, К.Л. Едвардс, і А.Р. Баррон, Нано Рез., 2008, 1, 72.
Графен
Вступ
Графен - це плоский лист товщиною один атом атомів вуглецю sp 2, які щільно упаковані в стільникову кристалічну решітку (рис.\(\PageIndex{11}\)). Назва походить від «графіт» та «алкен»; сам графіт складається з багатьох графенових листів, складених разом.

Одношарові графенові нанолисти вперше були охарактеризовані в 2004 році, підготовлені механічним відлущуванням (метод «скотч-стрічки») об'ємного графіту. Пізніше графен був отриманий шляхом епітаксійного хімічного осадження парів на карбід кремнію і нікелеві підкладки. Зовсім недавно графенові нанострічки (ГНР) були отримані шляхом окислювальної обробки вуглецевих нанотрубок та плазмового травлення нанотрубок, вбудованих в полімерні плівки.
Фізичні властивості графена
Повідомлялося, що графен має модуль Юнга 1 tPa і внутрішню міцність 130 GP; подібно до одностінних вуглецевих нанотрубок (SWNT). Електронні властивості графена також мають деяку схожість з вуглецевими нанотрубками. Графен - напівпровідник з нульовою смугою пропускання. Рухливість електронів у графені надзвичайно висока (15 000 см 2 /В. с при кімнатній температурі), а балістичний транспорт електронів, як повідомляється, знаходиться на шкалах довжини, порівнянних з масштабами SWNT. Одним з найбільш перспективних аспектів графена є використання GNR. Різання окремого шару графену на довгу смужку може отримати напівпровідникові матеріали, де заборона налаштовується на ширину стрічки.
Хоча нові електронні та фізичні властивості графену гарантують, що цей матеріал буде вивчатися протягом багатьох років, перед тим, як матеріали на основі графену можуть бути повністю використані, є деякі фундаментальні перешкоди. Вищезазначені методи отримання графену є ефективними, однак вони недоцільні для великомасштабного виробництва. Найбільш рясним і недорогим джерелом графена є насипний графіт. Хімічні методи відлущування графену з графіту забезпечують найбільш реалістичний і масштабований підхід до графенових матеріалів.
Шари графена утримуються в графіті величезними силами ван дер Ваальса. Подолання цих сил є головною перешкодою для відшарування графіту. На сьогоднішній день хімічні зусилля при відлущуванні графіту були зосереджені насамперед на інтеркаляцію, хімічну дериватизацію, термічне розширення, окислення-відновлення, використання поверхнево-активних речовин або деяку їх комбінацію.
оксид графіту
Ймовірно, найпоширеніший шлях до графена передбачає виробництво оксиду графіту (GO) надзвичайно суворою хімією окислення. Методи Staudenmeier або Hummers найчастіше використовуються для виробництва GO, сильно відшаровується матеріалу, який диспергується у воді. Структура ГО була предметом численних досліджень; відомо, що вона містить епоксидні функціональні групи вздовж базальної площини листів, а також гідроксильні та карбоксильні фрагменти по краях (рис.\(\PageIndex{12}\)). На відміну від інших методів синтезу ГО, окислення м-пероксибензойної кислоти (m -CPBA) мікрокристалічного синтетичного графіту при кімнатній температурі дає епоксид графіту з високим виходом, без істотних додаткових дефектів.

Оскільки оксид графіту є електроізоляційним, він повинен бути перетворений хімічним відновленням для відновлення електронних властивостей графена. Хімічно перетворений графен (CCG) зазвичай зменшується гідразином або борогідридом. Властивості CCG ніколи не можуть повністю відповідати властивостям графену з двох причин:
- Окислення до ГО вносить дефекти.
- Хімічне відновлення не повністю відновлює графітичну структуру.
Як і слід було очікувати, CCG схильний до агрегації, якщо не стабілізується. Графенові матеріали, виготовлені з незайманого графіту, уникають різкого окислення до GO та подальшого (неповного) відновлення; таким чином, вироблені матеріали потенційно набагато краще підходять для застосування в електроніці.
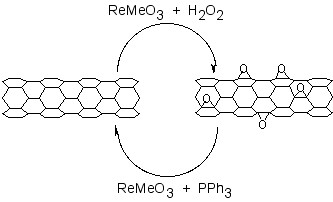
До епоксиду графену та ГО застосовано каталітичний підхід до видалення епоксидів з фулеренів та СНТ. Обробка окислених графенів метилтріоксоргенієм (MeReO 3, MTO) у присутності pPH 3 призводить до перенесення кисню, утворюючи O=pPH 3 і дозволяє кількісно визначити співвідношення C:O.
Однорідні дисперсії графена
Альтернативний підхід до виробництва графенових матеріалів передбачає використання незайманого графіту в якості вихідного матеріалу. Фундаментальна цінність такого підходу полягає в уникненні його окислення до ГО і подальшого (неповного) відновлення, тим самим зберігаючи бажані електронні властивості графена. Існує прецедент для відлущування незайманого графіту в акуратних органічних розчинниках без окислення або поверхнево-активних речовин. Повідомлялося, що N, N -диметилформамід (ДМФ) дисперсії графена можливі, але детальної характеристики дисперсій не повідомлялося. На відміну від цього, Коулман і колеги повідомили про подібні дисперсії з використанням N -метилпіролідону (NMP), в результаті чого окремі аркуші графена в концентрації ≤0,01 мг/мл. NMP і DMF є високополярними розчинниками, і не ідеальні в тих випадках, коли хімія реакцій вимагає неполярного середовища. Далі вони гігроскопічні, що робить їх використання проблематичним, коли вода повинна бути виключена з реакційних сумішей. Нарешті, ДМФ схильний до термічного і хімічного розкладання.
Останнім часом повідомляється про дисперсії графена в орто-дихлорбензолі (ODCB) з використанням широкого спектру джерел графіту. Вибір ODCB для відлущування графіту грунтувався на кількох критеріях:
- ODCB є звичайним реакційним розчинником для фулеренів і, як відомо, утворює стабільні дисперсії SWNT.
- ODCB - це зручний висококиплячий ароматизатор і сумісний з різними хімічними речовинами реакції.
- ODCB, будучи ароматичним, здатний взаємодіяти з графеном за допомогою π-π укладання.
- Було висловлено припущення, що хороші розчинники для відлущування графіту повинні мати значення поверхневого натягу 40 - 50 МДж/м 2. ODCB має поверхневий натяг 36,6 МДж/м 2, близький до запропонованого діапазону.
Графіт легко відшаровується в ODCB з гомогенізацією та ультразвуком. Успішно диспергували три вихідні матеріали: мікрокристалічний синтетичний, термічно розширений та високоупорядкований піролітичний графіт (HOPG). Дисперсії мікрокристалічного синтетичного графіту мають концентрацію 0,03 мг/мл, що визначаються гравіметрично. Дисперсії з розширеного графіту та HOPG менш концентровані (0,02 мг/мл).
Електронна мікроскопія з високою роздільною здатністю (HRTEM) показує переважно малошаровий графен (n < 5) з одиночними шарами та дрібними пластівцями, укладеними зверху (рис.\(\PageIndex{13}\)). Видно великі графітові області; це додатково підтримується виділеною областю електронної дифракції (SAED) та швидким перетворенням Фур'є (БПФ) у вибраних областях. Атомно-силовий мікроскоп (AFM) зображення дисперсій, розпорошених на кремнієві підкладки, показують надзвичайно тонкі пластівці з майже всіма нижче 10 нм. Середня висота становить 7 - 10 нм. Найтоншими є менше 1 нм, графенові моношари. Бічні розміри наноаркушів коливаються від 100 до 500 нм.

Як осаджені плівки, відлиті з графену ODCB, демонструють погану електропровідність, однак після вакуумного відпалу при 400° C протягом 12 годин плівки значно покращуються, маючи опір листа близько 60 Ом/кв. Для порівняння, графен, епітаксіально вирощений на Ni, має повідомлений опір листа 280 Ом/кв.
Ковалентна функціоналізація графена та оксиду графіту
Добре встановлена ковалентна функціоналізація SWNT. Деякі шляхи до ковалентно функціоналізованих SWNT включають етерифікацію/амідацію, відновне алкілування (реакція Біллупса) та лікування азометиновими лідами (реакція Прато), солями діазонію або нітронами. І навпаки, хімічна дериватизація графена та ГО все ще відносно невивчена.
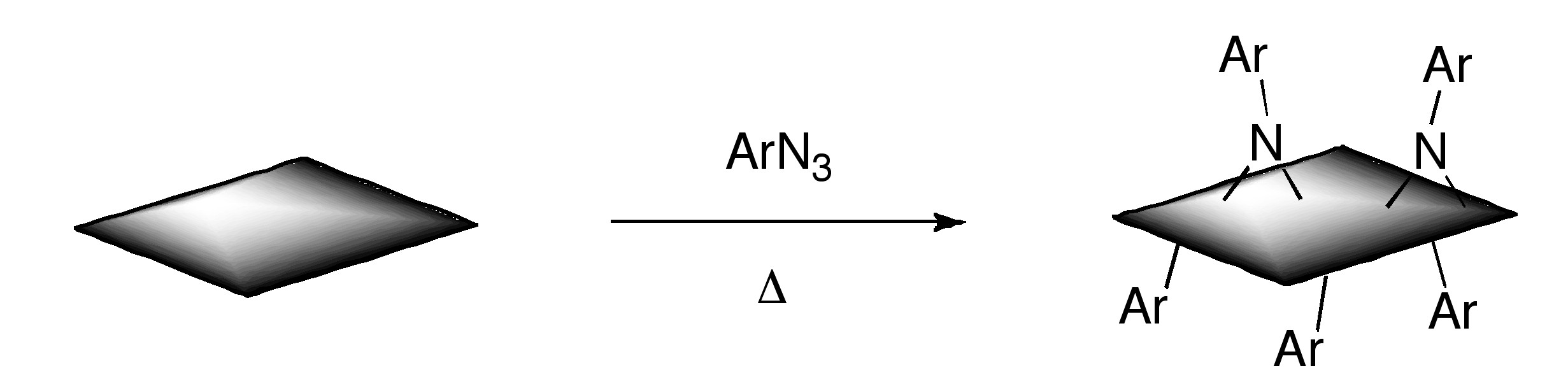
Деякі методи, раніше продемонстровані для SWNT, були адаптовані до GO або графену. Групи карбонових кислот GO були перетворені в ацилхлориди з подальшим амідацією довголанцюговими амінами. Крім того, повідомлялося про зв'язок первинних амінів та амінокислот за допомогою нуклеофільної атаки епоксидних груп GO. Ще один шлях пов'язані ізоціанати з карбоновими кислотними групами GO. Також продемонстровано функціоналізацію частково відновленого ГО солями арилдіазонію. Реакція Біллупса була проведена на інтеркаляційній сполуці графіту калію (C 8 K), а також фторид графіту, а останнім часом GO. Алкілування графену було здійснено шляхом обробки фториду графіту алкілітієвими реагентами.
Дисперсії графена ODCB можуть бути легко перетворені на ковалентно функціоналізувати графен. Термічне розкладання пероксиду бензоїлу використовується для ініціювання радикального додавання алкіл-йодидів до графену в дисперсіях ODCB.

Крім того, функціоналізований графен з нітронами, що генеруються термічним розкладанням арилазидів
Бібліографія
- Блейк, П.Д. Брімікомб, Р.Р. Нейр, Т.Дж. Бут, Д. Цзян, Ф. Щедін, Л.А. Пономаренко, С.В. Морозов, Глісон Глісон, Е. В. Хілл, А.К. Гейм, і К.С. Новоселов, Нано Летт., 2008, 8, 1704.
- Дж. Чаттопадхьяй, А.Мукерджі, Гамільтон, J.-H. Кан, С.Чакраборті, В. Го, К.Ф. Келлі, А.Р. Баррон, і W. Е. Хім. Соц., 2008, 130, 5414.
- Г. Еда, Г. Фанчіні та М. Чховалла, Нат. Нанотехнол., 2008, 3, 270.
- Хан М.Ю., Озілмаз Б., Чжан Ю., і П.Кім, Фіз. Преподобний Летт., 2008, 98, 206805.
- Ернандес, В.Ніколозі, М. Лотя, Ф.М. Бліге, З. Сан, С. де, І. Т. Макговерн, Б. Голландія, М. Бірн, Ю.К. Гун'Ко, Дж. Боланд, П. Нірадж, Г. Дюсберг, С.Крішнамурті, Р. Гудхью, Дж. Хатчінсон, В.Скардачі, А.К. Феррарі, і Дж. Ман, Нат. Нанотехнол. , 2008, 3, 563.
- Хаммерс і Р.Е. Оффеман, Дж. Хім. Соц., 1958, 80, 1339.
- Л. Цзяо, Л.Чжан, Х. Ван, Дянков Г., і Х.Дай, Природа, 2009, 458, 877.
- Косинкін Д.В., Хіггінботам А.Л., Синицький А.Р., Ломеда Ю.Р., Дімієв А.К., Прайс, і Дж.М. тур, Природа, 2009, 458, 872.
- Д. Лі, М.Б. Мюллер, С.Гільє, Р.Б. Канер, і Г. Г. Уоллес, Нат. Нанотехнол., 2008, 3, 101.
- С. Нійогі, Е.Бек'ярова, М.Е. Іткіс, Дж. Л. МакВільямс, М.А. Хамон, Гаддон, Дж. Хім. Соц., 2006, 128, 7720.
- Ю.Сі та Е.Т. Самульський, Нано Летт., 2008, 8, 1679.
- Стауденмайер Л., Бер. Dtsch. Хім. Гес., 1898, 31, 1481.
