6.13: Халькогеніди алюмінію, галію та індію
- Page ID
- 17673
Єдиними стабільними халькогенідами алюмінію є Al 2 S 3 (білий), Al 2 Se 3 (сірий) та Al 2 Te 3 (темно-сірий). Кожен з них готується шляхом безпосередньої реакції елементів (100° C) і швидко гідролізується у водному розчині (6.13.1). Всі халькогеніди мають гексагональну структуру ZnS, в якій зайняті 2/3 металевих ділянок.
\[ \text{Al}_3\text{E}_3 \text{ + 6 H}_2\text{O} \rightarrow \text{2 Al(OH)}_3 \text{ + 3 H}_2\text{E}\]
Халькогеніди галію та індію більш численні, ніж у алюмінію, і перераховані в таблиці\(\PageIndex{1}\) та таблиці\(\PageIndex{2}\) разом з вибраними фізичними властивостями.
| З'єднання | Структурний тип | Кристалографічна система | Параметри комірки (Å,°) | Зазор смуги (еВ) |
| Газ | шестикутна | а = 3,587, с = 15,492 | 3.05 (реж.), 2.593 (інд.) | |
| Газ | ZnS або NaCl | Кубічний | а = 5,5 | 4.0 (опт.) |
| β-газ | Газ | шестикутна | а = 3,742, с = 15,919 | 2.103 (реж.), 2.127 (інд.) |
| γ-газ | Газ | Ромбоедричні | а = 3,755, с = 23,92 | |
| Δ-газ | Газ | шестикутна | а = 3,755, с = 31,99 | |
| β-ворота | Газ | шестикутна | а = 4,06, с = 16,96 | |
| Гейт | Газ | Моноклінічний | а = 17,44, б = 4,077, с = 10,456, β = 104,4 | 1.799 (реж.) |
| α-га 2 S 3 | Вурцит | Кубічний | а = 5,181 | |
| α-га 2 S 3 | Вурцит | Моноклінічний | а = 12,637, б = 6,41, с = 7,03, β = 131,08 | 3.438 (опт.) |
| β-га 2 S 3 | Дефект Вюрциту | шестикутна | а = 3,685, с = 6,028 | 2,5 - 2,7 (опт.) |
| α-га 2 Se 3 | Сфалерит | Кубічний | а = 5,429 | 2.1 (реж.), 2.04 (інд.) |
| α-га 2 Те 3 | Сфалерит | Кубічний | а = 5,886 | 1.22 (опт.) |
| З'єднання | Структурний тип | Кристалографічна система | Параметри комірки (Å,°) | Зазор смуги (еВ) a |
| β-іни | Газ | Орторомбічний | а = 3,944, б = 4,447, с = 10,648 | 2.58 (реж.), 2.067 (інд.) |
| ІН б | Хг 2 Сл 2 | Тетрагональний | ||
| InSe | Газ | Ромбоедричні | а = 4,00, с = 25,32 | 1.3525 (реж.), 1.32 (інд.) |
| β-інсе | Газ | шестикутна | а = 4,05, с = 16,93 | |
| ІнТе | TLSe | Тетрагональний | а = 8,437, с = 7,139 | Металеві |
| ІнТе б | NaCl | Кубічний | а = 6,18 | |
| α-в 2 S 3 | γ-Ал 2 О 3 | Кубічний | а = 5,36 | |
| β-в 2 S 3 | Шпінель | Тетрагональний | а = 7,618, с = 32,33 | 2.03 (реж.), 1.1 (інд.) |
| α-в 2 Se 3 | Дефект Вюрциту | шестикутна | а = 16,00, с = 19,24 | |
| β-в 2 Sep 3 | Дефект Вюрциту | Ромбоедричні | а = 4,025, с = 19,222 | 1.2 - 1.5 (ін.) |
| α-в 2 Те 3 | Сфалерит | Кубічний | а = 6,158 | 0,92 - 1,15 (опт.) |
| У 6 S 7 | Моноклінічний | а = 9,090, б = 3,887, с = 17,705, β = 108,20 | 0,89 (реж.), 0,7 (інд.) | |
| В 6 вер 7 | У 6 S 7 | Моноклінічний | а = 9,430, б = 4,063, с = 18,378, β = 109,34 | 0.86 (реж.), 0.34 (інд.) |
| У 4 вер 3 | Орторомбічний | а = 15,297, б = 12,308, с = 4,081 | 0.64 (реж.) | |
| У 4 Чт 3 | У 4 вер 3 | Орторомбічний | а = 15,630, б = 12,756, с = 4,441 | 0.48 (реж.) |
Гексагональна β -форма Ga 2 S 3 є ізоструктурною з алюмінієвим аналогом; однак, хоча α-фаза була запропонована бути гексагональною, вона пізніше була показана моноклінною. Повідомлялося про кубічну α-фазу. Кубічні сфалеритні структури знайдені для Ga 2 Se 3, Ga 2 Te 3 і In 2 Te 3, в яких структура заснована на кубічній тісній упаковці халькогенідів і атомів металів, що займають 1/3 тетраедричної сайти. Всі ці структури утворюються при швидкій кристалізації; повільна кристалізація і/або термічний відпал призводить до впорядкування і утворення більш складних структур. Сульфіди індію та похідні селенідів є шпінеллю (γ-Al 2 O 3) та дефектом Вюрциту відповідно.
На відміну від халькогенідів алюмінію, галію та індію також утворюють субвалентні сполуки, тобто ті, в яких метал формально має ступінь окислення менше +3. З цих субвалентних халькогенідів найбільший інтерес представляють (формально) двовалентні матеріали. Термодинамічно стабільна фаза GaS має структуру гексагонального шару (рис.\(\PageIndex{1}\)) з зв'язками Ga-Ga (2.48 Å). Тому сполуку можна розглядати як приклад Ga (II). Кожен Ga координується трьома атомами сірки і одним галієм, а послідовність шарів по осі z дорівнює... S-Га-Га-С... S-Га-Га-С... .

Структури β-газу та β-InSe схожі на гексагональні ГАЗ. Шарувата структура GaTe схожа тим, що складається з... ТегаГейт... шарів, але є моноклінним, тоді як InS знаходиться як в тетрагональній фазі (високий тиск) (рис.\(\PageIndex{2}\) А), так і в орторомбічній фазі (рис.\(\PageIndex{2}\) b). На відміну від цих M-M зв'язаних шаруватих сполук InTe (рис.\(\PageIndex{3}\)) має структуру, формалізовану як In (I) [In (III) Te 2]; кожен In (III) чотиригранно узгоджений з чотирма Te, і ці тетраедри пов'язані через спільні ребра; In (I) центри, що лежать між цими ланцюгами.


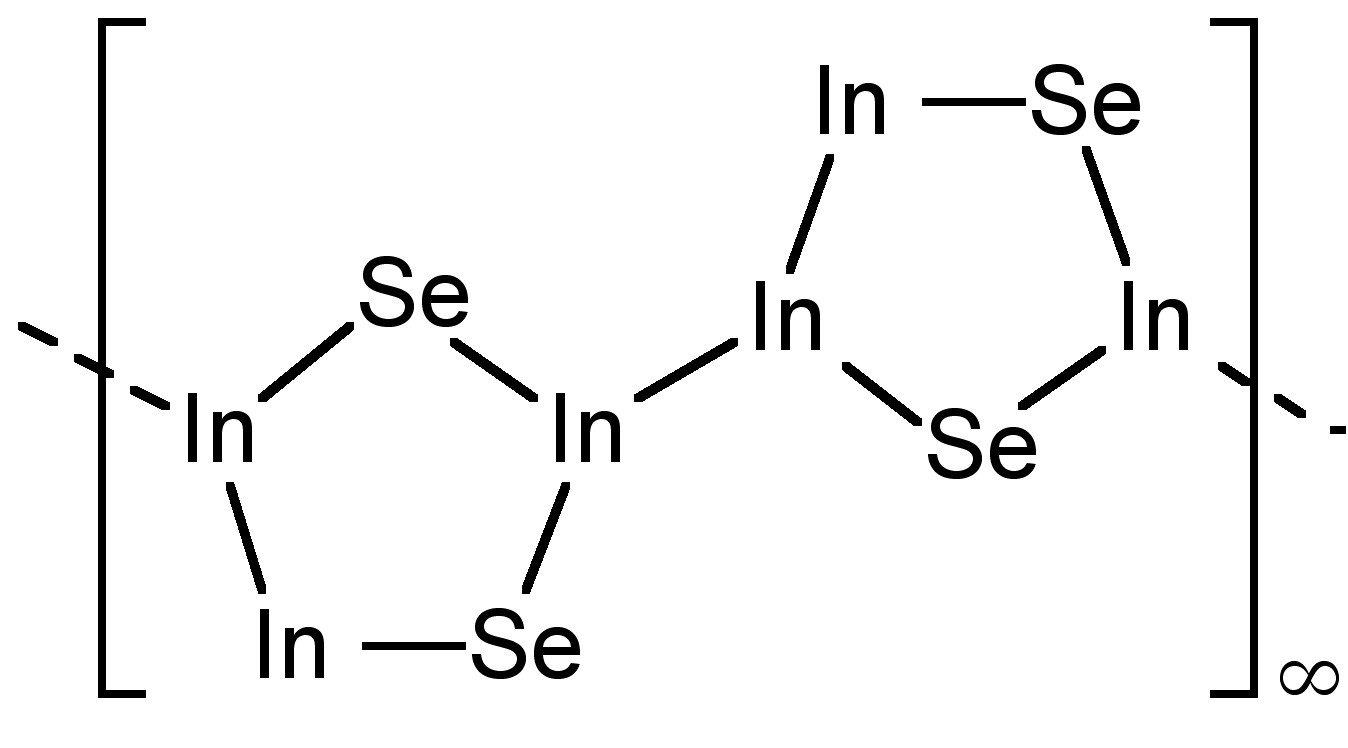
Подальші субхалькогеніди відомі для індію, наприклад; У 4 Se 3, який містить [In (III) 3 Se 2] 5+ групи (рис.\(\PageIndex{4}\)). У той час як формально молекула In (I) In 2 S була виявлена в газовій фазі, вона насправді є сумішшю In і InS в твердому стані.
Бібліографія
- Дж. Даффін і Дж. Х. Хогг, Акта Кристаллогр., 1966, 20, 566.
- Дж. Гудієр і Г. Штайгман, Акта Кристаллограф. 1963, 16, 946.
- Г.Хан і Г. Франк, З. анорг. Алгем. Хім., 1955, 278, 340.
- Кабалкіна, В.Г. Лосєв, і Н.М. Гасанли, Твердотільний комун., 1982, 44, 1383.
- Кейс, С.Г. Ботт, і А.Р. Баррон, Chem. Матер. , 1999, 11, 3578.
- А.Н. MacInnes, М.Б. Пауер, і А.Р. Баррон, Chem. Матер. , 1992, 4, 11.
- А. Макіннес, У.М. Клівер, А.Р. Баррон, М.Б. Пауер, і А.Ф. Гепп, адв. Матер. Оптика. Електрон. , 1992, 1, 229.
- Шуберт, Е. Дерре, і Е. Гюнцель, Натурвіссеншафтен, 1954, 41, 488.