6.12: Електронний клас арсеніду галію
- Page ID
- 17640
Вступ
Синтез і очищення об'ємного полікристалічного напівпровідникового матеріалу є першим кроком до комерційного виготовлення електронного пристрою. Потім цей полікристалічний матеріал використовується як сировина для формування монокристалічного матеріалу, який обробляється до напівпровідникових пластин.
На відміну від кремнію електронного класу (EGS), використання якого є незначною часткою світового виробництва елементарного кремнію, арсенід галію (GaAs) проводиться виключно для використання в напівпровідниковій промисловості. Однак миш'як і його сполуки мають значне комерційне застосування. Основне використання елементарного миш'яку - в сплавах Pb, і в меншій мірі Cu, тоді як сполуки миш'яку широко використовуються в пестицидах та консервантах деревини та виробництві пляшкового скла. Таким чином, електронна промисловість являє собою незначного користувача миш'яку. На відміну від цього, хоча галій має незначне використання як високотемпературне рідке ущільнення, манометричні рідини та теплоносії, а також для низькотемпературних припоїв, його основне використання - у напівпровідниковій технології.
Виділення та очищення металу галію
При 19 ppm галій (L. Gallia, Франція) приблизно такий же багатий, як азот, літій і свинець; він вдвічі рясніший, ніж бор (9 ppm), але важче видобути через відсутність будь-якої великої галійсодержащей руди. Галій завжди зустрічається в асоціації або з цинком або германієм, його сусідами по таблиці Менделєєва, або з алюмінієм тієї ж групи. Так, найвищі концентрації (0,1-1%) припадають на рідкісний мінеральний германіт (комплексний сульфід Zn, Cu, Ge та As), тоді як концентрації в сфалериті (ZnS), діаспорі [AlO (OH)], бокситах або вугіллі - в сто разів менше. Промислово галій спочатку був відновлений з димового пилу, що виділяється під час випалу сульфіду або спалювання вугілля (до 1,5% Ga), однак зараз він отримується як побічний продукт великої алюмінієвої промисловості і, зокрема, з процесу Байєра для отримання глинозему з бокситів.
Процес Байєра включає розчинення бокситів, AlO x OH 3-2x, у водному NaOH, відділення нерозчинних домішок, часткове осадження тригідрату Al (OH) 3 та прожарювання при 1200 °С. При обробці лужний розчин поступово збагачується галієм з початкове співвідношення ваги Ga/Al близько 1/5000 до приблизно 1/300. Електроліз цих екстрактів з катодом Hg призводить до подальшої концентрації, і утворюється таким чином розчин галлату натрію потім електролізується катодом з нержавіючої сталі для отримання металу Ga. Оскільки боксити містять 0,003-0,01% галію, повне відновлення дасть близько 500-1000 тонн на рік, проте нинішнє споживання становить лише 0,1% від цього близько 10 тонн на рік.
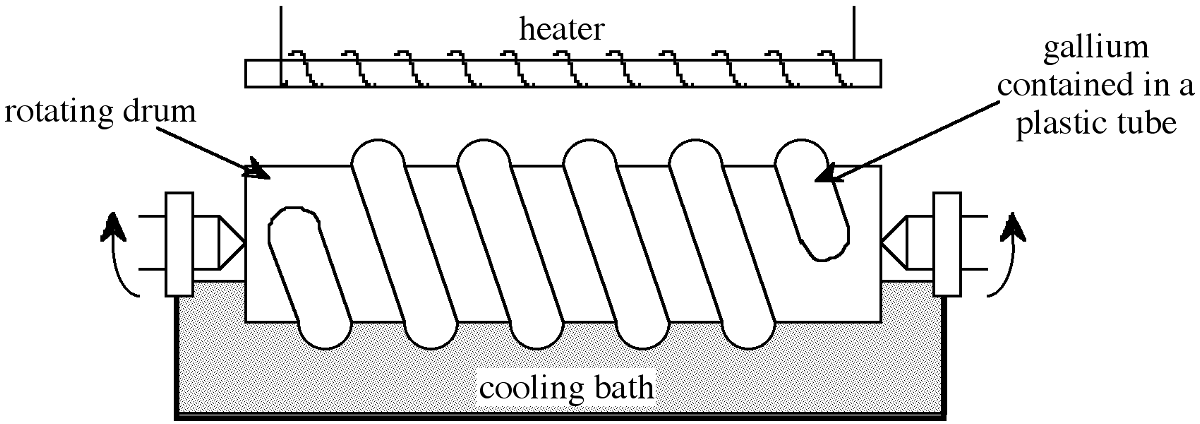
Типовий аналіз 98-99% чистого галію, отриманого в якості побічного продукту з процесу Байєра, наведено в табл\(\PageIndex{1}\). Цей матеріал додатково очищається до 99,99% шляхом хімічної обробки кислотами і O 2 при високих температурах з подальшою кристалізацією. Цей хімічний процес призводить до зменшення більшості металевих домішок на рівні проміле, див. Табл\(\PageIndex{1}\). Очищення до семи дев'яток 99,9999% можливо шляхом зонального рафінування, однак, оскільки коефіцієнт рівноважного розподілу залишкових домішок k 0 ≈ 1, потрібні багаторазові проходи, типово > 500. Низька температура плавлення галію забезпечує мінімізацію забруднення від стінки контейнера (що є значним при рафінуванні кремнієвої зони). Для того, щоб полегшити багатозонну переробку у відповідний час, використовується проста модифікація зонального рафінування, показана на малюнку\(\PageIndex{1}\). Галій міститься в пластиковій трубці, обгорнутій навколо обертового циліндра, який наполовину занурений в охолоджуючу ванну. Над галієвим пластиковим змійовиком розташований нагрівач. Таким чином, встановлюють ряд розплавлених зон, які проходять при обертанні барабана по одному гвинтовому сегменту за оборот. Таким чином, 500 пропусків можуть бути зроблені за відносно короткі проміжки часу. Типові рівні домішок зони галію, очищені таким чином, наведені в табл\(\PageIndex{1}\).
| Елемент | Процес Байєра (проміле) | Після кислотного/основного вилуговування (ppm) | 500 пропусків зони (проміле) |
|---|---|---|---|
| алюміній | 100-1000 | 7 | < 1 |
| кальцій | 10-100 | не виявлено | не виявлено |
| мідь | 100-1000 | 2 | < 1 |
| залізо | 100-1000 | 7 | < 1 |
| свинець | < 2000 | 30 | не виявлено |
| магній | 10-100 | 1 | не виявлено |
| ртуті | 10-100 | не виявлено | не виявлено |
| нікель | 10-100 | не виявлено | не виявлено |
| кремній | 10-100 | ≈ 1 | не виявлено |
| олово | 10-100 | ≈ 1 | не виявлено |
| титан | 10-100 | 1 | < 1 |
| цинку | 30 000 | ≈ 1 | не виявлено |
Виділення і очищення елементарного миш'яку
Елементарний миш'як (L. arsenicum, жовтий абопімент) існує в двох формах: жовтий (кубічний, As 4) і сірий або металевий (ромбоедричний). При природному достатку 1,8 проміле миш'як зустрічається відносно рідко, однак, це компенсується його наявністю в ряді поширених мінералів і відносною легкістю виділення. Миш'як, що містять мінерали, групуються в три основні класи: сульфіди realgar (As 4 S 4) і орпімент (As 2 S 3), оксид арсеноліту (As 2 O 3), а також арсеніди і сульфарееніди заліза, кобальту та нікелю. Мінерали цього останнього класу включають: лоеллінгініт (FeAs 2), сафарліт (CoAs), ніколіт (NiAs), раммельбергіт (NiAS 2), ансенопірит або міспікель (FeaS), кобалтит (COaS), енаргіт (Cu 3 Ass 4), гердсорфіт (NiaS) та квартсульфід укодот [(Co, Fe) АС]. У таблиці\(\PageIndex{2}\) наведені типові домішки в арсенопіриті.
| Елемент | Концентрація (проміле) | Елемент | Концентрація (проміле) |
|---|---|---|---|
| срібло | 90 | нікель | < 3,000 |
| золото | 8 | свинець | 50 |
| кобальт | 30 000 | платина | 0.4 |
| мідь | 200 | реній | 50 |
| германій | 30 | селену | 50 |
| марганцю | 3 000 | ванадій | 300 |
| молібден | 60 | цинку | 400 |
Миш'як отримують комерційно шляхом виплавки або FeAs 2 або FeAss при 650-700° C за відсутності повітря і конденсації сублімованого елемента (T sub = 613° C), (6.12.1).
\[ \text{FeAsS} \xrightarrow{\text{650-700 °C}} \text{FeS + As(vapor)} \xrightarrow{\text{<613 °C}} \text{As(solid)}\]
Отриманий таким чином миш'як з'єднують зі свинцем, а потім сублімують (T sub = 614° C), який пов'язує будь-які домішки сірки сильніше, ніж миш'як. Будь-який залишковий миш'як, який залишається в пастці в сульфіді заліза, відокремлюється шляхом утворення оксиду (As 2 O 3) шляхом випалу сульфіду на повітрі. Оксид сублімується в димохідну систему під час обсмажування, звідки він збирається і відновлюється деревним вугіллям при 700-800° C для отримання елементарного миш'яку. Миш'як напівпровідникового класу (> 99,9999%) утворюється зональним рафінуванням.
Синтез і очищення арсеніду галію.
Арсенід галію може бути отриманий шляхом безпосередньої реакції елементів, (6.12.2). Однак, хоча концептуально простий, синтез GaAs ускладнюється різним тиском пари реагентів та високоекзотермічною природою реакції. Крім того, оскільки синтез GaAs при атмосферному тиску супроводжується його одночасним розкладанням через втрату сублімацією миш'яку, синтез повинен здійснюватися під надлишковим тиском миш'яку, щоб підтримувати стехіометричний склад синтезованих GaAs.
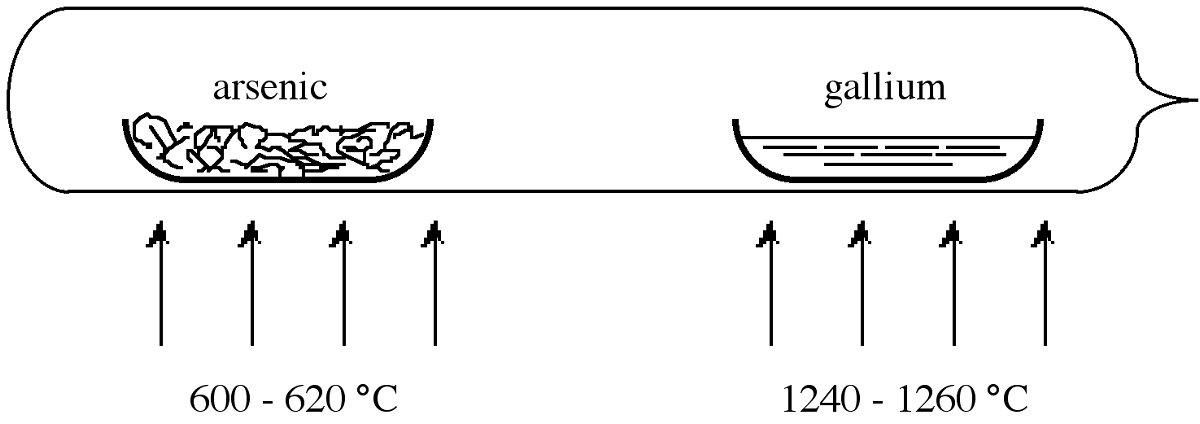
\[ \text{Ga(liquid) + As(vapor)} \xrightarrow{ \text{>1240 °C}} \text{GaAs(solid)}\]
Для того щоб подолати проблеми, пов'язані з втратою миш'яку, реакцію зазвичай проводять в герметичній реакційній трубці. Однак, якщо в реакції використовується стехіометрична кількість миш'яку, необхідно використовувати постійну температуру 1238° C, щоб підтримувати бажаний надлишковий тиск миш'яку в 1 атм. Практично простіше використовувати великий надлишок миш'яку, нагрітого до більш низької температури. У цій ситуації тиск в трубці приблизно дорівнює рівноважному тиску пари летючого компонента (миш'яку) при більш низькій температурі. Таким чином, надлишковий тиск в 1 атм миш'яку може зберігатися, якщо всередині герметичної трубки елементарний миш'як нагріти до 600-620° C, тоді як GaAs підтримується на рівні 1240-1250° C.
\(\PageIndex{2}\)На малюнку показана герметична конфігурація трубки, яка зазвичай використовується для синтезу GaAs. Трубка нагрівається всередині двозонної печі. Човни, що тримають реагенти, зазвичай виготовляються з кварцу, однак графіт також використовується, оскільки останній має ближчий збіг теплового розширення до продукту GaAs. Якщо потрібна більш висока чистота, то використовується піролітичний нітрид бору (ПБН). Один з човнів завантажений чистим галієм, інший - миш'яком. Між човнами може бути розміщена пробка з кварцової вати, щоб виступати в ролі дифузора. Потім трубку евакуюють і герметизують. Після доведення до правильних температур реакції (рис.\(\PageIndex{2}\)) пари миш'яку транспортуються до галію, і вони реагують з утворенням GaAs контрольованим чином. У таблиці\(\PageIndex{3}\) наведено типові концентрації домішок, виявлені в полікристалічних GaAs.
| Елемент | Концентрація (проміле) | Елемент | Концентрація (проміле) |
|---|---|---|---|
| бор | 0.1 | кремній | 0,02 |
| вуглець | 0.7 | фосфор | 0.1 |
| азоту | 0.1 | сірки | 0,01 |
| кисень | 0.5 | хлору | 0,08 |
| фтору | 0.2 | нікель | 0,04 |
| магній | 0,02 | мідь | 0,01 |
| алюміній | 0,02 | цинку | 0,05 |
Полікристалічні GaAs, що утворюються в результаті прямої реакції елементів, часто використовують як вихідний матеріал для росту монокристалів через зростання кристалів Бріджмана або Чохральського. Також можна готувати монокристали GaAs безпосередньо з елементів за допомогою in-situ, або прямого, компаундування в рідкій інкапсульованій під високим тиском технології Чохральського (HPLEC).
Зростання кристалів арсеніду галію
При розгляді синтезу сполук групи 13-15 для електронних застосувань сама природа поведінки напівпровідників вимагає використання монокристалічних матеріалів високої чистоти. Тому синтезовані вище полікристалічні матеріали малопридатні для 13-15 напівпровідників, але можуть, однак, служити вихідним матеріалом для розплаву вирощених монокристалів. Для GaAs, безсумнівно, найважливіших 13-15 (III - V) напівпровідників, розплавити вирощені монокристали досягаються однією з двох методик: методикою Бріджмана і технікою Чохральського.
Зростання Бріджмена
Техніка Бріджмана вимагає двозонної печі, типу, показаного на малюнку\(\PageIndex{3}\). Зона лівої руки підтримується при температурі близько 610° C, що дозволяє достатній надлишковий тиск миш'яку в герметичній системі, щоб запобігти втраті миш'яку з арсеніду галію. Права сторона печі містить полікристалічну сировину GaAs, що утримується при температурі трохи вище її температури плавлення (близько 1240° C). У міру руху печі зліва направо розплав остигає і твердне.
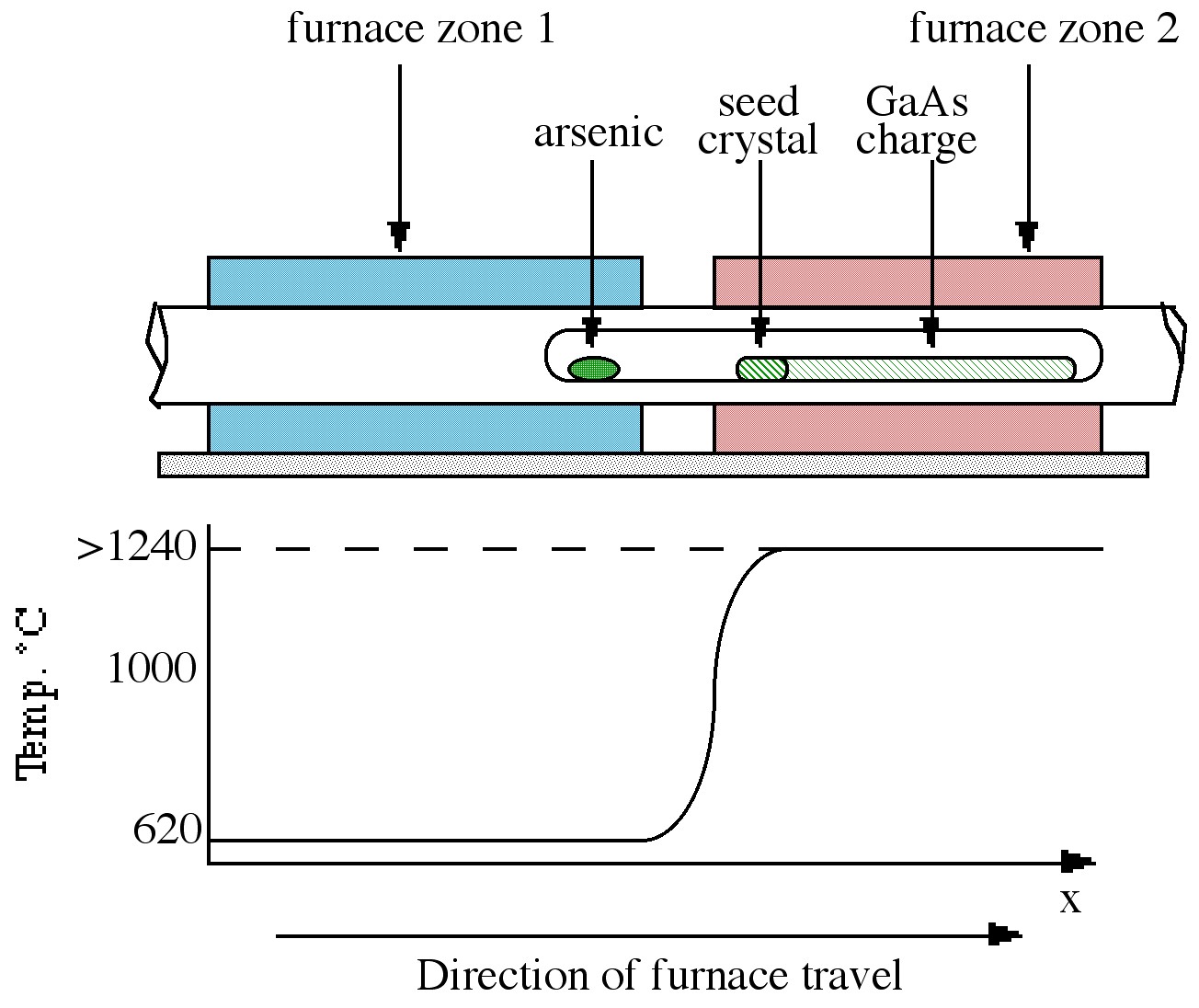
Якщо кристал насіння розміщений на лівій стороні розплаву (у точці, де градієнт температури такий, що плавиться лише кінець), певна орієнтація монокристала може поширюватися на межі розділу рідина-тверде тіло в кінцевому підсумку, щоб отримати монокристал.
Зростання Чохральського
Методика Чохральського, яка є найбільш часто використовуваною технікою в промисловості, показана на малюнку\(\PageIndex{4}\). Процес спирається на контрольоване вилучення кристала насіння з рідкого розплаву. Коли насіння опускається в розплав, відбувається часткове плавлення наконечника, створюючи рідку тверду поверхню, необхідну для росту кристалів. У міру вилучення насіння відбувається затвердіння і орієнтація насіння розмножується на вирощений матеріал. Змінні параметри швидкості виведення і швидкості обертання можуть контролювати діаметр кристалів і чистоту. Як показано\(\PageIndex{4}\) на малюнку, розплав GaAs укритий триоксидом бору (B 2 O 3). Укупорочний шар, інертний до GaAs, запобігає втраті миш'яку, коли тиск на поверхню вище атмосферного тиску. Зростання GaAs за цією методикою, таким чином, називається рідким капсульованим зростанням Чохральського (LEC).
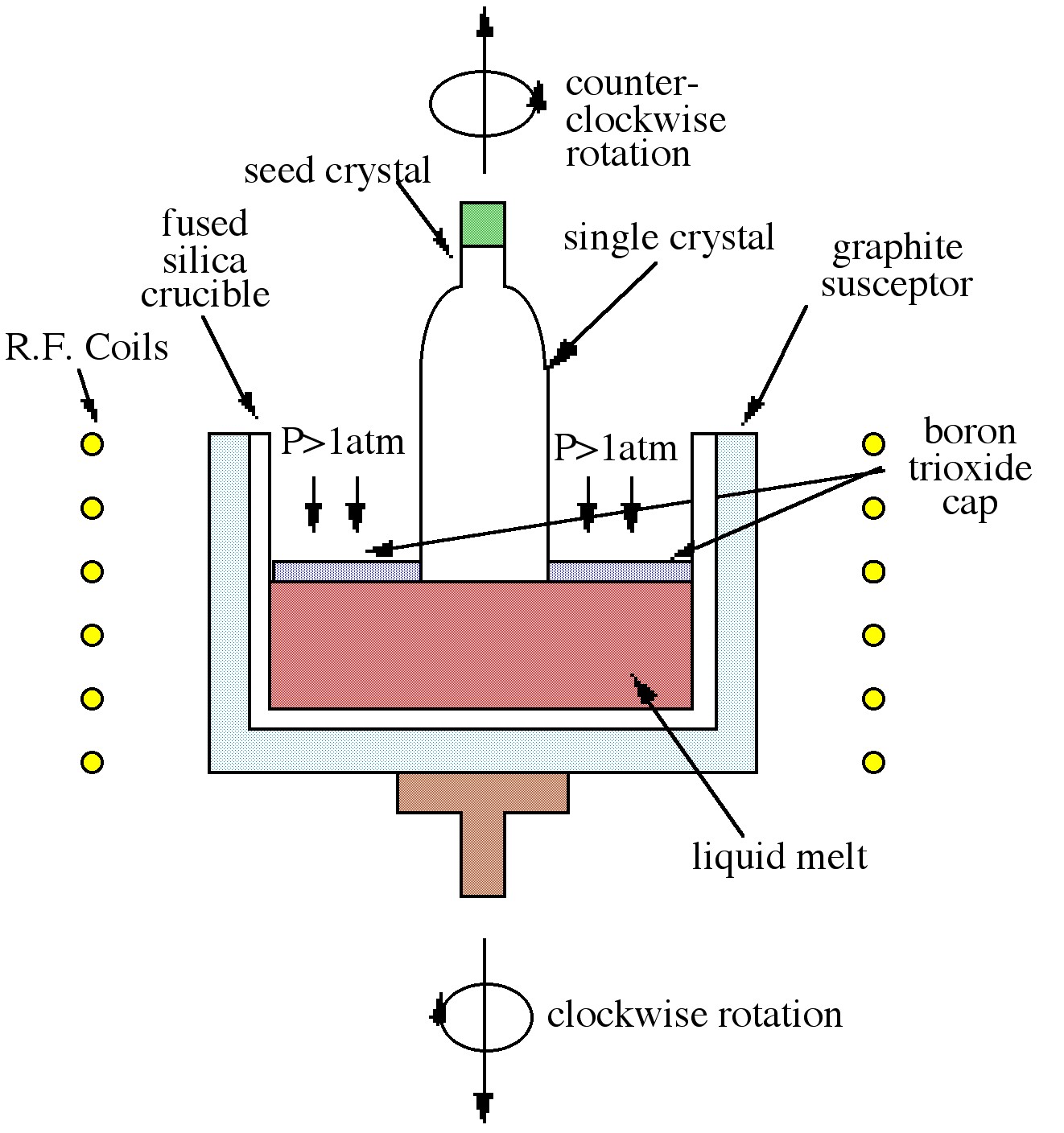
Хоча методика Бріджмана значною мірою сприяє зростанню GaAs, пластини більшого діаметру можна отримати методом Чохральського. Обидва ці методи розплаву виробляють матеріали, сильно забруднені тиглем, що робить їх придатними майже виключно як матеріал основи. Ще одним недоліком цих прийомів є отримання дефектів матеріалу, викликаних процесом розплаву.
Бібліографія
- Ганді С.К., Принципи виготовлення СБС: кремній і арсенід галію. Вілі-міжнауковий, Нью-Йорк, (1994).
- Дж. Краускопф, Дж. Мейер, Б. Відеманн, М. Вальдшмідт, К. Бетге, Г. Вольф, і W. Schültze, 5-а конференція з напівізоляційних матеріалів III-V, Мальме, Швеція, 1988, ред. Гроссман і Л.Ледебо, Адам-Хільгер, Нью-Йорк (1988).
- Пфанн, «Зона плавлення», «Джон Уайлі та сини», Нью-Йорк (1966).
- Вільямс Р.Е., Методи обробки арсеніду галію. Будинок Артех (1984).
- Властивості арсеніду галію. Ред. Брозель і Г. Е. Стілман. 3-е изд. Інститут інженерів-електриків, Лондон (1996).