5.2: Номенклатура
Класифікація лігандів
Давайте трохи ближче розглянемо ліганди і подивимося, як ми можемо їх класифікувати. Один із способів - класифікувати їх на монодентатні та багатозубчасті ліганди.
Монодентатні ліганди мають лише одну точку кріплення до іона металу.
Визначення: Монодентатний ліганд
Монодентатні ліганди мають тільки одну точку кріплення до іона металу
Прикладами для таких лігандів є галогенідні ліганди, аміак як ліганд і вода як ліганд. Молекули часто мають різні назви, коли діють як ліганди, і ви повинні знати ці назви. Наприклад, воду як ліганд називають аква-лігандом, аміак як ліганд називають аміновим лігандом, хлорид як ліганд називається хлоролігандом.
Ліганди з більш ніж однією точкою кріплення називаються багатозубчастими лігандами, або хелатними лігандами.
Визначення: Багатозубчасті ліганди
Багатозубчасті ліганди мають дві або більше точок кріплення до іона металу
Комплекси з хелатними лігандами називаються хелатними комплексами. Грецькі приставки вказують, скільки точок кріплення має ліганд (рис.5.2.1).

Якщо їх два, то у нас бідентатний ліганд, коли їх три, у нас тризубчастий ліганд. Ми використовуємо приставки tetra, penta і hexa для позначення чотирьох, п'яти і шести точок кріплення відповідно. Багатозубчасті ліганди з більш ніж шістьма точками кріплення зустрічаються рідко.

Назва хелатний ліганд походить від грецького слова chela, що означає великий кіготь омара. Ми бачимо, що наш омар на малюнку 5.2.2 радісно хелює іон Ni 2 + своїми двома великими кігтями!
Загальні двозубчасті ліганди
Кілька поширених бідентатних лігандів показані нижче.
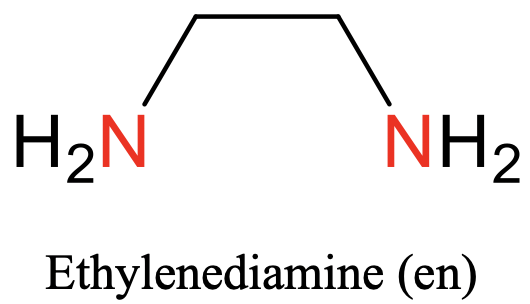
Перший з них - етилендіамін. Він має два атома-донора азоту, які можуть зв'язуватися з металом, і вони розділені групою етилену (рис.5.2.3).
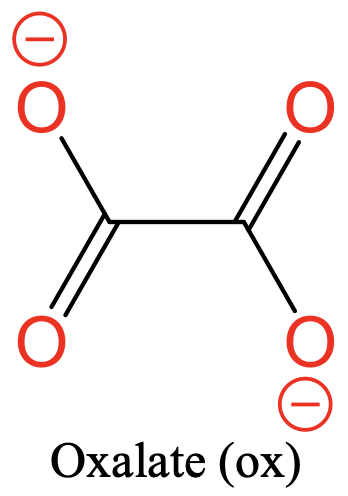
Ще один поширений ліганд - оксалатний ліганд. Він має два атома донора O, розділених двома атомами вуглецю. Є два негативних заряду, які делокалізовані над чотирма атомами O (рис.5.2.4).
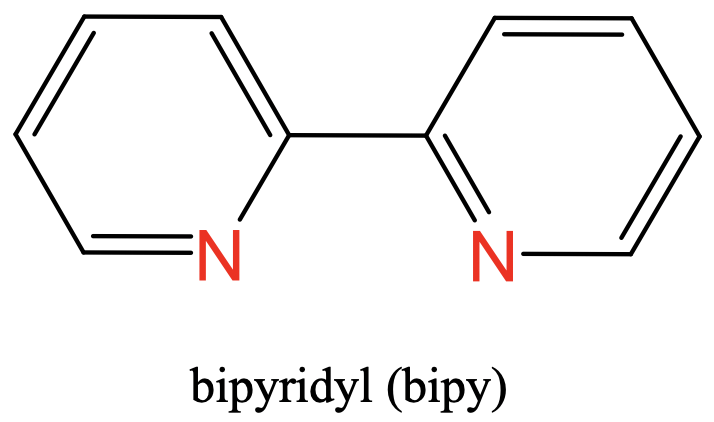
Як третій приклад можна побачити біпіридиловий ліганд, який має два атоми-донора N у складі двох ароматичних кілець. Два атома N розділені двома атомами вуглецю (рис.5.2.5).
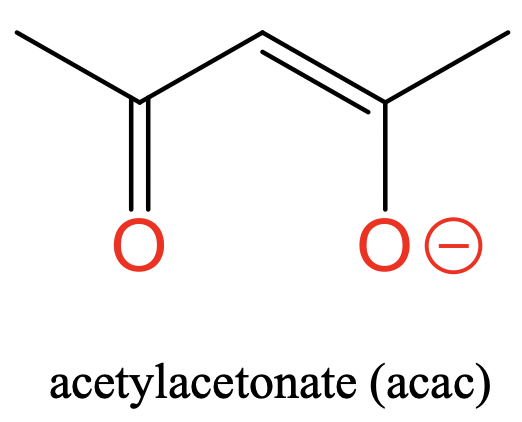
Нарешті, існує ацетилацетонат ліганд з двома атомами донора O, розділеними трьома атомами С (рис.5.2.6). Ацетилацетонат несе негативний заряд, який делокалізується між двома атомами O. При цьому атоми-донори розділені трьома вуглецями.
Поширені ліганди часто мають специфічні абревіатури. Вони часто використовуються в формулах координаційних сполук з цими лігандами. Наприклад, ліганд етилендіаміну скорочено en, оксалатний ліганд - скорочено ox, біпіридиловий ліганд скорочено bipy, а ацетилацетонат ліганд скорочено acac. Існують не тільки бідентатні ліганди з O і N донорними атомами, але і з іншими, такими як P і S.
Кільця в комплексах з хелатними лігандами
У більшості хелатних лігандів донорські атоми розділені двома або трьома іншими атомами, переважно атомами вуглецю. Це пояснюється тим, що в цьому випадку хелатні ліганди можуть утворювати п'яти- і шестичленні кільця з іоном металу (рис.5.2.7).
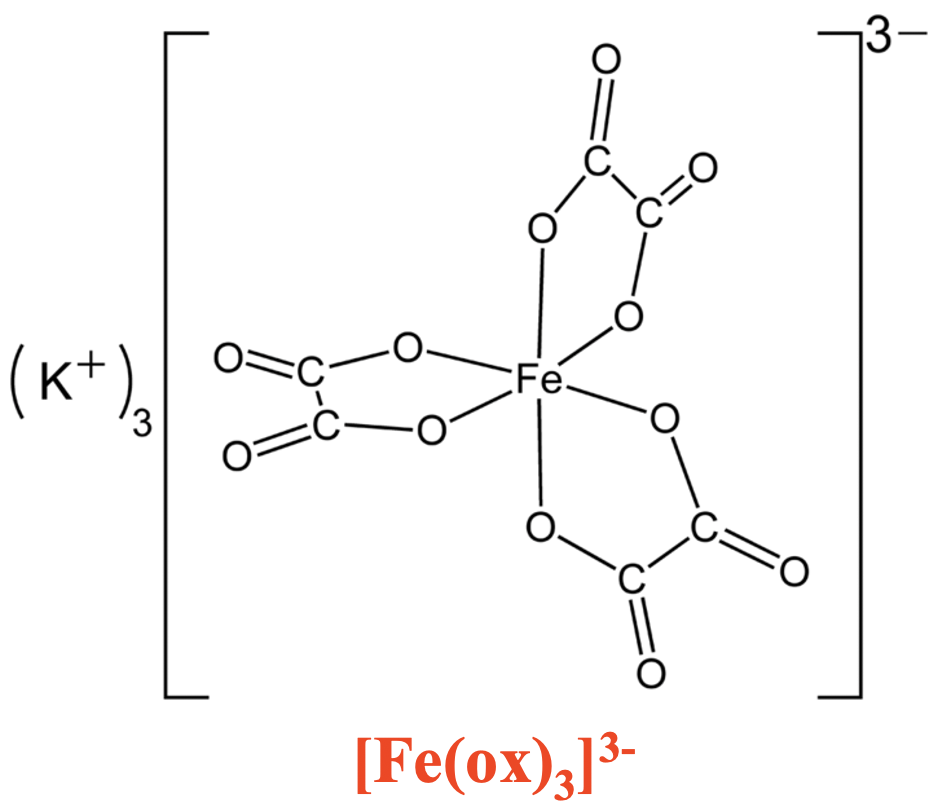
Ви можете бачити, що комплекс заліза тріоксолато вище має три п'ятичленні кільця, що містять один Fe, два O та два атоми С. Ці розміри кілець особливо стабільні, оскільки вони мають найменшу кільцеву напругу. Як наслідок, відповідні хелатні комплекси особливо стабільні.
Тризубчасті ліганди
Ось кілька прикладів для тризубчастих лігандів.
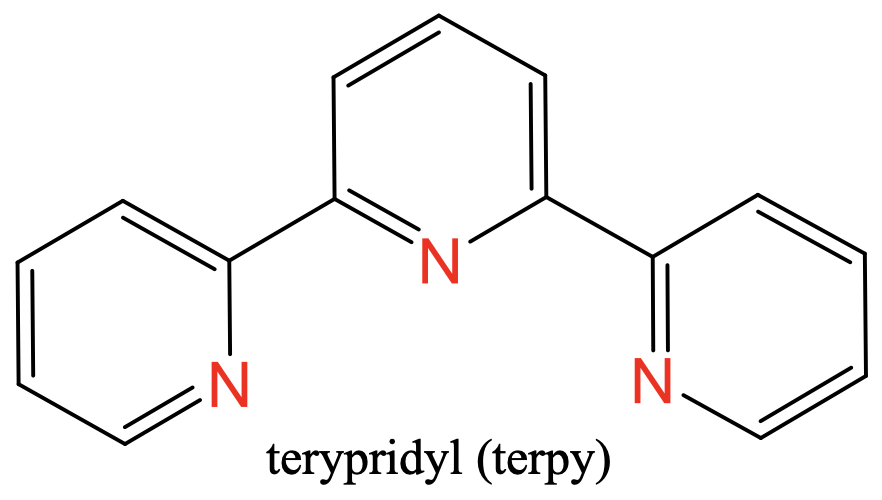
Перший - терпіридил, скорочено «Терпи» (рис. 5.2.8), другий - бісетілентріамін, скорочено «тріс» (рис.5.2.9).
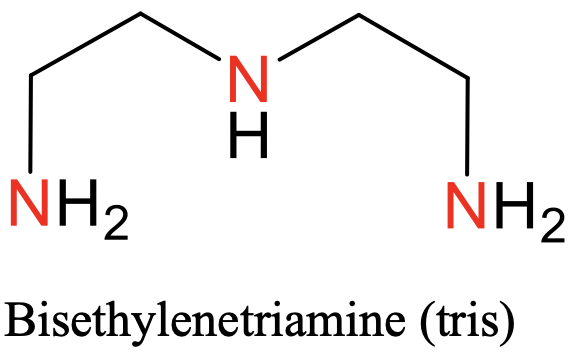
Обидва вони мають три атома N-донора, розділених двома атомами вуглецю. У «трис» -ліганді є дві групи етилену між атомами N, у випадку з «терпі» -лігандом N-атоми входять до складу трьох ароматичних кілець (рис.5.2.8 і рис.5.2.9)
тетрадентатні ліганди
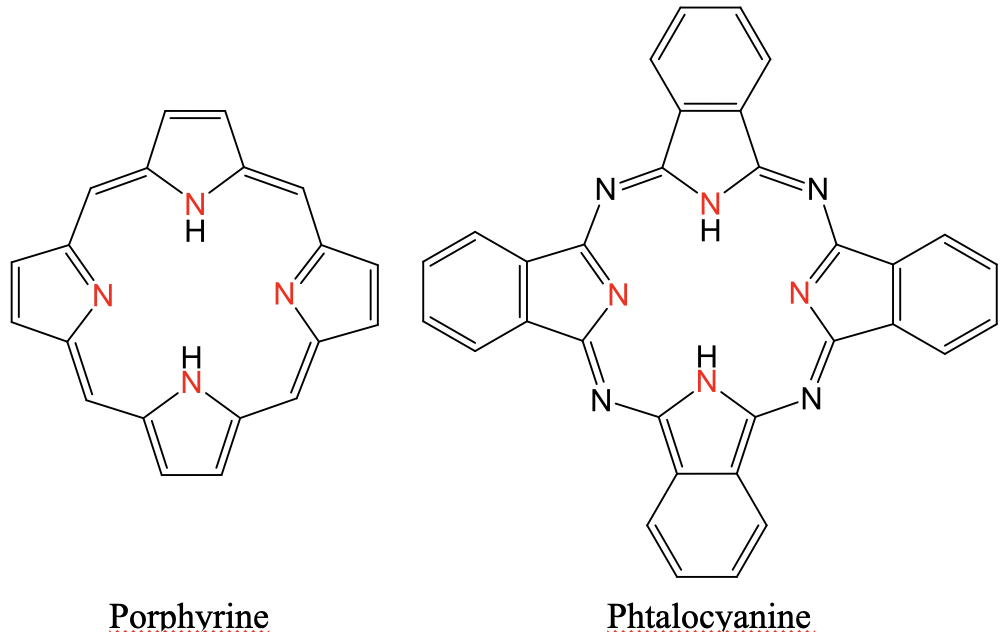
Два поширених тетрадентатних ліганда - порфірин і фталоціанін (рис. 5.2.9 і 5.2.10). Обидва є так званими макроциклічними лігандами, оскільки вони є великими циклами. Вони обидва мають чотири атоми N-донора, що вказують всередину циклу. Фталоціаніновий ліганд має чотири додаткові атоми N, що з'єднують п'ятичленні кільця за допомогою імін-зв'язків. Далі фталоціанін має чотири бензольні кільця, сплавлені з чотирма п'ятичленними кільцями. Порфіриновий ліганд дуже важливий в біологічних системах. Наприклад, він входить до складу білка гемоглобіну. При цьому в центрі порфіринового кільця сидить іон Fe 2 +. Він також є компонентом хлорофілу, і в цьому випадку іон Mg 2 + сидить в центрі кільця. Фталоціанінові ліганди важливі як компоненти барвників.
Гексадентат ліганд, ЕДТА
Дуже поширеним гексадентатним лігандом є ліганд етилендіамінтетраоцтової кислоти (ЕДТА). Її структуру ви можете побачити нижче (рис.5.2.11).
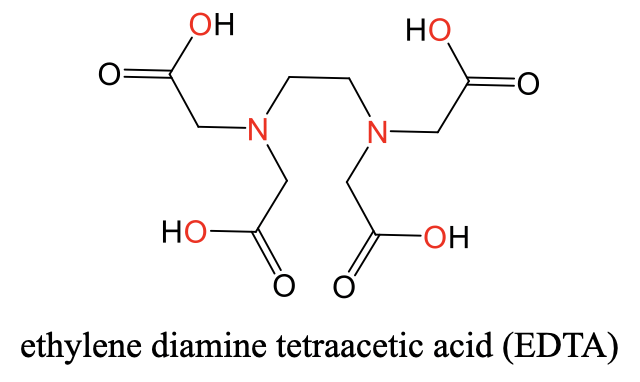
Він має два атома N-донора, розділених групою етилену. Кожен N-атом додатково з'єднується з двома ацетильними групами. Загальні чотири ацетильні групи несуть чотири атоми О-донора. Загалом, існує шість донорських атомів. Шість атомів-донорів можуть октаедрильно координувати іон металу, такий як іон Ca 2 + (рис. 5.2.12).
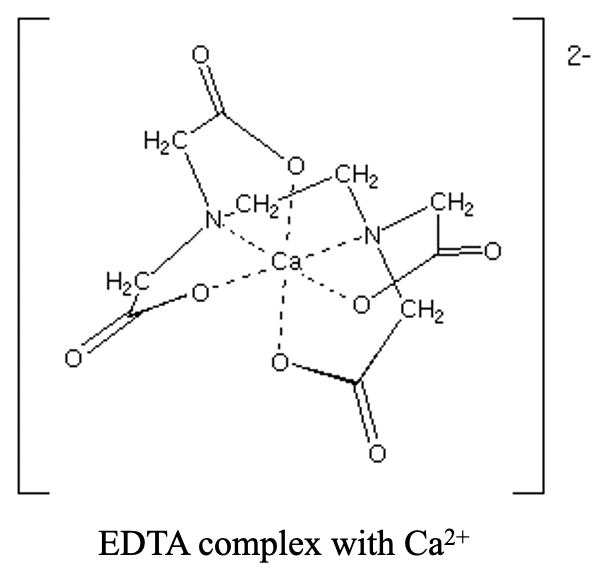
У скоординованій формі ЕДТА ліганд депротонується, а атоми-донори O несуть негативний заряд. Тому комплекс ЕДТА з двовалентним катіоном, таким як Ca 2+, має 2- заряд.
Номенклатура комплексів
Тепер давайте розробимо номенклатуру координаційної хімії, щоб ми могли спілкуватися з ними в освіченій формі. Одним з важливих аспектів є те, що ми називаємо кількість лігандів. Для позначення номера конкретного ліганда використовуємо грецькі приставки (рис.5.2.13).
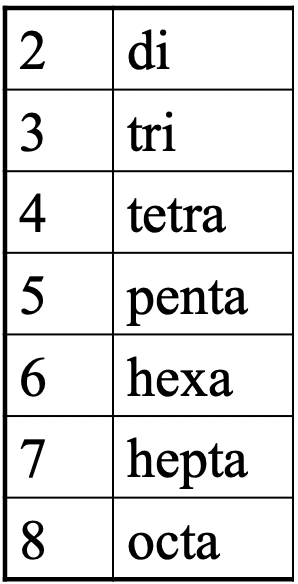
Це ті самі префікси, які ми дізналися, коли обговорювали багатозубчасті ліганди. Якщо є два ліганди, ми використовуємо префікс di, якщо їх три, ми використовуємо префікс tri- і так четвертий.
Номенклатура комплексів з аніонними координаційними сферами
Тепер ми можемо розробити повну назву координаційного з'єднання. Розглянемо спочатку сполуки зі складними аніонами. Ми можемо назвати їх відповідно до трьох кроків.
На першому кроці ми називаємо лічильник катіона. Ми не враховуємо кількість зустрічних катіонів в назві.
Далі визначаємо назву і кількість лігандів. Якщо ліганд аніонний, він отримує суфікс «o». Відзначимо, що іноді для зручності вимови використовуються абревіатури. Наприклад, Cl - це хлороліганд, а не хлоридоліганд. Ви повинні запам'ятати ці коротші форми. Як правило, коли аніон закінчується на «ide», «ide» опускається і замінюється на «o».
Третій крок - назвати іон металу і додати суфікс «з'їв» до назви. Ви можете додати число окислення металу римськими цифрами або заряд комплексного аніона в дужках після назви металу. Перша номенклатура називається системою «Шток», друга - системою «Юінг-Бассетт». Зверніть увагу, що якщо символ елемента металу походить від латинської назви, то використовується латинська назва. Наприклад, якщо срібло є металом, то складний аніон - це аргентат, якщо свинець - метал, складний аніон - це схил. Також тут часто використовуються скорочення, щоб полегшити вимову. Якщо назва закінчується на «um», це закінчення замінюється на «їли».
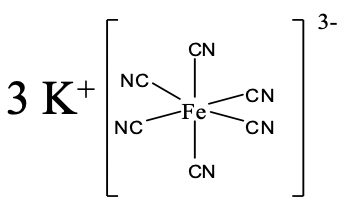
Приклад координаційних сполук зі складним аніоном наведено вище (рис.5.2.14). Як називається його? Є три катіони K +, тому назва починається з калію. Далі ми розуміємо, що існує шість ціанідних аніонів у вигляді лігандів, тому назва продовжує «гексачано». Назва металу залізо, але ми використовуємо латинську назву ferrum, а закінчення «um» замінюємо закінченням «їли». Число окислення заліза становить +3. Ми бачимо, що з того, що комплексний іон має 3- заряд, а шість ціанолігандів мають по 1 заряду кожен. Якщо ми використовували систему Stock, ми б розмістили римські цифри для +3 у дужках за назвою. Якби ми використовували систему Юінга-Бассетта, ми б розмістили (3-) для негативного заряду комплексу за назвою. Тож загалом це буде або гексаціаноферрат калію (III), або гексаціаноферрат калію (3-).
Вправи
Як би ви назвали наступні дві сполуки?
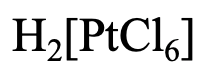
Давайте розглянемо перший приклад (рис.5.2.17). По-перше, нам потрібно назвати катіон. Що це таке? Це просто «водень». Далі нам потрібно визначитися з назвою і кількістю лігандів. У нас шість хлоролігандів, тому назва продовжується з «гексахлоро». Назва металу - платина. Закінчення «um» замінюємо на «їли». У системі Stock римська цифра буде (IV), оскільки ступінь окислення Pt становить +4. Ми бачимо це з того, що складний аніон має 2- заряд, а шість хлоролігандів мають по 1 заряду. Ми повинні додати +4 до -6, щоб дістатися до -2. Тому в системі Stock назва була б гексахлорплатинат водню (IV), а в системі Юінга-Бассетта - гексахлорплатинат водню (2-).
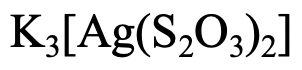
Другий приклад (рис. 5.2.18) має три катіони K +, тому назва починається з калію. Як називається ліганд? Назва аніона - тіосульфат. В даному випадку замінюємо закінчення «e» закінченням «o». У нас є два ліганди, тому це «дітіосульфато». Метал сріблястий, але ми використовуємо латинську назву «argentum», а закінчення «um» замінюємо закінченням «їли». Так що це «аргентат». Зплавлення частин разом дає «калію дітіосульфато аргентат». Число окислення Ag дорівнює +1, заряду у аніона -3. Так покласти або (I) в римські цифри або 3- в дужках позаду імені.
Номенклатура комплексів з катіонними координаційними сферами
Тепер назвемо комплекси зі складними катіонами. Ми називаємо спочатку складний катіон, а потім аніон. Потім визначаємо назву і кількість лігандів і префіксів відповідно. Якщо є аніонний ліганд, ми знову даємо йому суфікс «o». Потім ми називаємо метал. У цьому випадку ми завжди використовуємо англійські назви. Ми розміщуємо число окислення римськими цифрами або заряд складного катіона позаду назви, залежно від того, чи хочемо ми використовувати систему Stock або Ewing-Bassett.
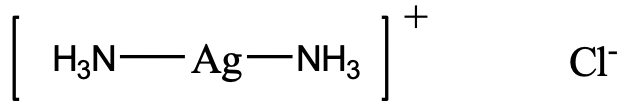
Наприклад, як би ви назвали комплекс, зображений вище (рис.5.2.19)? Є два ліганди NH 3, які є нейтральними. Ми повинні враховувати, що NH 3 як ліганд називається лігандом «аммін». Зверніть увагу, що вона пишеться з двома «m» посередині. Так починається назва «діаммін». Назва металу - срібло, а ступінь окислення срібла +1. Це пояснюється тим, що комплекс має 1+ заряд, а амінові ліганди нейтральні. Аніон являє собою хлоридний аніон.
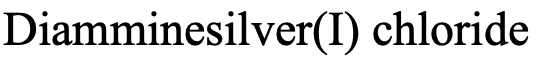
Тому назва в системі Stock буде «diamminesilver (I) хлорид (рис.5.2.20).
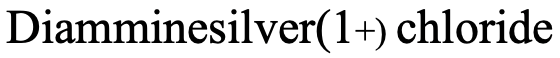
У системі Юінга-Бассетта це буде «хлорид діаммінсрібла (1+)» (рис. 5.2.21)
Вправи
Якими були б назви двох з'єднань, перерахованих нижче.
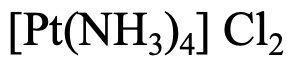
Перший приклад, рис. 5.2.22, має чотири ліганди NH 3, тому назва починається з тетраамміну. Платина є металом, тому назва продовжує «платина». Ступінь окислення Pt становить +2, оскільки складний катіон має заряд 2+, а ліганди - нейтральні до заряду. Назва аніона - «хорід». Отже, в цілому це «хлорид тетраамінплатини (II)» відповідно до системи Stock або «тетрамінплатиновий (2+) хлорид відповідно до системи Евінга-Бассетта.
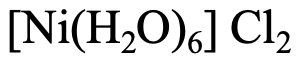
Друге з'єднання (рис. 5.2.23) має шість водних лігандів, тому назва починається з «гексааква», за яким слідує назва металу з - «нікель». Ступінь окислення Ni становить 2+, оскільки заряд на комплексному катіоні становить +2, а ліганди - нейтральні від заряду. Назва аніона - «хлорид». Тому назва - або хлорид гексааква нікелю (II), або «гексааканікель (2+) хлорид.
Номенклатура комплексів з катіонною та аніонною координаційними сферами
Існує також ймовірність того, що координаційне з'єднання складається зі складного катіона і складного аніона. У цьому випадку правила, обговорювані раніше, дотримуються єдине нове, що потрібно дізнатися, це те, що ми називаємо складний катіон першим і складний аніон другий.
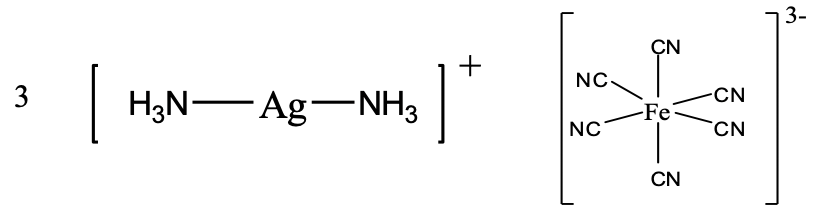
У зображеному з'єднанні (рис. 5.2.24) ми маємо катіон діаммін-срібла (I) і гексаціаноферрат (III) аніон.
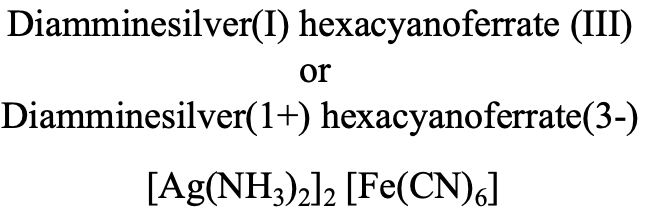
Звідси і назва діаммінсрібла (I) гексацианоферрат (III) в системі Stock або діаммін-срібло (1+) гексаціаноферрат (3-), рис. 5.2.24.
Номенклатура комплексів з більш ніж одним лігандом одного виду
Що робити, якщо в координаційному з'єднанні присутні різні ліганди? У цьому випадку ми називаємо ліганди в алфавітному порядку, і кожному ліганду даємо префікс відповідно до його номера.
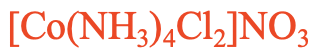
Наприклад: Яка назва [Co (NH 3) 4 Cl 2] NO 3, рис. 5.2.26? Це з'єднання зі складним катіоном, що містить амін і хлороліганди. Оскільки «а» стоїть перед «c» в алфавіті, ми повинні спочатку назвати аміновий ліганд. Існує чотири амінових ліганди і два хлороліганди. Тому використовуємо приставки «тетра» перед «аммін» і «ді» перед «хлоро». Так починається назва «тетраамміндихлор». Потім ми називаємо метал, який є кобальтом. Число окислення кобальту становить +3, оскільки є чотири нейтральних заряду амінових лігандів, два аніонних хлорліганда, а заряд на комплексному катіоні становить +1. +3 -2 = +1. Так в системі Stock з'єднання називається тетраміндіхлоркобальт (III) нітрат, в системі Евінг-Бассет його називають тетрамінодіхлоркобальт (1+) нітратом.

Зробимо ще один приклад, рис.5.2.27. У сполуці [Pt (NH 3) BrCl (H 2 O)] SO 4 є складний катіон з чотирма різними лігандами: ліганд «амін», «бромо» -ліганд, «хлоро» -ліганд та ліганд «аква». Який порядок у них? Згідно з алфавітом, на першому місці стоїть «аммін», «аква» - на другому, «бромо» - третє, а «хлоро» - четверте. Вони не отримують приставки, тому що для кожного з них є лише одна. Метал - платина, а його ступінь окислення становить +4, оскільки складний катіон має заряд 2+, і є два нейтральних ліганди, а саме аква і амінові ліганди, і два аніонних, а саме бромо і хлороліганди: +4 - 2 = +2.

Тому назва - сульфат амінааквабромохлорплатини (IV) в системі Stock, а амінеаквабромохлорплатина (2+) сульфат в системі Евінга-Бассетта, 5.2.28.
Номенклатура комплексів зі складними лігандами в координаційній сфері
Поки ми розглядали лише відносно прості ліганди, які були або одноатомними, або містили лише кілька атомів. Однак багато ліганди, зокрема хелатні ліганди, містять більше атомів, і мають більш складні назви. Ці імена вже можуть містити префікси, які ми використовуємо для нумерації лігандів. Наприклад, етилендіамінний ліганд - це хелатний ліганд з довшою назвою, який вже містить префікс «ді». У таких випадках, щоб уникнути двозначності, ми ставимо назву ліганду в дужки, а перед ним ставимо дещо інший префікс для обліку кількості лігандів.

Замість «di» ми використовуємо «bis», замість «tri» використовуємо «tris», замість «tetra» використовуємо «tetrakis», замість «pentakis» використовуємо «pentakis» і так далі, рис.5.2.29.
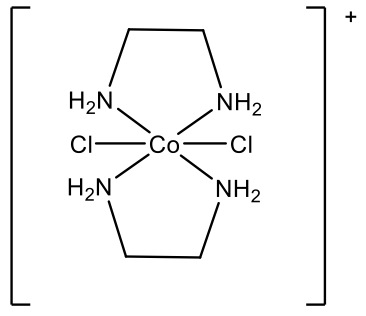
Наприклад, як називається складний катіон, зображений вище (рис.5.2.30)? Спочатку потрібно усвідомити, що існує два різних ліганди: хлорліганди та етилендіамінліганди. Нам потрібно спочатку назвати хлороліганди, тому що вони приходять на перше місце в алфавіті. Оскільки є два хлороліганди, ми використовуємо префікс «ді». Етилендіамінний ліганд поміщається в дужки, а замість «ді» використовується префікс «біс». Металом є кобальт у стані окислення +3, оскільки складний катіон має заряд 1+, і є два хлороліганди з зарядом 1- кожен, і два нейтральних заряду етилендіамінних лігандів: +3 -2 = +1.

Тому назва - дихлорробіс (етилендіамін) кобальт (III) в системі Stock і дихлорробіс (етилендіамін) кобальт (1+) в системі Юінга-Бассетта (рис.5.2.31).
Номенклатура комплексів з мостовими лігандами
Ліганди не можуть бути лише термінальними, вони також можуть перемикати два металеві центри. Щоб вказати, що ліганд - це мостовий ліганд, ми даємо йому префікс μ. Мостові ліганди названі перед кінцевими лігандами, а назва молекулярних фрагментів з кінцевими лігандами та іонами металів розміщено в дужках після назви мостового ліганду.
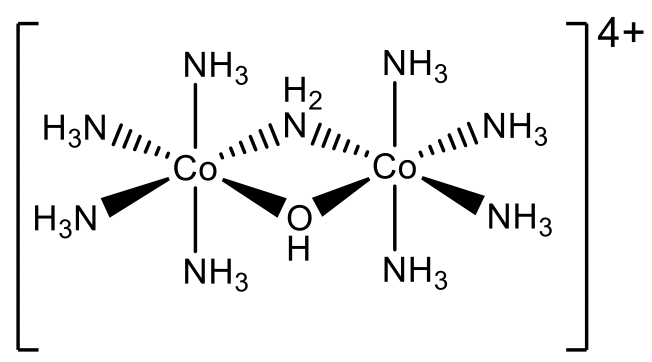
Так як називається складний катіон, зображений вище (рис.5.2.32)? Ми бачимо, що існує два різних мостових ліганда, один - гідроксоліганд OH -, а інший називається амідолігандом NH 2 -. Ці мостові ліганди об'єднують два однакових молекулярних фрагмента, що містять атом Co і чотири амінових ліганди кожен. Два мостові ліганди повинні бути названі першими, і ми повинні називати їх відповідно до алфавітного порядку. Звідси і починається назва «μ -amido- μ -гідроксо». Потім нам потрібно назвати два фрагменти, які мостові. Оскільки існує один Co і чотири ліганди NH 3, назва фрагмента - «тетрааммінекобальт». Тому що це більш складне ім'я, ми повинні поставити його в дужки. Фрагментів два, тому нам потрібно використовувати приставку «біс». Ступінь окислення Co становить +3. Це пов'язано з тим, що є два аніонні ліганди, гідроксо та амідоліганд, які мають обидва 1- заряд. Інші ліганди нейтральні. Комплексний катіон несе 4+ заряд: +6-2=+4. Оскільки є два атоми Co, вони мають число окислення +6/2 = +3.

Звідси загальна назва за системою Stock - «μ -amido- μ -гідроксобіс (тетрааммінекобальт) (III)», рис.5.2.33.

У системі Юінга-Бассетта це μ -амідо- μ -гідроксобіс (тетрааммінекобальт) (4+), рис.5.2.34. Тепер ми завершили главу про номенклатуру.
