Асоціативне заміщення лігандів
- Page ID
- 104879
Незважаючи на святість 18-електронного правила для багатьох студентів металоорганічної хімії, найрізноманітніші стабільні комплекси мають менше 18 загальних електронів в центрі металу. Мабуть, найвідомішими прикладами цих комплексів є 14- і 16-електронні комплекси металів групи 10, які беруть участь в реакціях перехресного зв'язку.
Заміна ліганду в комплексах цього класу зазвичай відбувається за допомогою асоціативного механізму, що передбачає наближення вхідного ліганду до комплексу перед виходом з групи, що йде. Якщо мати на увазі цей принцип, здається досить легко передбачити, коли заміщення лігандів, ймовірно, буде асоціативним. Але як ми можемо визначити асоціативний механізм в експериментальних даних і які наслідки цього механізму?
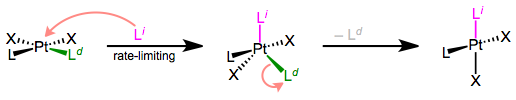
Прототиповий механізм асоціативного заміщення лігандів. Першим кроком є визначення ставки. Типовий механізм асоціативного заміщення лігандів показаний вище. Слід зазначити, що квадратна пірамідальна геометрія також можлива для проміжних, але зустрічається рідше. Почнемо з кінетики реакції.
Кінетика реакції
Кінетика реакції зазвичай використовується для з'ясування металоорганічних механізмів реакції, і заміщення лігандів не є винятком. Різні механізми заміщення можуть відповідати різним нормам, тому побудова залежності швидкості реакції від концентрації часто дозволяє розрізняти механізми. Закон швидкості асоціативного заміщення аналогічний закону реакції S N 2 - швидкість залежить від концентрацій обох вихідних матеріалів.
\[ L_nM–L^d + L_i → L_nM–L_i + L^d \]
\[ \dfrac{d[L_nM–L^i]}{dt} = rate = k_1[L_nM–L^d][L^i] \]
The easiest way to determine this rate law is to use pseudo-first-order conditions. Although the rate law is second order overall, if we could somehow render the concentration of the incoming ligand unchanging, the reaction would appear first order. The observed rate constant under these conditions reflects the constancy of the incoming ligand’s concentration (\(k_{obs} = k_1[L^i]\), where both \(k_1\) and \([Li]\) are constants). How can we make the concentration of the incoming ligand invariant, you ask? We can drown the reaction in ligand to achieve this. The teensy weensy bit actually used up in the reaction has a negligible effect on the concentration of the “sea” of starting ligand we began with. The observed rate is equal to \(k_{obs}[L_nM–L^d]\), as shown by the purple trace below. By determining \(k_{obs}\) at a variety of \([L^i]\) values, we can finally isolate \(k_1\), the rate constant for the slow step. The red trace below at right shows the idea.
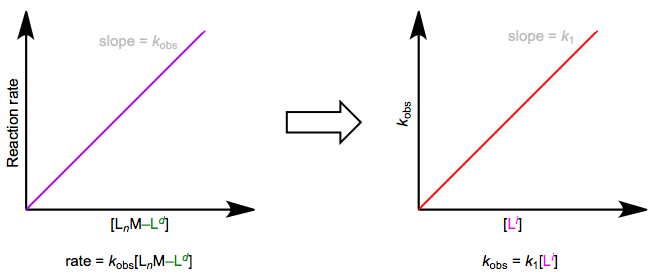
Асоціативне заміщення за умов псевдопершого порядку. Реакція «заболочена» вхідним лігандом.
У багатьох випадках червоний слід закінчується ненульовим y-перехопленням... цікаво, якщо ми обмежимося простим механізмом, показаним на першому малюнку цього поста. Ненульовий перехоплення передбачає більш складний механізм. Нам потрібно додати новий термін (покликаний з\(k_s\) причин, щоб незабаром з'ясуватися) до нашого першого набору рівнянь:
\[rate = (k_1[L_i] + k_s)[L_nM–L^d]\]
\[k_{obs} = k_1[L_i] + k_s\]
Повний закон ставки передбачає, що в механізмі бере участь якийсь інший крок (зі швидкістю ks [lnm—lD]), незалежний від вхідного ліганду. Щоб пояснити це спостереження, ми можемо викликати розчинник як реагент. Розчинник може асоціюватися з комплексом спочатку повільним кроком, потім вхідний ліганд може витіснити розчинник швидким кроком. Концентрація розчинника не входить в закон про норму, тому що, ну, він топить реагенти, і його концентрація зазнає незначних змін! Приклад цього механізму в контексті хімії Pt (II) наведено нижче.
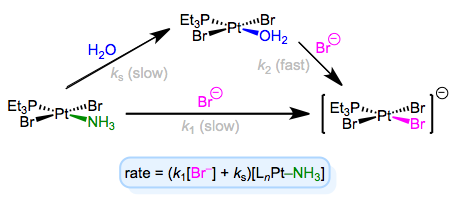
Асоціативне заміщення за участю розчинника — механізм подряпання голови для багатьох аспірантів з металоорганічних матеріалів!
В якості осторонь варто згадати, що ентропія активації асоціативного заміщення, як правило, негативна. Ентропія зменшується, коли вхідний ліганд і комплекс збираються разом у кроці визначення швидкості. Дисоціативна заміщення показує протилежну поведінку: втрата відходить ліганду в РДС збільшує ентропію, в результаті чого виникає позитивна ентропія активації.
Стереохімія заміщення
Як ми бачили в обговореннях транс-ефекту, що входять і відходять ліганди обидва займають екваторіальні позиції в тригональному біпірамідному проміжному. Виною всьому мікроскопічна оборотність: механізм прямого заміщення (зміщення відходить лігандом) повинен бути таким же, як і механізм зворотної реакції (зміщення вхідного лигандом). Це може бути заплутаним моментом, тому давайте розглянемо альтернативний механізм, який порушує мікроскопічну оборотність.
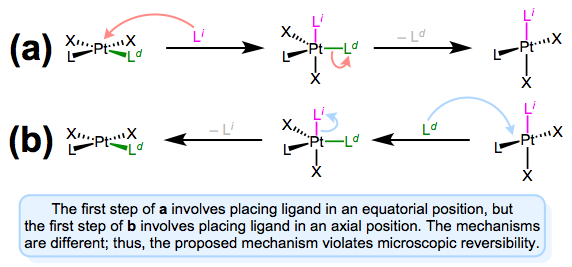
Механізм, що передбачає наближення до осьового положення та відхід від екваторіального положення, порушує мікроскопічну оборотність. Пряма і зворотна реакції a і b відрізняються!
На малюнку вище показано, чому механізм, що передбачає осьовий наближення та екваторіальний виліт (або навпаки), неможливий. Пряма і зворотна реакції відрізняються, по суті, в обох кроках. У прямому механізмі а вхідний ліганд входить в осьову ділянку. Але при зворотній реакції вхідний ліганд (а саме., що відходить ліганд в механізмі а) сидить на екваторіальному ділянці. Другі етапи кожного механізму теж відрізняються — a передбачає втрату екваторіального ліганду, тоді як b - втрата осьового ліганду. Коротше кажучи, цей механізм порушує мікроскопічну оборотність. А як щодо механізму, що передбачає осьовий підхід і осьовий виліт? Такий механізм малоймовірний на електронних підставах. Екваторіальні сайти більш багаті на електрони, ніж осьові ділянки, і σ зв'язку з осьовим\(d_{z^2}\) orbital is expected to be strong. Intuitively, then, loss of ligand from an axial site is less favorable than loss from an equatorial site.
I know what you’re thinking: what the heck does all of this have to do with stereochemistry? Notice that, in the equatorial-equatorial mechanism (first figure of this post), the axial ligands don’t move at all. The configuration of the starting complex is thus retained in the product. Although retention is “normal,” complications often arise because five-coordinate TBP complexes—like other odd-coordinate organometallic complexes—are often fluxional. Axial and equatorial ligands can rapidly exchange through a process called Berry pseudorotation, which resembles the axial ligands “cutting through” a pair of equatorial ligands like scissors (animation!). Fluxionality means that all stereochemical bets are off, since any ligand can feasibly occupy an equatorial site. In the example below, the departing ligand starts out cis to L, but the incoming ligand ends up trans to L.
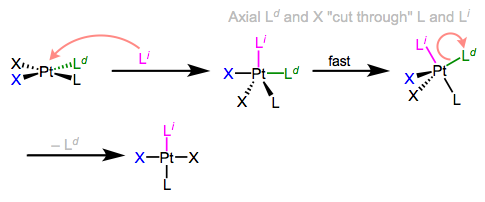
Псевдоротація ягід в розпал асоціативного заміщення лігандів.
Асоціативне заміщення в 18-електронних комплексах?
Асоціативне заміщення може відбуватися в 18-електронних комплексах, якщо йому передує дисоціація ліганду. Наприклад, зміни гаптичності циклопентадієнілу або інденіл-лігандів можуть відкрити координаційну ділянку, який може бути зайнятий новим лігандом для початку асоціативної заміни. Алліловий ліганд може перетворити з його π в σ форму, залишаючи відкритий координаційний сайт, де π зв'язок ліворуч. Особливо цікавим випадком є нітрозиловий ліганд — перетворення з лінійної форми в зігнуту форму відкриває ділянку для координації зовнішнього ліганду.
Резюме
Асоціативне заміщення лігандів поширене для комплексів з 16 сумарними електронами або менше. Реакція характеризується законом швидкості другого порядку, можливістю участі розчинника та тригональним біпірамідним проміжним продуктом, який часто є флуксіональним. Відкритий координаційний сайт необхідний для асоціативного заміщення, але такі сайти часто приховані в динамічності 18-електронних комплексів з лабільними лігандами.