2.3: Електронні фактори, що регулюють склеювання та структуру
- Page ID
- 20379
Зв'язок і структура сполуки визначаються електронними властивостями, такими як потужність складових атомів притягувати або відштовхувати електрони, молекулярні орбіталі, зайняті валентними електронами тощо Геометричні розташування атомів також впливають електронні взаємодії між незв'язками електронів. Тут описані деякі фундаментальні поняття.
(a) Ефективний ядерний заряд
Оскільки позитивний ядерний заряд, як правило, компенсується негативним зарядом внутрішніх електронів в електронній оболонці всередині валентних електронів, ядерний заряд, який відчувають валентні електрони, менший за цілочисельний заряд, Ze для атомного номера Z. це зменшення виражається захисна постійна\(\sigma\), а чистий ядерний заряд називається ефективним ядерним зарядом, Z eff e.
\[Z_{eff} = Z - \sigma\]
Ефективний ядерний заряд змінюється з різними орбіталями електронів і відстанями від ядра.
(б) Енергія іонізації
Енергія іонізації визначається як мінімальна енергія, необхідна для видалення електрона з атома в газовій фазі (g), як показано в наступному рівнянні. Енергія іонізації виражається в одиницях електронвольта (еВ), де 1 еВ = 96,49 кДж моль -1.
\[A(g) \rightarrow A^{+} (g) + e^{-} (g)\]
1-а енергія іонізації, яка видаляє самий зовнішній електрон, є найменшою, а 2-я і 3-я енергії іонізації, які додатково іонізують катіони, швидко збільшуються. Ентальпія іонізації, яка є стандартною зміною ентальпії процесу іонізації і використовується в термодинамічних розрахунках, - це енергія іонізації, помножена на RT (R - універсальна газова константа 8.31451 J K -1 моль -1 і T - температура, 2,479 кДж (0,026 еВ), в приміщенні температура). Різниця між цими двома параметрами невелика. 1-а енергія іонізації періодично змінюється з атомним номером по таблиці Менделєєва, причому нижня ліва (цезій, Cs) є найменшою, а верхня права (гелій, He) найбільша.
Зрозуміло, що лужні метали, як правило, мають найнижчі енергії іонізації, оскільки вони стабілізуються видаленням електрона для досягнення рідкісної конфігурації газу. Рідкісні газові елементи мають стабільні електронні структури, а енергії їх іонізації найбільші. Хоча енергія іонізації збільшується практично монотонно від лужних металів до рідкісних газів в кожен період, в декількох місцях відбуваються розвороти, такі як азот N і кисень O, а фосфор Р і сірка S. 1-е енергії іонізації наведені в табл\(\PageIndex{5}\).
| Атом | Я | A | \(\chi_{M}\) |
|---|---|---|---|
| Ч | 13.60 | 0,75 | \ (\ chi_ {М}\) ">7.18 |
| Він | 24.59 | \ (\ chi_ {M}\) "> | |
| Лі | 5.39 | 0,62 | \ (\ chi_ {М}\) ">3.01 |
| Бути | 9.32 | \ (\ chi_ {M}\) "> | |
| Б | 8.30 | 0,28 | \ (\ chi_ {M}\) ">4.29 |
| C | 11.26 | 1.27 | \ (\ chi_ {М}\) ">6.27 |
| П | 14.53 | \ (\ chi_ {M}\) "> | |
| O | 13.62 | 1.46 | \ (\ chi_ {M}\) ">7.54 |
| F | 17.42 | 3.40 | \ (\ chi_ {М}\) ">10.41 |
| Ne | 21.56 | \ (\ chi_ {M}\) "> | |
| Na | 5.14 | 0,55 | \ (\ chi_ {M}\) ">2.85 |
| Мг | 7.65 | \ (\ chi_ {M}\) "> | |
| Аль | 55.99 | 0,44 | \ (\ chi_ {М}\) ">3.22 |
| СІ | 8.15 | 1.39 | \ (\ chi_ {M}\) ">4.77 |
| Р | 10.49 | 0,75 | \ (\ chi_ {M}\) ">5.62 |
| S | 10.36 | 2.08 | \ (\ chi_ {M}\) ">6.22 |
| Cl | 12.97 | 3.61 | \ (\ chi_ {M}\) ">8.29 |
| Ар | 15.76 | \ (\ chi_ {M}\) "> | |
| К | 4.34 | 0,50 | \ (\ chi_ {М}\) ">2.42 |
| Ca | 6.11 | 0,02 | \ (\ chi_ {М}\) ">3.07 |
| Sc | 6.56 | 0,19 | \ (\ chi_ {М}\) ">3.38 |
| Ti | 6.83 | 0,08 | \ (\ chi_ {М}\) ">3.45 |
| V | 6.75 | 0,53 | \ (\ chi_ {М}\) ">3.64 |
| Cr | 6.77 | 0,67 | \ (\ chi_ {М}\) ">3.72 |
| Мн | 7.44 | \ (\ chi_ {M}\) "> | |
| Fe | 7.90 | 0,15 | \ (\ chi_ {М}\) ">4.03 |
| Co | 7.88 | 0.66 | \ (\ chi_ {М}\) ">4.27 |
| Ni | 7.64 | 1.16 | \ (\ chi_ {М}\) ">4.40 |
| Cu | 7.73 | 1.24 | \ (\ chi_ {M}\) ">4.48 |
| Zn | 9.99 | \ (\ chi_ {M}\) "> | |
| Га | 6.00 | 0,30 | \ (\ chi_ {М}\) ">3.20 |
| Ге | 7.90 | 1.23 | \ (\ chi_ {M}\) ">4.61 |
| Як | 9.82 | 0,81 | \ (\ chi_ {М}\) ">5.31 |
| Се | 9.75 | 2.02 | \ (\ chi_ {M}\) ">5.89 |
| Br | 11.81 | 3.36 | \ (\ chi_ {М}\) ">7.59 |
| Кр | 14.00 | \ (\ chi_ {M}\) "> | |
| Рб | 4.18 | 0,49 | \ (\ chi_ {М}\) ">2.34 |
| Sr | 5.69 | 0,11 | \ (\ chi_ {M}\) ">2.90 |
| У | 622 | 0,31 | \ (\ chi_ {М}\) ">3.27 |
| Зр | 6.63 | 0,43 | \ (\ chi_ {М}\) ">3.53 |
| Нб | 6.76 | 0,89 | \ (\ chi_ {М}\) ">3.83 |
| Пн | 7.09 | 0,75 | \ (\ chi_ {М}\) ">3.92 |
| Ру | 7.36 | 1.05 | \ (\ chi_ {М}\) ">4.26 |
| Rh | 7.46 | 1.14 | \ (\ chi_ {М}\) ">4.30 |
| Pd | 8.34 | 0,56 | \ (\ chi_ {М}\) ">4.45 |
| Ag | 7.58 | 1.30 | \ (\ chi_ {М}\) ">4.44 |
| Cd | 8.99 | \ (\ chi_ {M}\) "> | |
| В | 5.79 | 0,30 | \ (\ chi_ {М}\) ">3.10 |
| Сн | 7.34 | 1.11 | \ (\ chi_ {M}\) ">4.23 |
| Сб | 8.64 | 1.07 | \ (\ chi_ {M}\) ">4.86 |
| Te | 9.01 | 1.97 | \ (\ chi_ {M}\) ">5.49 |
| Я | 10.45 | 3.06 | \ (\ chi_ {M}\) ">6.76 |
| Xe | 12.13 | \ (\ chi_ {M}\) "> | |
| Cs | 3.89 | 0,47 | \ (\ chi_ {M}\) ">2.18 |
| Ба | 5.21 | 0,15 | \ (\ chi_ {M}\) ">2.68 |
| Ла | 5.58 | 0,50 | \ (\ chi_ {М}\) ">3.09 |
| Hf | 6.83 | 0.00 | \ (\ chi_ {М}\) ">3.42 |
| Та | 7.89 | 0,32 | \ (\ chi_ {М}\) ">4.11 |
| Ш | 7.98 | 0.82 | \ (\ chi_ {М}\) ">4.40 |
| Re | 7.88 | 0,15 | \ (\ chi_ {М}\) ">0.40 |
| Ос | 8.70 | 1.10 | \ (\ chi_ {M}\) ">4.90 |
| Ір | 9.10 | 1.60 | \ (\ chi_ {М}\) ">5.40 |
| Пт | 9.00 | 2.13 | \ (\ chi_ {M}\) ">5.61 |
| Au | 9.23 | 2.31 | \ (\ chi_ {M}\) ">5.77 |
| Hg | 10.44 | \ (\ chi_ {M}\) "> | |
| Тл | 6.11 | 0,20 | \ (\ chi_ {М}\) ">3.16 |
| Пб | 7.42 | 0,36 | \ (\ chi_ {М}\) ">3.89 |
| Бі | 7.29 | 0,95 | \ (\ chi_ {М}\) ">4.12 |
(c) спорідненість до електронів
Електронна спорідненість - це негативна ентальпія посилення електронів\(\Delta\) H наприклад атома в газовій фазі, як показано в наступному рівнянні і позначається A e (= -\(\Delta\) H наприклад) (табл.\(\PageIndex{5}\)).
\[A(g) + e^{-} (g) \rightarrow A^{-} (g)\]
Це може розглядатися як іонізаційна ентальпія аніону. Оскільки атоми галогену досягають рідкісних конфігурацій газових електронів, якщо до них додається електрон, їх електронна спорідненість велика.
(г) Електронегативність
Електронегативність є одним з найбільш фундаментальних атомних параметрів, який чисельно виражає тенденцію до залучення електронів до атомів в молекулі. Це дуже корисно для пояснення відмінностей у зв'язку, структурі та реакції з точки зору атомних властивостей. Запропоновано різні схеми для пояснення теоретичної основи сили притягання електронів, і дослідження досі активно шукають нові числові значення електронегативності. Шкала Паулінга, вперше введена в 1932 році, все ще є найбільш часто використовуваною, і наступні нові числові значення виправдані, якщо вони близькі до показників Полінга.
Полінг визначив електронегативність як кількісний іонний характер зв'язків. Спочатку в якості формули було запропоновано наступне рівняння для визначення іонного характеру зв'язку між атомами А і В.
\[\Delta D(AB) - \frac{1}{2} [D(AA) + D(BB)]\]
де D - енергія зв'язку ковалентного зв'язку. Однак виявилося, що не обов'язково позитивний, і Полінг видозмінив визначення
\[\Delta = D(AB) - \sqrt{D(AA) \times D(BB)}\]
і переосмислював його як іонний характер зв'язку A-B. Крім того, електронегативність\(\chi\) була визначена таким чином, що різниця електронегативностей атомів A і B пропорційна квадратному кореню іонного характеру. Тут коефіцієнт
\[| \chi_{A} - \chi_{B}| = 0.208 \sqrt{\Delta}\]
0,208 так визначається, що електронегативність водню Н стає 2,1 при вираженні енергій зв'язку в ккал моль -1. Оскільки електронегативність Паулінга збільшують вищі стану окислення атома, ці значення відповідають найвищому числу окислення кожного елемента. Електронегативності, розраховані з використанням останніх значень енергій зв'язку, наведені в табл\(\PageIndex{6}\).
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Ч 2,2 |
||||||||
| 2 | Лі 0,98 |
Будьте 1,57 |
|||||||
| 3 | На 0,93 |
Мг 1,31 |
|||||||
| 4 | К 0,82 |
Сб 1.00 |
Сб 1.36 |
Тот 1,54 |
V 1,63 |
Кр 1,66 |
Мн 1,55 |
Фт 1,83 |
Ко 1,88 |
| 5 | 0,82 руб |
Ср 0,95 |
У 1,22 |
Зр. 1,33 |
Нб 1.6 |
Пн 2.16 |
Тк 1.9 |
Ру 2.2 |
Rh 2,28 |
| 6 | Куди 0.79 |
Ба 0,89 |
Лантаноїд | Гф 1,3 |
Тан 1.5 |
Вт 2,36 |
Ре 1.9 |
ОС 2.2 |
Ір 2.20 |
| 7 | Пт 0.7 |
Ра 0,9 |
Актиноїди |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|
| Він | ||||||||
| Б 2.04 |
С 2,55 |
N 3.04 |
З 3.44 |
Ф 3,98 |
Ne | |||
| Аль 1.61 |
Сі 1,90 |
П 2.19 |
С 2,58 |
Кл 3.16 |
Ар | |||
пн 1.91 |
Куб 2,0 |
Зн 1,65 |
Газ 1,81 |
Візьміть 2.01 |
Заявки 2,18 |
Див 2.55 |
Бар 2,96 |
Кр 3,0 |
| Пд 2.20 |
Вік 1,93 |
Кд 1.69 |
В 1,78 |
Сн 1.96 |
Сб 2.05 |
Те 2.10 |
Я 2.66 |
Ке 2.6 |
| Пт 2.28 |
Ау 2.54 |
Рт 2,00 |
До 2,04 |
Пб 2,33 | Бі 2.02 |
Ро 2.0 |
В 2,2 |
Rn |
Оллред А.Л. та Е.Г. Рохоу визначив електронегативність як електричне поле Z eff/r 2 на поверхні атома. Вони додали константу для того, щоб зробити електронегативність\(\chi_{AR}\) якомога ближче до значень Паулінга, використовуючи r для радіуса ковалентного зв'язку атомів.
\[\chi_{AR} = 0.74 + 0.36 \frac{Z_{eff}}{r^{2}}\]
Виходить, що елементи з малими ковалентними радіусами і великими ефективними ядерними зарядами мають великі електронегативності (табл.\(\PageIndex{6}\)).
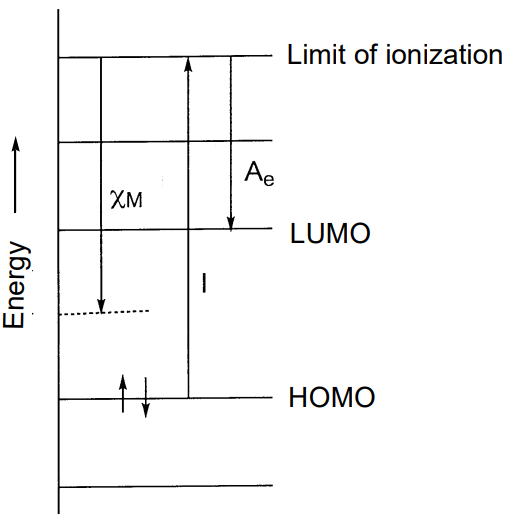
Р.Маллікен визначив електронегативність\(\chi_{M}\) як середнє значення енергії іонізації I і спорідненості електронів A e наступним чином (рис.\(\PageIndex{14}\)).
\[\chi_{M} = \frac{1}{2} (I + A_{e})\]
Оскільки енергія іонізації є енергією електронного збудження від ГОМО і спорідненості електронів енергією приєднання електронів до LUMO (див. Розділ 2.3 (е)), в цьому визначенні електронегативність можна назвати також середнім значенням енергетичних рівнів ГОМО і ЛЮМО. Ті елементи, які важко іонізуються і легко притягуються електрони, мають великі значення. Хоча електронегативність визначається для атомів у валентному стані в молекулі і має розміри енергії, вона розглядається як безрозмірне число (табл.\(\PageIndex{5}\)).
Хоча визначення Маллікена є зрозумілим, оскільки воно безпосередньо пов'язане з атомними орбіталями, як правило, використовуються значення Полінга або Оллреда-Рохоу. Оскільки ці значення мало чим відрізняються, електронегативність Паулінга доречна при виборі тільки однієї. Значення електронегативності змінюються не тільки за визначенням, але і значно впливають на стан зв'язку атомів, і застосовувати їх слід з великою обережністю. Електронегативність складових атомів є основоположними для пояснення відмінностей у зв'язку, структурі та реакціях сполук. Тому хіміки-теоретики продовжують в своїх зусиллах твердо розширити основи цього параметра.
Вправа\(\PageIndex{4}\)
Охарактеризуйте чисельну тенденцію електронегативності елементів у таблиці Менделєєва.
- Відповідь
-
Вони збільшуються вправо і зменшуються вниз по столу. А саме електронегативність лужного металу Cs найменша, а у фтору F - найбільша.
(e) Молекулярні орбіталі
Хвильові функції електронів в атомі називаються атомними орбіталями. Оскільки ймовірність знаходження електронів в молекулярній орбіталі пропорційна квадрату хвильової функції, електронна карта виглядає як хвильова функція. Хвильова функція має області позитивної та негативної амплітуди, які називаються частками. Перекриваються позитивні частки або негативні частки хвильових функцій атомів у молекулі підсилюють один одного, утворюючи зв'язок, але позитивні та негативні частки скасовують один одного, не утворюючи зв'язку. Ступінь цього ефекту інтерференції відповідає величині інтеграла перекриття в квантовій хімії.
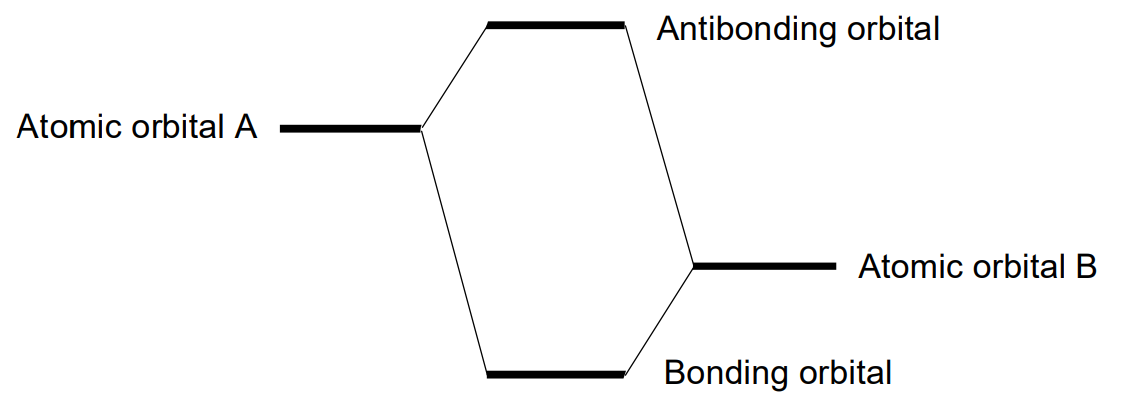
При утворенні молекули атомні орбіталі перекриваються, утворюючи молекулярну орбіталь, яка є хвильовою функцією електронів у молекулі. Кількість молекулярних орбіталів - це сума атомних орбіталів, і ці молекулярні орбіталі класифікуються на склеювальні, незв'язні або антизв'язуючі молекулярні орбіталі за ступенем їх участі у зв'язку між атомами. Умови формування склеювальної молекулярної орбіталі такі.
[Умови формування склеювальних молекулярних орбіталей]
- Частки атомних орбіталей складових атомів підходять для перекриття.
- Позитивний або негативний знак перекриваються часточок однаковий.
- Рівні енергії атомних орбіталей близькі.
Найпростіший випадок, коли молекулярна орбіталь побудована з атомних орбіталів A і B, пояснюється тут. Зв'язка молекулярна орбіталь утворюється між А і В, якщо виконані вищезазначені умови (1), (2) і (3), але якщо знак однієї з атомних орбіталей зворотний, умова (2) не виконується і антизв'язуюча молекулярна орбіталь, в якій ознаки перекриваються частки різні (рис. \(\PageIndex{15}\)) результати. Енергетичний рівень зв'язкової орбіти нижчий, а рівень антизв'язуючої орбіти вище, ніж у складових атомних орбіталів. Чим більша різниця енергій зв'язку і антизв'язуючої орбіти, тим міцніше зв'язок. Коли між А і В немає зв'язку або антизв'язуючої взаємодії, результуюча молекулярна орбіта є незв'язною орбіталлю. Електрони займають молекулярні орбіталі в порядку найнижчого до найвищого енергетичного рівня. Найвища зайнята молекулярна орбіталь називається HOMO, а найнижча незайнята - LUMO. Кен'ічі Фукуї (1981 Нобелівська премія) назвав ці орбіталі прикордонними орбіталями.
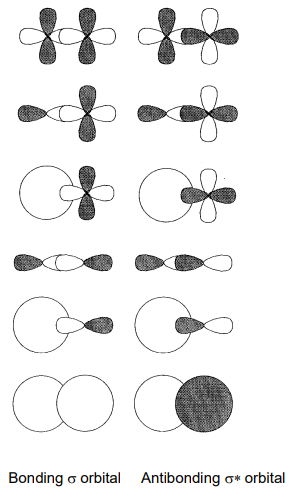
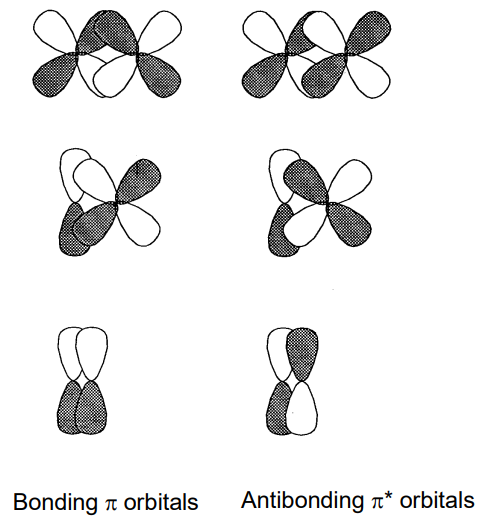
Дві або більше молекулярних орбіталей однакової енергії називаються виродженими орбіталями. Символ невиродженої орбіти є a або b, a подвійно вироджена орбітальна e, і потрійно вироджена орбітальна t Символ g (gerade) прикріплений як суфікс до центросиметричної орбіти і u (ungerade) до орбіти, яка змінює знак під інверсією навколо центру інверсії. Число перед символом симетрії використовується в порядку енергії для розрізнення орбіталей одного і того ж виродження. Крім того, вони називаються орбіталями sigma (\(sigma\)\(\pi\)) або pi () відповідно до орбітального характеру. Орбітальна сигма має симетрію обертання навколо осі зв'язку, а орбітальна пі має вузлову площину. Тому сигма-зв'язки утворюються перекриттям s-s, p-p, s-d, p-d і d-d орбіталей (рис.\(\PageIndex{16}\)) і pi зв'язків перекриттям p-p, p-d і d-d орбіталей (рис.\(\PageIndex{17}\)).
Коли хвильові функції двох атомів встановлені на\(\phi_{A}\) і\(\phi_{B}\), молекулярна орбіталь - це лінійна комбінація атомних орбіталів (LCAO), виражена як
\[\psi = C_{A} \phi_{A} + C_{B} \phi_{B}\]
Тільки атомні орбіталі валентної електронної оболонки використовуються в найпростішому молекулярно-орбітальному методі. Побудова молекулярної орбіти показано нижче для найпростішого випадку двоатомних молекул. Всі рівні нижче HOMO зайняті електронами, а рівні вище LUMO порожні.
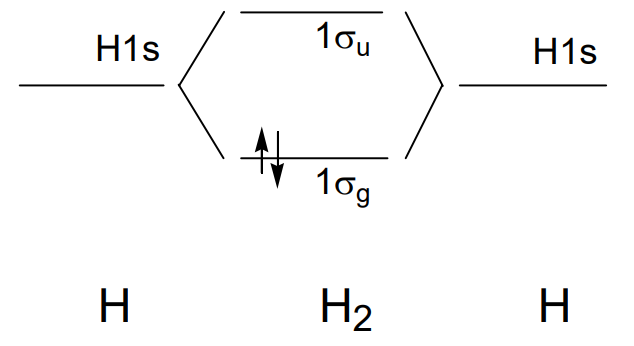
У молекулі водню H 2 перекриття 1-ї орбіти кожного атома водню утворює зв'язкову орбіталь,\(\sigma_{g}\) якщо частки мають знак рівності і антизв'язуючу орбіту,\(\sigma_{u}\) якщо вони мають протилежні ознаки, а два електрони займають зв'язкову орбіту\(\sigma_{g}\) (рис.\(\PageIndex{18}\)).
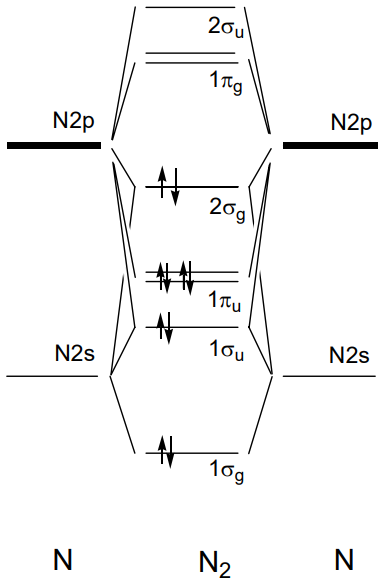
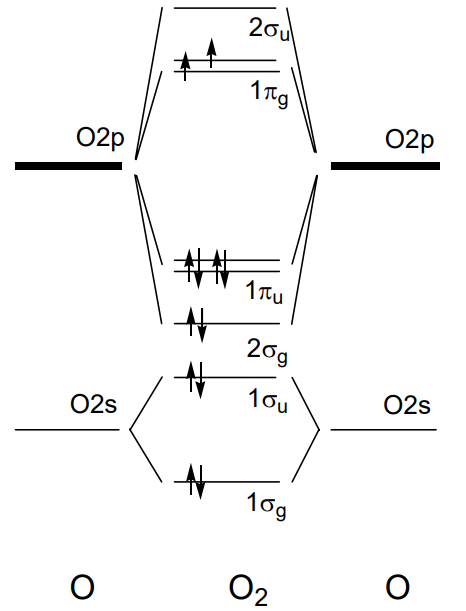
У двоатомних молекулах 2-го періоду від літію Li 2 до фтору F 2, якщо вісь z встановлена як вісь зв'язку, 1\(\sigma_{g}\) і 1\(\sigma_{u}\) утворюються перекриттям 2s орбіталей кожного атома і 2\(\sigma_{g}\) і 2\(\sigma_{u}\) з орбіталей 2p z і 1\(\pi_{u}\) і 1 \(\pi_{g}\)від 2р х, і 2р у. Рівні орбітальної енергії для молекул від Li 2 до N 2 впорядковані як 1\(\sigma_{g}\)\(\sigma_{u}\) < 1\(\pi_{u}\) < 1\(\sigma_{g}\) < 2\(\pi_{g}\) < 1 < 2,\(\sigma_{u}\) а електрони займають рівні послідовно знизу. Приклад молекули N 2 з десятьма валентними електронами наведено на малюнку\(\PageIndex{19}\). Оскільки порядок орбіталей дещо відрізняється у O 2 та F 2, в яких орбіталь 2 потрапляє під\(\sigma_{g}\) орбіталь 1\(\pi_{u}\), молекулярна орбіталь молекули кисню, O 2, проілюстрована на малюнку\(\PageIndex{20}\). 11-й і 12-й електрони серед 12 валентних електронів займають подвійно вироджену\(\sigma_{g}\) орбіталь 1 в основному стані, і вони мають паралельні спини під правилом Гунда і, отже, молекула кисню має два непарних електронів.
Молекулярні орбіталі двох різних атомів утворені перекриттям атомних орбіталей з різним рівнем енергії. Енергетичний рівень орбіти атома з більшою електронегативністю, як правило, нижчий, а молекулярні орбіталі більш характерні для атомної орбіти з більш близьким енергетичним рівнем. Тому зв'язкові орбіталі мають характер атома з більшою електронегативністю, а антизв'язуючі орбіталі атома з меншою електронегативністю.
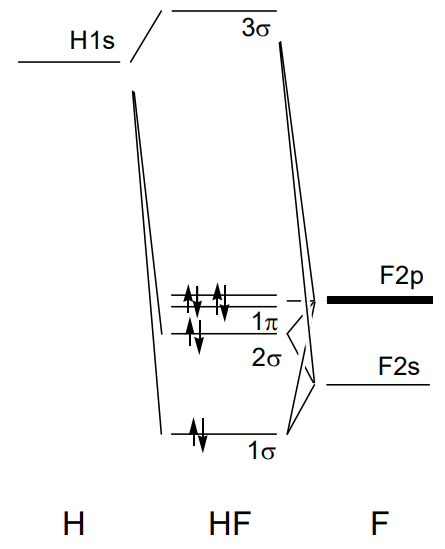
Наприклад, п'ять молекулярних орбіталей у фтористому водні, HF, утворюються з 1-ї орбіталі водню і 2s і 2p орбіталей фтору, як показано на малюнку\(\PageIndex{21}\). Зв'язка 1\(\sigma\) орбітальна має 2s характер фтору, а антизв'язуючий 3\(\sigma\) орбітальний характер 1s водню. Оскільки водень має лише одну орбітальну 1s, перекриття з 2p орбіталлю фтору з\(\pi\) характером не є ефективним, а орбітальна фтор 2p стає незв'язною орбітою. Оскільки HF має вісім валентних електронів, ця незв'язкова орбіталь є HOMO.
У окисі вуглецю СО, вуглець і кисень мають 2s і 2p орбіталі, що призводить як сигма, так і pi зв'язки, і між атомами утворюється потрійний зв'язок. Хоча 8 молекулярних орбіталей в даному випадку якісно такі ж, як у ізолектронної молекули азоту N 2 і 10 електронів займають орбіталь до 3\(\sigma\), рівень енергії кожної орбіти відрізняється від рівня молекули азоту. \(\sigma\)Орбітальна зв'язок 1 має 2s характер кисню через його більшу електронегативність, а зв'язок 1\(\pi\) орбітальний також має 2p характер кисню. Антізв'язуючі 2\(\pi\) і 4\(\sigma\) орбіталі мають 2p характер вуглецю (рис.\(\PageIndex{22}\)).
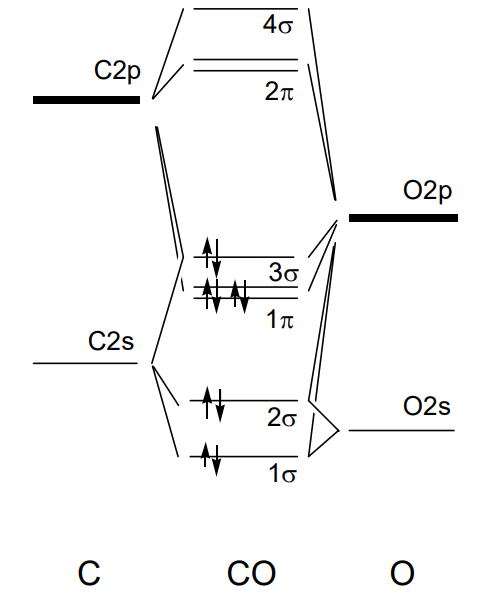
Порядок зв'язку між атомами становить половину від кількості електронів на орбіталах зв'язку мінус орбіталів антизв'язуючих. Наприклад, в N 2 або СО вона дорівнює\(\frac{1}{2}\) (8 - 2) = 3 і відповідає структурі Льюїса.
Вправа\(\PageIndex{5}\)
Чому атомні орбіталі атома кисню на молекулярно-орбітальній діаграмі окису вуглецю, СО, нижчі, ніж у вуглецю?
- Відповідь
-
Це тому, що електронегативність кисню більша, ніж у вуглецю.
проблеми
2.1
Використовуючи рівняння Полінга, обчислити електронегативність хлору з енергій зв'язку молекули водню H 2 (432 кДж моль -1), молекули хлору Cl 2 (239 кДж моль -1) і молекули хлористого водню HCl (428 кДж моль -1) і електронегативність водню (\(\chi\)= 2,1).
2.2
Чому рівні енергії\(\sigma_{g} < \sigma_{u}\) в орбіталі сигматичного характеру і\(\pi_{u} < \pi_{g}\) в пі-характер в молекулярній орбітальній діаграмі N 2 або O 2?
Велика теорія та оцінка
Теорія валентних електронів Льюїса передбачає, що ковалентний зв'язок утворюється з електронною парою і що навколо кожного атома є вісім валентних електронів. Це дуже важливе поняття, за допомогою якого ми розуміємо зв'язки між основними груповими елементами. Однак теорія не дотримувалася достатньо високо, щоб Нобелівська премія була присуджена Льюїсу. Однією з причин цього зневаги, здається, є те, що хіміки в США, батьківщині Льюїса, спочатку ігнорували його теорію, і що лауреат Нобелівської премії Ленгмюр розширив теорію Льюїса, яка пізніше була відома як теорія Льюїса-Ленгмюра. Н.Бор, видатний фізик, який мав великий вплив на відбір Нобелівської премії, більш високо оцінив теорію адсорбції Ленгмюра, що говорить про те, що фізики вважали теорію Льюїса занадто спрощеною.
Існує подібна історія про теорію перехідного стану Е.Айрінга. Фізики та хіміки-теоретики, які любили математичне лікування хімічних явищ, вважали теорію Айрінга занадто нехитрою. З цієї причини найважливіше поняття в хімічній кінетиці не розглядалося на Нобелівську премію. Це епізод в історії хімії, який нагадує нам коментар Р.Гофмана, який зазначив, що прості поняття важливіші, ніж оманливо складні математичні теорії.