2.2: Геометричні фактори, що регулюють склеювання та структуру
- Page ID
- 20392
Два параметри, радіуси та сила притягання електронів атомів або іонів, визначають зв'язок, структуру та реакцію елементарних речовин і сполук. Багато зусиль було присвячено пошуку числових значень цих двох факторів, застосовних до всіх матеріалів. Можна сподіватися, що хімічні властивості відомої сполуки та ще неіснуючого нового матеріалу можна передбачити за допомогою комбінації відповідних числових значень. По-перше, будуть описані геометричні фактори.
| Ч 32 |
||||||||||||||||
| Лі 123 |
Бути 89 |
Б 82 |
С 77 |
N 75 |
З 73 |
Ф 72 |
||||||||||
| Na 154 |
Мг 136 |
Аль 118 |
Сі 111 |
П 106 |
S 102 |
Кл 99 |
||||||||||
| К 203 |
Ка 174 |
Сб 144 |
До 132 |
В 122 |
Автомобіль 118 |
Мн 117 |
Лт 117 |
Ко 116 |
Ni 115 |
Куб 117 |
Зн 125 |
Газ 126 |
Вік 122 |
Як 120 |
Ср. 117 |
Бр 114 |
| Рб 2016 |
ср 191 |
Р 162 |
Зр. 145 |
Нб 134 |
пн 130 |
Тк 127 |
Ру 125 |
Рх 125 |
Пд 128 |
вік 134 |
Кд 148 | У 144 |
Сн 140 |
Сб 140 |
Те 136 |
Я 133 |
| CS 235 |
Бар 198 |
Ла 169 |
Гф 144 |
Податок 134 |
Вт 130 |
Ре 128 |
Ос 126 |
Ір 127 |
Пт 130 |
Ау 134 |
Рт 149 |
До 148 |
Пб 147 |
Бі 146 |
Атомні та іонні радіуси
Електронна щільність в атомах поступово наближається, але ніколи не досягає нуля в міру збільшення відстані від ядра. Тому, строго кажучи, радіус атома або іона невизначений. Однак визначити відстань зв'язку між атомними ядрами можна експериментальним шляхом. Атомні радіуси, визначені експериментальним шляхом, є одним з найважливіших атомних параметрів, що описують структурну хімію сполук. Радіус металу об'ємного металу розумно визначити як половину відстані між атомами металу. Половина відстані між атомами визначається також як ковалентний радіус ковалентного елементарної речовини (табл.\(\PageIndex{1}\)).
| Лі + (4) 59 | Бути 2 + (4) 27 | Б 3+ (4) 11 | Н 3+ (6) 16 | О 2- (6) 140 | Ф - (6) 133 |
| На + (6) 102 | Мг 2 + (6) 72 | Всі 3 + (6) 54 | П 3+ (6) 44 | С 2- (6) 184 | Кл - (6) 181 |
| К+ (6) 138 | Ка 2 + (6) 100 | Газ 3 + (6) 62 | Як 3 + (6) 58 | Сен 2 - (6) 1998 | Бар - (6) 196 |
| Рб + (6) 152 | Ср 2 + (6) 118 | В 3 + (6) 80 | 2- (6) 2021 | Я - (6) 220 | |
| Кс+ (6) 167 | Бар 2 + (6) 135 | До 3 + (6) 89 |
*Цифри в дужках — координаційний номер іонів.
Оскільки катіони та аніони різних елементів в іонній сполуці пов'язані електростатичними взаємодіями, відстань зв'язку - це сума іонних радіусів, призначених катіону та аніону. Стандартний іонний радіус одного виду фіксується спочатку, а потім віднімається від відстані між іонами, щоб вирішити радіус іонного партнера. Як стандарт, радіус O 2- іона в ряді оксидів встановлюється 140 пм (1 пм = 10 -12 м) (Р.Д. Шеннон). Катіонні радіуси в оксидах - це різниця між дальністю зв'язку і 140 пм. Після визначення радіусів катіонів в оксидах можна обчислити інші радіуси аніонів шляхом віднімання радіусів катіонів від відстаней між атомами в іонних сполуках. Застосовуючи такі методи до багатьох іонних сполук, іонні радіуси були складені таким чином, що експериментальні та розрахункові значення в цілому узгоджуються (табл.\(\PageIndex{2}\)).
Навіть іонні сполуки мають певний ковалентний внесок, і не очікується, що розрахункові та експериментальні відстані зв'язку будуть точно узгоджені. Навіть якщо іонний радіус, призначений стандартному іону, змінюється, ми все одно можемо скласти набір іонних радіусів, які узгоджуються у багатьох сполуках. Інші приклади запропонованих радіусів O 2- іона - 132pm (V.M. Goldschmidt) або 60 вечора (J. C. Slater). Ми також повинні пам'ятати, що катион-аніонні відстані однієї і тієї ж іонної пари стають більшими зі збільшенням координаційного числа протилежних іонів. Тому при будь-якому обговоренні структурних особливостей іонних сполук з точки зору іонних радіусів слід використовувати набір іонних радіусів, розрахованих з використанням того ж стандартного радіуса для сполук з однаковим координаційним числом.
Вправа\(\PageIndex{2}\)
Який іонний радіус більше, Cs + або F -?
- Відповідь
-
Сс + (167 вечора) > Ф - (133 вечора). Радіус аніонів не завжди більший.
Металеві та ковалентні радіуси, також звані атомними радіусами, стають меншими в той же період періодичної таблиці, коли група елемента йде вправо, а потім знову збільшуються в наступному періоді. Скорочення лантанідів відповідає за елементи 5-го періоду (4d), що мають майже ті ж атомні радіуси, що і 6-го періоду (5d). У таблиці Менделєєва лантаноїдні елементи вставляються перед елементами 5d. Атомні радіуси лантаноїдних елементів помітно зменшуються зі збільшенням ефективного ядерного заряду, оскільки екрануючі ефекти 4f орбіталів лантанідних елементів слабкі через їх орбітальні форми. Отже, атомні радіуси елементів, наступних за лантаноїдами, дуже схожі на радіуси 4d елементів.
ентальпія решітки
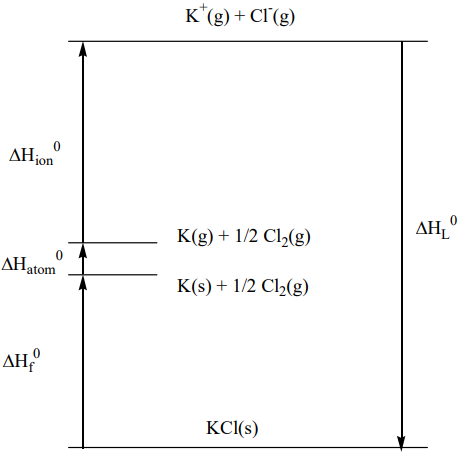
Хоча стабільність кристала при постійній температурі і тиску залежить від зміни вільної енергії Гіббса утворення кристала від входять до його складу іонів, стабільність кристала визначається здебільшого лише зміною ентальпії, оскільки формування решітки дуже екзотермічне, а термін ентропії мізерно мала (див. Розділ 3.1). Ентальпія решітки\(\Delta H_L\), визначається як стандартна зміна ентальпії реакції, в якій іонний кристал розкладається на газоподібні іони (s твердий, g - газ і L - решітка).
\[MX(s) \rightarrow M^{+} (g) + X^{-} (g) \qquad \Delta H_{L}\]
Ентальпія решітки побічно обчислюється за значеннями зміни ентальпії на кожному етапі за допомогою циклу Борна-Хабера (рис.\(\PageIndex{1}\)). А саме, за даними ентальпії формується замкнутий цикл; стандартна ентальпія утворення\(\Delta H_f\) іонного кристала з елементів, сублімаційна ентальпія елементарного твердого тіла або атомізаційна ентальпія\(\Delta\Hatom corresponding to the dissociation enthalpy of a gaseous elementary molecule, the ionization enthalpy \(\Delta\) η іона, яка є сумою іонізаційної ентальпії катіоноутворення і електрона придбання ентальпії утворення аніонів. Ентальпія решітки обчислюється за допомогою співвідношення, що зміна ентальпії в циклі дорівнює нулю.
\[\Delta H_{atom}^{0} + \Delta_{ion}^{0} - \Delta H_{L}^{0} - \Delta H_{f}^{0} = 0\]
Постійна Маделунг
Загальна кулонова потенційна енергія, яка існує між іонами в іонному кристалі, що складається з іонів A і B, повинна бути сумою окремих кулонівських потенційних енергій V ab. Так як місця розташування іонів в кристалічній решітці визначаються типом структури, загальний кулонівський потенціал між усіма іонами обчислюється шляхом встановлення відстані між іонами в d А - постійна Маделунга, характерна для кожного типу кристалів (табл.\(\PageIndex{3}\)) .
\[V = N_{A} \frac{e^{2}}{4 \pi \epsilon_{0}} \left(\dfrac{z_{A} z_{B}}{d} \right) \times A\]
N A - постійна Авогадро, а z A і z B - електричні заряди катіону та аніону. Електростатична взаємодія між суміжними іонами є найсильнішою, і постійна Маделунга, як правило, стає більшою зі збільшенням координаційного числа. Оскільки електричні заряди мають протилежні ознаки, потенціал стає негативним, що свідчить про стабілізацію, яка супроводжує утворення кристалічної решітки з добре дисперсних, газоподібних фазових іонів. Хоча, як правило, вірно, що найнижчий електростатичний потенціал призводить до найбільш стабільної структури, це не є строго правильним, оскільки існують також інші взаємодії, які слід враховувати.
| Структурний тип | A |
|---|---|
| Кам'яна сіль | 1.748 |
| Хлорид цезію | 1.763 |
| Сфалерит | 1,638 |
| Вурцит | 1.641 |
| Флюорит | 2.519 |
| Рутил | 2.408 |
Другим за величиною фактором, що сприяє ентальпії решітки, є сила ван дер Ваальса, а сили розсіювання або лондонська взаємодія є основним походженням цієї сили. Це приваблива взаємодія між електричними диполями, яке обернено пропорційно 6-й потужності відстані d між іонами. Сила ван дер Ваальса дуже мала.
\[V = - \frac{N_{A} C}{d^{6}}\]
Значення константи C є функцією кожної сполуки. Оскільки вона становить не більше 1% від кулонівського сили, нею можна сміливо знехтувати при розрахунку ентальпії решітки.
(d) Структура металевих кристалів
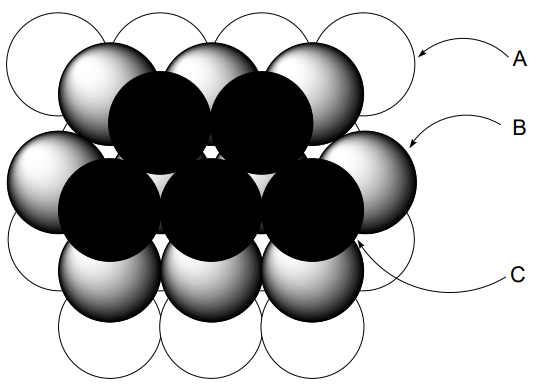
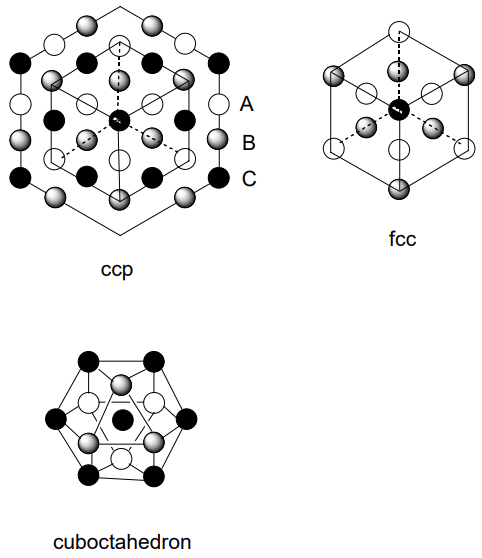
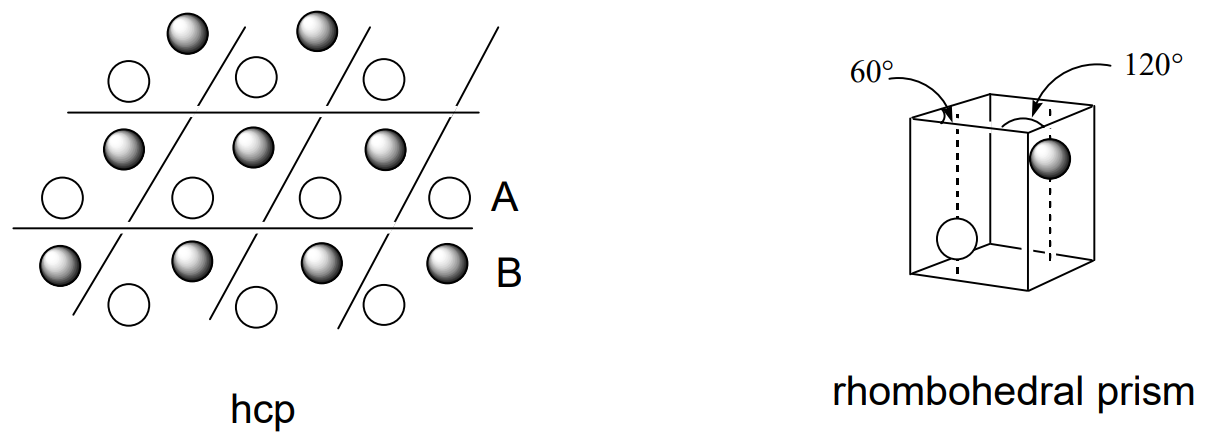
Якщо ми уявляємо атоми металів твердими кульками, коли щільно упаковані в двох вимірах кожна куля буде контактувати з шістьма іншими кульками (A). Коли інший шар цього 2-мірного розташування розміщується поверх першого, упаковка буде найщільнішою і структурою найбільш енергетично стабільною, коли атоми металу розміщуються поверх западин (B) першого шару. Коли 3-й шар розміщується поверх 2-го шару, є дві можливості. А саме, 3-й шар (А) перекривається 1-м шаром (А) або 3-м шаром (С) не перекривається ні (А), ні (В). ABAB... -тип упаковки називається шестигранно близько упаковані (hcp) (рис.\(\PageIndex{2}\)), а ABCABC... -тип називається кубічним тісно упакованим (ccp) (рис.\(\PageIndex{3}\)). В обох випадках кожен м'яч оточений 12 кульками, тобто він 12-координований. Координаційний багатогранник hcp - антикубоктаедр,
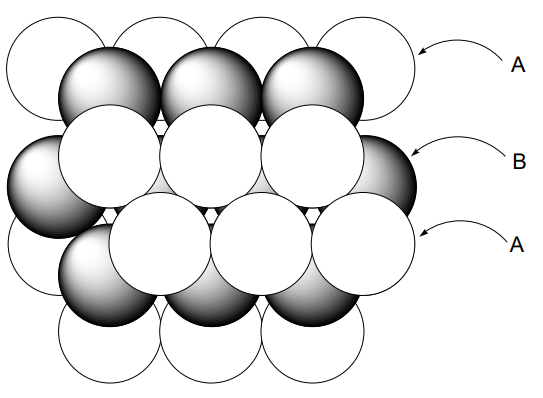
а ccp - кубооктаедр. Коли решітка нарізана в різних площинях, одинична решітка ccp представляється як гранецентрированная кубічна решітка (fcc), що містить кульку на кожній кубічній вершині і в центрі кожної грані (рис.\(\PageIndex{4}\)). Одинична решітка hcp являє собою ромбоедричну призму, в якій дві кульки розташовані в положеннях, показаних на (рис.\(\PageIndex{5}\)). Існує кілька різних режимів накопичення шарів, крім звичайних hcp і ccp, і відомо багато прикладів.
Решітка з іншим кулею в центрі кубічної решітки, що складається з восьми куль, є центром тіла кубічної решітки (ОЦК), а деякі метали припускають такий режим упаковки. Коефіцієнт зайнятості простору в решітці ОЦК менше, ніж у тісно упакованих, але різниця невелика. Хоча центральний куля формально 8-координований, він, по суті, 14-координований, оскільки є ще шість куль лише на 15.5% віддаленіший, ніж перші вісім куль. Однак через менший коефіцієнт зайнятості простору, ОЦК з'являється відносно рідко, а чисті метали, як правило, приймають hcp або ccp.
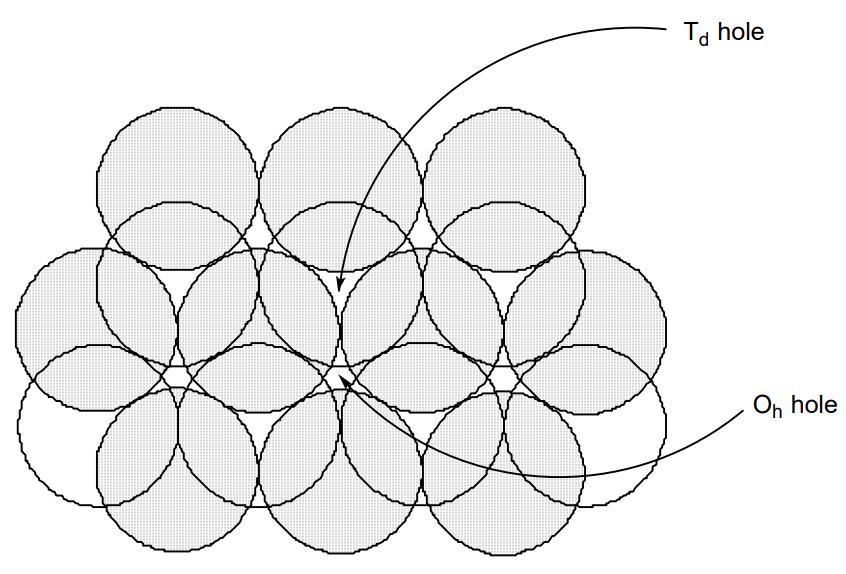
Як в hcp, так і в ccp порожнинами серед кульок є або O h отвори, укладені октаедрально шістьма кульками, або T d отвори, укладені чотиригранно чотирма кульками (рис.\(\PageIndex{6}\)). (O h і T d - символи симетрії, що використовуються в теорії груп.) У іонних твердих тілах, якщо аніони знаходяться в механізмах hcp або ccp, катіони потрапляють в будь-яку з цих порожнин.
Іонний кристал
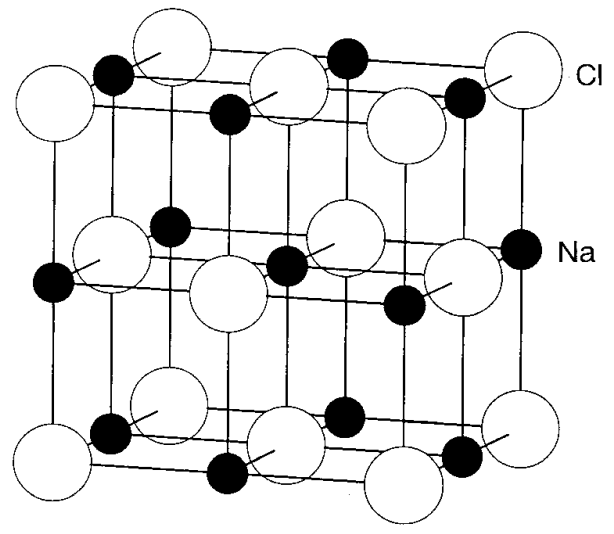
У іонних кристалах, таких як галогеніди металів, оксиди та сульфіди, катіони металів та аніони вирівнюються поперемінно, а тверда речовина пов'язана між собою головним чином електростатичним зв'язком. Багато галогенідів металів розчиняються в полярних розчинниках, наприклад, хлорид натрію NaCl розчиняється у воді; тоді як оксиди металів та сульфіди, в яких є значний внесок ковалентного зв'язку, зазвичай нерозчинні навіть у самих полярних розчинниках. Фундаментальна будова іонних кристалів полягає в тому, що більші іони (зазвичай аніони) щільно упаковані і менші іони (зазвичай катіони) потрапляють в октаедричні або чотиригранні порожнини між ними. Іонні кристали класифікуються на кілька типових структур відповідно до видів катіонів та аніонів, що беруть участь, та їх іонних радіусів. Кожен тип структури називається назвою типового з'єднання, так само, як структура кам'яної солі, що представляє структури не тільки NaCl (кам'яної солі), але і різних інших сполук. Представницька структура типів твердих сполук і приклади, що належать до кожного типу, наведені в табл\(\PageIndex{4}\).
| Тип кристала | Номер координації | приклади з'єднань |
|---|---|---|
| Кам'яна сіль | (6,6) | ЛКЛ, NaCl, кБр, Бри, ГКЛ, Мго, НіО, НіП |
| Хлорид цезію | (8,8) | ЦСЛ, ЦСБ, ЦСі, КузН |
| Сфалерит | (4,4) | ZnS, компакт-диски, ГГС, CuCl, GAP |
| Флюорит | (8,4) | СаФ 2, СРФ 2, СФ 2, ЗрО 2, УО 2 |
| Рутил | (6,3) | То 2, № 2, Уро 2, НіФ 2 |
| йодид кадмію | (6,3) | CdI 2, СОІ 2, Мг (ОН) 2 |
| Оксид ренію | (6,2) | Еро 3, ВО 3, Сб (ОН) 3 |
| Перовскіт | (6,2) | Атіо 3, Атіо 3, СтІО 3 |
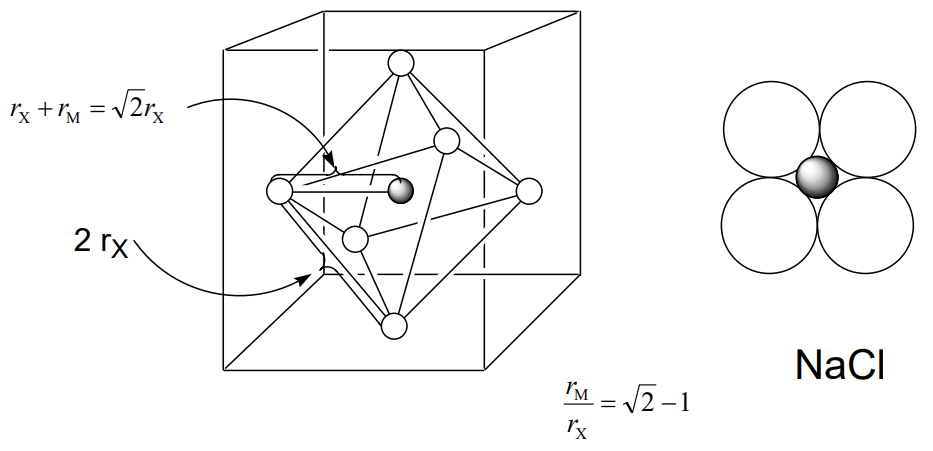
Кам'яно-сольова структура Хлорид натрію NaCl є типовим з'єднанням, в якому Cl- аніони розташовані в ccp, а катіони Na+ займають всі октаедричні отвори (Oh отвори) (рис.\(\PageIndex{7}\)). Кожен катіон Na+ оточений шістьма Cl- аніонами. Така ж структура призводить навіть в тому випадку, якщо положення аніонів і катіонів обмінюються. У разі зворотної структури кожен Cl- аніон оточений шістьма катіонами Na+. А саме, кожен іон 6-узгоджений і зручно описувати структуру як (6,6) -структуру. Кількість іонів в одиничній решітці розраховується шляхом підсумовування іонів, показаних на малюнку\(\PageIndex{7}\). Так як всередині решітки один іон, то іони на гранях решітки діляться на 2, на ребрах - на 4, а на кутах на 8 решіток - сітка з 4 іонів Cl, що належать до одиничної решітці NaCl, виходить множенням чисел іонів всередині решітки на 1, на гранях на 1/2, на ребрах на 1/4 і на кутах на 1/8. Кількість іонів Na в одиничній решітці також дорівнює 4 і співвідношення іонів Cl і Na узгоджується з формулою NaCl.
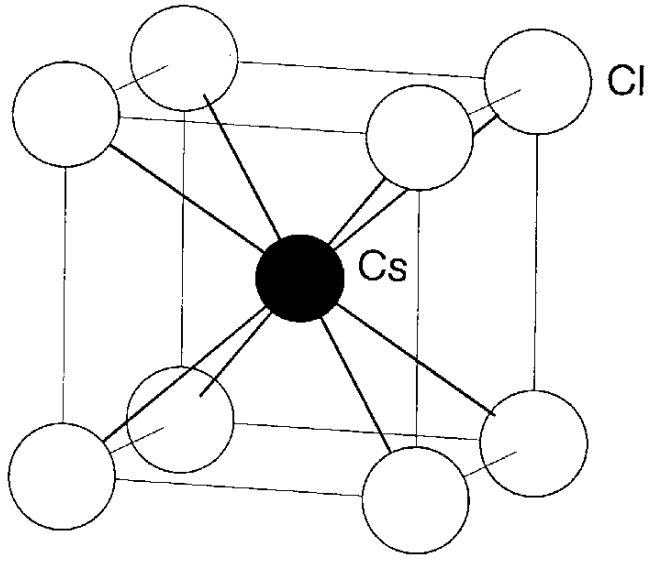
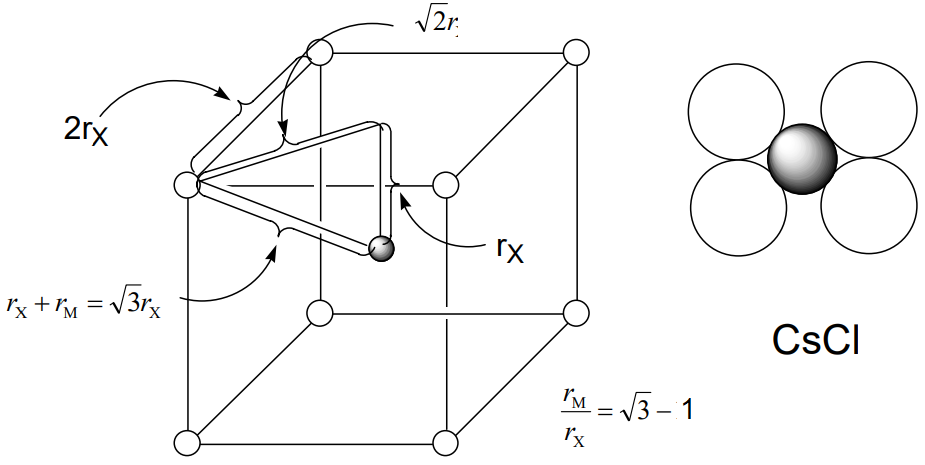
Структура хлориду цезію хлорид цезію, CScl, є типовим прикладом структури, показаної на малюнку\(\PageIndex{8}\). У центрі знаходиться іон Cs +, а вісім Cl - розташовані у восьми кутах куба. І навпаки, навіть якщо Cl - доходить до центру і вісім Cs + доходять до кутів, кількість кожного іона в одиничній решітці однакове. Таким чином, це іменується як (8, 8) -структура. Так як до цієї одиничної решітці належить один Cs + і один Cl - іон, він збігається з формулою CsCl.
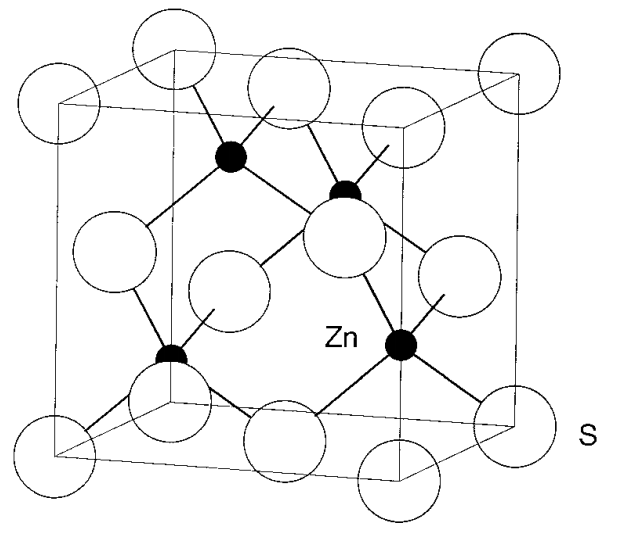
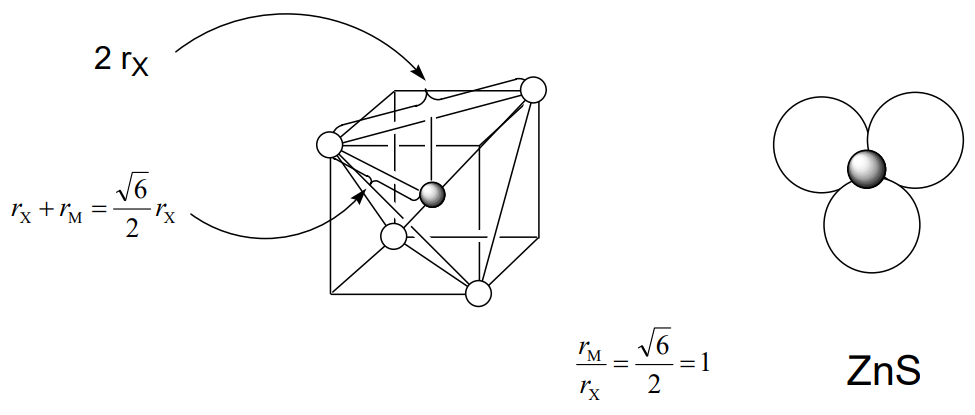
Структура суміші цинку Цинкова суміш має склад ZnS і її одинична решітка показана на малюнку\(\PageIndex{9}\). S 2- аніони розташовані в ccp, а катіони Zn 2 + займають половину чотиригранних отворів (Td отворів). У такому розташуванні кожен катіон узгоджується чотирма аніонами, а кожен аніон - чотирма катіонами. Значить, це (4, 4) -структура. Є як чотири іона Zn 2 +, так і S 2-, що належать цій одиничній решітці і атомне співвідношення збігається з формулою ZnS.
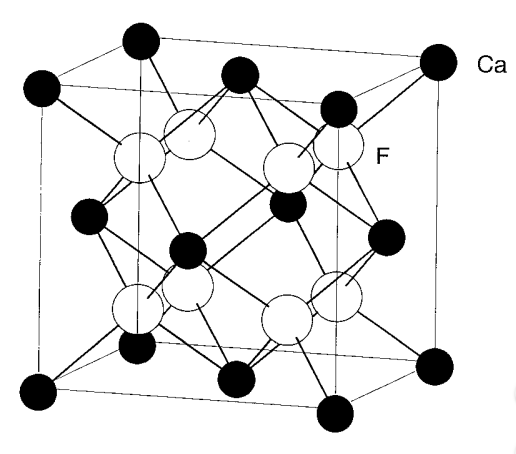
Структура флюориту Склад флюориту - CaF 2. Оскільки число F - вдвічі більше, ніж Ca 2+, всі чотиригранні отвори Са 2+, розташовані в ccp, займають F -, як показано на малюнку\(\PageIndex{10}\). Існує чотири Ca 2+ і вісім F - іонів і кількість іонів в 4 рази перевищує формулу. Структура проти флюориту обмінюється катіонами та аніонами, і на прикладі оксиду калію K 2 O тощо.
Вправа\(\PageIndex{3}\)
Скільки катіонів і аніонів є в одиничній решітці структури цинкової суміші?
- Відповідь
-
Всі чотири катіони включені в одиницю решітки. Аніони займають 8 кутів і 6 граней і число 8 х 1/8 + 6 х 1/2 = 4.
Коефіцієнт радіусу
Як правило, загальна куломбічна потенційна енергія E c одновалентного іонного з'єднання MX виражається наступною формулою.
\[E_{c} = - \frac{N_{A} e^{2}}{4 \pi \epsilon_{0} R} A\]
N A - постійна Авогадро, A - постійна Маделунга і R відстань між іонами. За цією формулою більш стійкою є структура з більшим співвідношенням A/R. Константа Маделунга сполуки MX збільшується зі збільшенням координаційного числа. З іншого боку, вигідно знизити число координації та зменшити R у випадку малих M, роблячи контакт між M та X складнішим. У іонному кристалі співвідношення r M і r X з аніонами, що контактують один з одним, а також з катіонами залежить від координаційного числа.
У частковій структурі, що складається тільки з аніонів, аніони утворюють координаційний багатогранник навколо катіона. Аніонний радіус Rx дорівнює половині відстані краю багатогранника, а відстань від центру катіону до вершини багатогранника - сума радіусів аніона і катіону r X + r M. Координаційний багатогранник структури CScL - куб, структура NaCl - октаедр, а ZnS - тетраедр. Відстань від центру кожного багатогранника до вершини дорівнює\(\sqrt{3} r_{X}\)\(\sqrt{2} r_{X}\),\ frac {\ sqrt {6}} {2} r_ {X}\). Отже, співвідношення катіонного та аніонного радіусів r M/r X становлять $$\ frac {\ sqrt {3} r_ {X}} {r_ {X}} =\ sqrt {3} −1 = 0.732$$для CScL, $$\ frac {\ sqrt {2} r_ {X} − r_ {X} − r_ {X}} {r_ {X}} =\ sqrt {2} −1 = 0.414$$ для NaCl та $\ frac {\ frac {\ sqrt {6}} {2} r_ {X}} - r_ {X}} {r_ {x}} =\ frac {\ sqrt {6}} {2} - 1 = 0,225$$ для структур ZnS (рис.\(\PageIndex{11}\)).
Пояснено, що координаційне число зменшується, коли ці радіусні співвідношення менші за задані значення, оскільки катіони та аніони не контактують один з одним, що спричиняє нестабільність. З іншого боку, координаційне число збільшується для більших катіонів, збільшуючи коефіцієнт радіуса. Однак зв'язок між координаційним числом та коефіцієнтом радіуса не є простим. Наприклад, галогеніди лужних металів приймають структури NaCl при нормальних температурах, крім хлориду цезію CScL, броміду цезію CsBr і йодиду цезію CSi. Неможливо припустити типи структури з радіусних співвідношень навіть у випадку простих іонних сполук, таких як галогеніди лужних металів. Однак якісна тенденція того, що менші катіони мають менші координаційні числа, як правило, правильна.
Варіація вираження твердої структури
Багато твердотільні неорганічні сполуки мають складні тривимірні структури. Різні структурні ілюстрації для одного і того ж з'єднання допомагають нам зрозуміти його структуру. У разі складних неорганічних сполук, проведення ліній зв'язку між атомами, як і в більшості органічних сполук, викликає плутанину. Аніони у багатьох оксидах металів, сульфідах або галогенідах утворюють тетраедру або октаедру навколо центральних катіонів металів. Хоча між аніонами немає зв'язку, структури значно спрощуються, якщо їх ілюструють аніонні багатогранники, що поділяють вершини, ребра або грані. У таких ілюстраціях зазвичай опущені атоми катіонних металів. Як уже згадувалося, іонні тверді структури можна розглядати як тісно упаковані масиви аніонів.
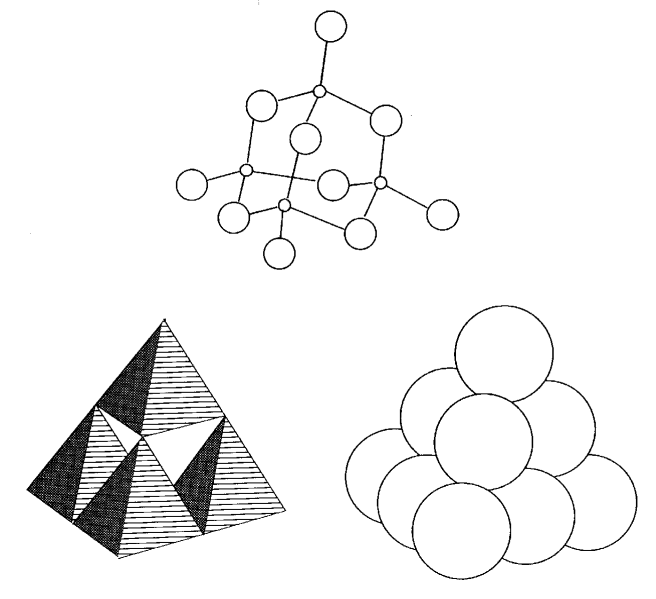
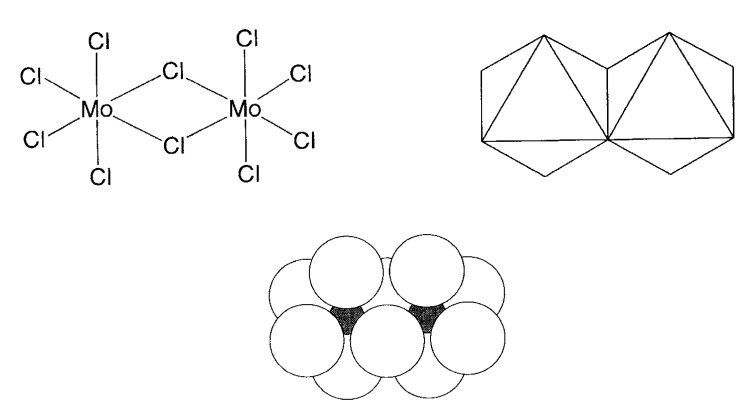
Малюнки 2.12 і 2.13 ілюструють ці три уявлення для молекулярного пентоксиду фосфору P 2 O 5 (= P 4 O 10) і пентахлориду молібдену MoCl 5 (= Mo 2 Cl 10). Багатогранні уявлення набагато легше зрозуміти для структур великих молекул або твердотільних сполук, утворених нескінченною кількістю атомів. Однак представлення лінії зв'язку підходить для молекулярних сполук, таких як наведені вище приклади.