10.2: Переходи метал-ізолятор
- Page ID
- 19792
У розділі 6 ми дізналися, що метали та ізолятори не тільки мають різні електричні властивості, але і мають дуже різну кристалічну структуру. Метали, як правило, мають високі координаційні числа (як правило, 8 або 12), тоді як ізолятори мають низькі координаційні номери, які можуть бути раціоналізовані як «октет» зв'язування. Наприклад, в кристалічних Si або Ge (структура алмазу) кожен атом має чотирьох найближчих сусідів. На зв'язок є два електрони, і, таким чином, кожен атом має вісім електронів у своїй валентній оболонці. Sn, елемент нижче Ge, існує у двох різних формах: одна (сіре олово) з алмазною структурою, яка є крихким напівпровідником з вузькою щілиною, а інша (біле олово) з тетрагональною структурою, що є ковким металом. Ці дві форми дуже близькі за енергією, і насправді металеве біле олово перетворюється в крихку напівпровідникову сіру форму при низькій температурі. Надзвичайно холодна погода в Європі 18 століття призвела до того, що багато труб олов'яних органів зламалися і врешті-решт перетворилися на пил Ця трансформація отримала назву фітофтороз олова, хвороба олова, шкідник олова або олов'яна проказа. Пил насправді сірий олово, якому не вистачає ковкості його металевого двоюрідного брата білого олова.
При експериментально доступних температурах і тисках Si і Ge завжди напівпровідникові (тобто ізолюючі), а Pb завжди металевий. Чому Sn відрізняється? Причина пов'язана з орбітальним перекриттям. Теорія говорить нам насправді, що будь-які (і всі) ізолятори повинні ставати металевими при досить високому тиску, або більше до точки, при досить високій щільності. Однак для більшості ізоляторів необхідний тиск набагато перевищує ті, яких ми можемо досягти в лабораторії.

Як можна раціоналізувати перехід ізоляторів в металевий стан? Дійсно, як взагалі зрозуміти існування ізоляторів?
Модель Хаббарда
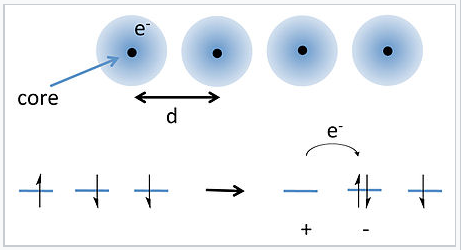
Розглянемо ланцюжок з великої кількості (N) атомів, як ми це робили в главі 6. Для зручності можна сказати, що це такі атоми, як H, Na або Cs, які мають один валентний електрон. Проста смугова модель, яку ми розробили раніше, передбачає, що ланцюг повинен бути металевим, оскільки атоми N об'єднуються, утворюючи N орбіталів, а N валентні електрони заповнюють смугу орбіталів лише на півдорозі. Але цей висновок не залежить від щільності, яка створює парадокс. Якщо атоми в ланцюжку знаходяться дуже далеко один від одного, ми підозрюємо, що електрони повинні локалізуватися на атомах.
|
Перескакування електронів в 1-D ланцюжку атомів. |
Рішення цієї проблеми було запропоновано Дж. Хаббардом в 1963 році. [1] Хаббард розглянув енергію, необхідну для перенесення електрона від атома до найближчого сусіда, як показано на малюнку праворуч. Оскільки кожен атом вже має один електрон (з випадковим спіном), переміщення електрона на один атом вимагає подолання енергії відштовхування електрон-електронів для створення пари катион-аніон. Для добре відокремлених атомів ця енергія (U) задається:
\[U = IP -Ea -\frac{e^{2}}{4\pi \varepsilon_{0} d}\]
де IP і EA - енергія іонізації та спорідненість електронів, ε 0 - діелектрична проникність вільного простору, а останній член рівняння представляє куломбічне тяжіння між катіоном і аніоном. Для атомів, таких як лужні метали, U знаходиться на порядку 3—5 еВ, що набагато більше теплової енергії kT. Таким чином, ми очікуємо, що буде дуже мало аніон-катіонних пар при кімнатній температурі, і ланцюг атомів повинен бути ізолюючим.
|
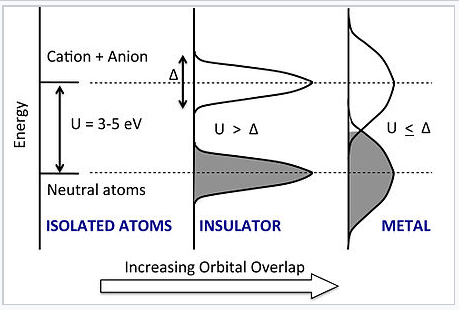
Енергія проти DOS для ланцюга атомів у міру збільшення щільності та ступеня орбітального перекриття між атомами. Зростаюче перекриття розширює нейтральний атом і аніон-катіонні стани на смуги, кожна з яких має смугу пропускання Δ. Перехід в металевий стан відбувається різко, коли Δ перевищує проміжок Хаббарда U. |
Що відбувається, коли ми стискаємо атоми разом? У моделі Хаббарда зі зменшенням відстані між атомами енергії як станів нейтральних атомів, так і аніон-катіонних станів розширюються на смуги, кожна з яких має ширину смуги Δ. Нижня смуга може вмістити точно N електронів (не 2N, як на зображенні MO, яку ми розробили раніше), оскільки кожна орбіталь може приймати лише один електрон без спін-пари. Таким чином, для малого Δ нижня смуга заповнена, а верхня смуга порожня. Однак, коли ми продовжуємо стискати ланцюг, орбітальне перекриття стає настільки сильним, що Δ ≈ U. в цей момент смуги перекриваються і деякі електрони заповнюють аніонно-катіонні стани. Потім ланцюг стає провідною, а матеріал металевим.
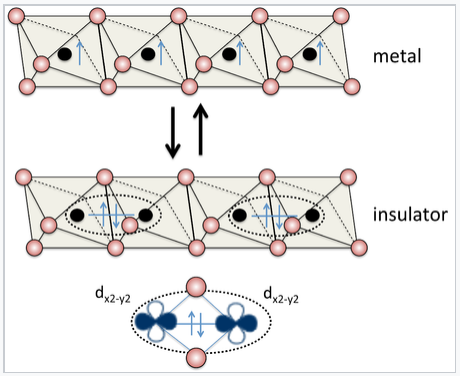
Деякі матеріали, такі як Sn та VO 2, мають лише правильний ступінь орбітального перекриття, щоб перехід Хаббарда відбувався шляхом зміни температури або тиску. Такі матеріали можуть бути дуже корисні для електричних комутацій, як показано праворуч для рутилової структури ВО 2. Більшість матеріалів знаходяться далеко від переходу, або на металевій, або ізолюючої стороні. Цікаву періодичну тенденцію, яка ілюструє це поняття, можна побачити серед монооксидів перехідних металів MO (M = Ti, V, Cr, Mn, Fe, Co, Ni), всі з яких мають структуру NaCl. TiO і VO є металевими, тому що 3d орбіталі мають значне перекриття в структурі. Однак CrO, MnO, FeO, CoO та NiO є ізоляторами, оскільки 3d орбіталі стискаються (і, отже, Δ < U), що переходять через серію перехідних металів. На відміну від цього, аналогічні сульфіди (TiS, VS,... NiS) всі металеві. Сульфіди мають структуру NiAs, в якій всі атоми металів затемнені вздовж осі штабелювання (шестикутна вісь С). Короткі відстані метал-метал уздовж цієї осі призводять до сильного орбітального перекриття, що робить Δ > U.
|
Діоксид ванадію має рутилову структуру, а в неспотвореному вигляді він металевий, з одним валентним електроном на V атом. Спотворення решітки робить пари атомів V, в результаті чого виходить електронно-ізолюючий стан. Перехід метал-ізолятор може управлятися оборотно, змінюючи температуру, тиск або заповнюваність орбіти. Вивчається електрична комутація цього переходу в ВО 2 для застосування в високопродуктивних тонкоплівкових транзисторах [2] |
Модель Мотта
Простіша, менш атомістична модель переходу метал-ізолятор була сформульована Невіллом Моттом. [3] Модель Мотта розглядає поведінку електрона в матеріалі як функцію щільності всіх інших валентних електронів. Ми знаємо, що для одноелектронного воднеподібного атома (H, Na, Cs тощо) рівняння Шредінгера містить потенційний енергетичний термін:
\[V(r) = -(\frac{e^{2}}{4 \pi \varepsilon_{0} r})\]
Ця потенційна енергетична функція породжує звичну сходи дозволених рівнів енергії в атомі водню. Однак у металі цей кулонівський потенціал повинен бути модифікований, щоб включити екранування ядерного заряду іншими електронами в твердому тілі. У цьому випадку існує екранований кулонівський потенціал:
\[V(r) = -(\frac{e^{2}}{4 \pi \varepsilon_{0}r}) exp(-qr)\]
де q, що є оберненою довжині екранування, задається:
\[ q^{2} = 4m_{e}^{2}(\frac{3n}{\pi})^{\frac{1}{3}}(\frac{2\pi}{h})\]
Тут n - щільність атомів (або валентних електронів), m e - маса електронів, а h - константа Планка. На відстанях, значно більших за довжину скринінгу q -1, електрон вже не «відчуває» заряд на ядрі. Мотт показав, що існує критична щільність електронів n c, вище якої валентні електрони більше не пов'язані окремими ядрами і вільні бродити по кристалу. Ця критична щільність знаменує перехід в металевий стан, і задається критерієм Мотта:
\[\mathbf{n_{c}^{\frac{1}{3}}a_{H} \approx 0.26}\]
У цьому рівнянні H є ефективним радіусом Бора для валентних електронів у межі низької щільності, наприклад, середній орбітальний радіус електронів у оболонці 6s атома Cs при обчисленні значення для металу Cs.
|
Розчини металу літію в рідкому аміаку при низькій (верхній, іонний провідник) і вище (знизу, метал) концентрації Li. З відео Джошуа Джудкінса |
Важливою концепцією з моделі Мотта є те, що перехід метал-ізолятор дуже сильно залежить від щільності валентних електронів. Це узгоджується з орбітальною моделлю перекриття Хаббарда, але і більш загальним в тому сенсі, що вона не залежить від періодичної структури атомів. Таким чином, модель Мотта застосовується до таких різноманітних систем, як атоми металів, розчинені в рідкому аміаку, атоми металів, що потрапили в матриці заморожених газів, і легуючі речовини в напівпровідниках. [4] У деяких системах можна безперервно налаштовувати щільність валентних електронів з досить вражаючими результатами. Наприклад, при розчиненні лужного металу (Li, Na,...) в рідкому аміаку (bp -33 o C) утворюється синя рідина. Розчинені катіони лугу та негативно заряджені електрони надають іонну провідність (як у сольовому розчині), але не електронну провідність синьому рідкому аміаку. Але зі збільшенням концентрації електронів утворюється світловідбиваюча рідка фаза бронзового кольору, яка плаває над синьою фазою. Ця бронзова фаза металева і високопровідна. Зрештою, при додаванні достатньої кількості лужного металу вся рідина перетворюється в електронно-провідну бронзову фазу.
Електричне перемикання ВО 2 між ізолюючими і металевими фазами (див. Вище) також може бути раціоналізовано з точки зору переходу Мотта. Додавання більшої щільності електронів (шляхом легування хімічним або електричним полем) збільшує концентрацію валентних електронів, рухаючи фазовий перехід в металевий стан.
Термодинаміка і фазові переходи
Термодинамічно перехід метал-ізолятор є фазовим переходом першого порядку. При такому переході структура і властивості різко змінюються (подумайте про перехід сніданку-обід в McDonalds - просто немає можливості отримати млинці після, або гамбургери до 10:30 ранку! [5]). Таким чином, у випадку з металом Sn зміни структури (від чотирьох до восьмикоординації) і в електронній провідності (ізолятор до металу) відбуваються одночасно. Як і в інших фазових переходах першого порядку, таких як лід до води до пари, існує приховане тепло, пов'язане з переходом, і розрив похідних властивостей, таких як теплоємність.
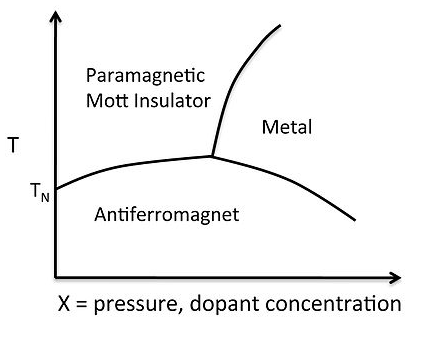
Типова діаграма фази для переходу метал-ізолятор показана праворуч для V 2 O 3. Октаедрильно координований іон V 3+ має кількість електронів d 2, тому на атом припадає дві непарні спини, а при низькій температурі спини в порядку решітки антиферомагнетично. Як ми дізналися в розділі 8, вище температури Нееля антиферомагнетик стає парамагнітом, який також є ізолятором Мотта. Збільшення тиску або легування електронами (наприклад, замінивши деяку d 3 Cr 3+ на V 3+) штовхає електронну щільність над переходом Мотта, спинами пари, і тверде тіло стає металевим.