2.3: Орбітальна симетрія
- Page ID
- 19925
Зображення МО для молекули ускладнюється, коли беруть участь багато валентних AoS. Ми можемо значно спростити проблему, зазначивши (без доказів тут), що орбіталі різної симетрії щодо молекули не взаємодіють. Операції симетрії молекули (які можуть включати обертання, дзеркальні площини, центри інверсії тощо) та класи симетрії зв'язків та орбіталів у молекулах можуть бути чітко визначені відповідно до теорії груп. Тут ми візьмемо простий підхід до цієї проблеми, заснований на нашому інтуїтивному розумінні симетрії тривимірних об'єктів, як показано на рис. \(\PageIndex{1}\).

АТ повинні мати однакову вузлову симетрію (як визначено операціями молекулярної симетрії), або їх перекриття дорівнює нулю.
Наприклад, в молекулі HCl існує унікальна вісь симетрії →, яка зазвичай визначається як декартова вісь z, як показано на рис. \(\PageIndex{2}\).
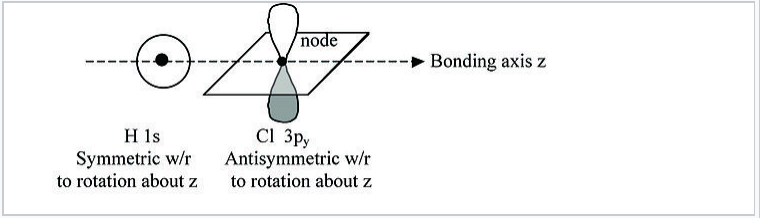
З цього малюнка видно, що орбіталь H 1s незмінна обертанням на 180° навколо осі зв'язку. Однак те ж обертання інвертує знак хвильової функції Cl 3p y. Оскільки ці дві орбіталі мають різну симетрію, орбітальна Cl 3p y не зв'язується і не взаємодіє з H 1s. Те ж саме стосується орбітальної Cl 3p x. Орбіталі p x і p y мають π симетрію (вузлова площина, що містить вісь зв'язку) і позначені π nb на діаграмі рівня енергії МО, рис. \(\PageIndex{3}\). На відміну від цього, орбіталі H 1s та Cl 3p z мають σ симетрію, що також є симетрією глиняного горщика, показаного на рис. \(\PageIndex{1}\). Оскільки ці орбіталі мають однакову симетрію (в точковій групі молекули), вони можуть складати сполучну і антизв'язуючу комбінації, наведені на рис. 2.1.1.
Діаграма МО HCl, яка включає всі валентні орбіталі атома Cl, показана на рис. \(\PageIndex{3}\). Дві орбіталі валентності Cl (3p x і 3p y) мають неправильну симетрію для взаємодії з орбіталлю H 1s. Орбітальна Cl 3s має таку ж (σ) симетрію, що і H 1s, але вона набагато нижча за енергією, тому орбітальної взаємодії мало. Таким чином, енергія орбіталі Cl 3s впливає лише незначно, утворюючи молекулу. Пари електронів на орбіталах π nb і σ nb, отже, не зв'язуються.
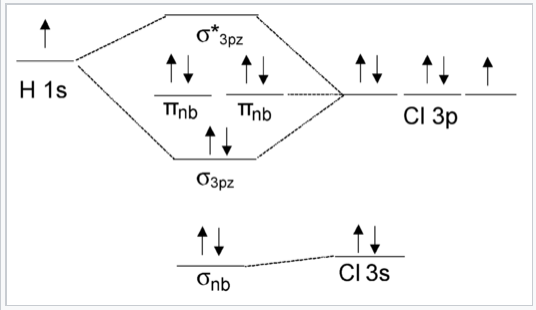
Зверніть увагу, що результат МО на рис. \(\PageIndex{3}\)(1 зв'язок і три пари незв'язних електронів) - це те саме, що ми отримали б з теорії валентних зв'язків для HCl. Незв'язні орбіталі локалізуються на атомі Cl, так само, як ми могли б припустити з картини валентного зв'язку.
Для того щоб відрізнити його від σ зв'язуючої орбіталі, орочкою позначається порожня в даному випадку σ антібондинговая орбіталь.
