1.4: Полярність зв'язку та міцність зв'язку
- Page ID
- 20198
Лінус Полінг ввів поняття електронегативності 1932 року для того, щоб пояснити додаткову стійкість молекул з полярними зв'язками. [12] Електронегативність атома, представлена грецькою літерою θ, може бути визначена як тенденція атома притягувати електрони до себе в хімічному зв'язку. За шкалою Паулінга різниця електронегативності між двома атомами A і B була визначена в терміні енергій дисоціації E d зв'язків A-A, B-B і A-B:
\[\chi_{A} - \chi_{B} = \sqrt{E_{d}(AB) - [E_{d}(AA) + E_{d}(BB)]/2}\]
де енергії виражаються в електронвольтах.
Це визначення, хоча і має пряме відношення до міцності хімічних зв'язків, вимагає термохімічних вхідних даних від багатьох сполук, деякі з яких були недоступні в той час. Маллікен [13] [14] і пізніше Пірсон [15] розробили шкалу електронегативності на основі середньої спорідненості електронів і енергії іонізації вільних атомів А і В, яку вони корелювали з термохімічними даними і шкалою Полінга.
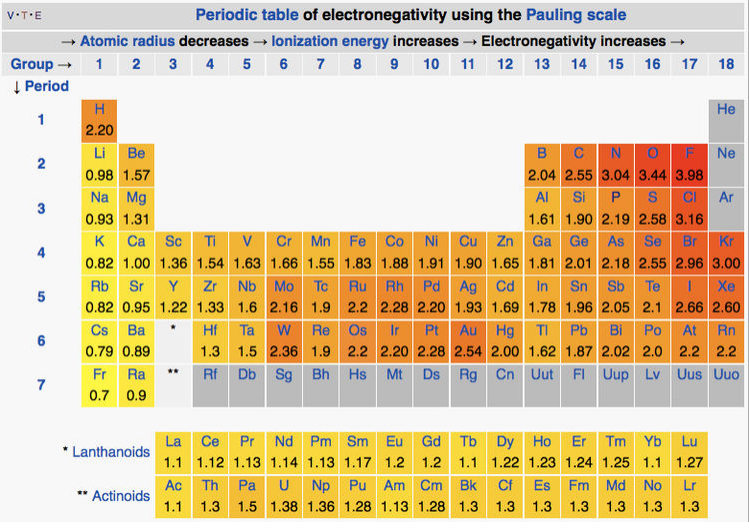
За шкалою Паулінга найменшими електронегативними елементами є лужні метали (θ = 0,7-1,0), а найбільш електронегативними є кисень (3,5) і фтор (4,0) у верхньому правому куті таблиці Менделєєва. Вуглець і водень мають проміжну електронегативність (2,6 і 2,2 за шкалою Паулінга відповідно). Загальна тенденція (див. Таблицю нижче) полягає в тому, що електронегативність збільшується вгору і вправо в таблиці Менделєєва. Є деякі цікаві винятки з цієї поведінки, особливо два острови з високою електронегативністю в нижній частині перехідного ряду, що досягають максимуму при вольфрамі (= 2.4) та золоті (θ = 2.5). Перший з них можна пояснити дуже високою енергією зв'язку метал-метал таких елементів, як Mo і W, які можуть використовувати всі шість своїх валентних електронів в зв'язку, як ми обговоримо в главі 6. Другий, однак, відбувається з більш слабо зв'язаними благородними металами, такими як Pt і Au, і відповідає за їх низьке положення в рядах активності, [16] а також їх надзвичайні властивості як каталізатори.
Таблиця електронегативності Паулінга
Полярність зв'язків визначається відмінностями електронегативності. Як орієнтир ми визначаємо облігації як:
- іонний, якщо Δ> 2,0
- полярний, якщо 2,0 > Δ> 0,5
- неполярний якщо 0.5> Δ
Полярність зв'язків допомагає нам зрозуміти нековалентні сили між молекулами, такі як водневий зв'язок та дипольно-дипольні взаємодії. Це також допомагає нам інтерпретувати реактивність молекул. Наприклад, зв'язок Si-H (θ Si = 1,8, θ Н = 2,1) більш гідридноподібна, ніж зв'язок С-Н (C = 2,5, θ H = 2,1). Тому силани реагують з кислотами, утворюючи Н 2, тоді як фосфіни (P = 2,1) та вуглеводні - ні. Аналогічно, електрофільні реакції заміщення протікають більш легко на сполуках Si-H і P-H, ніж на сполуках С-Н.
Існує також кореляція між міцністю хімічного зв'язку та довжиною зв'язку, більш довгі зв'язки слабкіші через слабке орбітальне перекриття. Паулінг ввів емпіричну формулу, що стосується довжини зв'язку з міцністю зв'язку. Для заданої пари атомів (наприклад, два атоми вуглецю):
\[D(n) = D(1) - 0.6 \log_{10}(n)\]
де D (n) представляє довжину зв'язку в Å, а n - порядок зв'язку. D (1) у цьому випадку буде довжиною одиночного зв'язку C-C, яку ми можемо отримати із середньої довжини зв'язку в алканах (1,54 Å). Використовуючи цю формулу, можна передбачити, що довжини зв'язків в етилені (подвійний зв'язок C = C) та ацетилені (потрійний зв'язок CC) повинні бути 1,36 та 1,25 Å відповідно, які близькі до експериментальних значень 1,33 та 1,20 Å. У пов'язаній формі формула Полінга може бути використана для обчислення довжин зв'язків, коли довжина одиночного зв'язку D (1) недоступна:
\[D(n) = D(m) -0.6 \log_{10}(n/m)\]
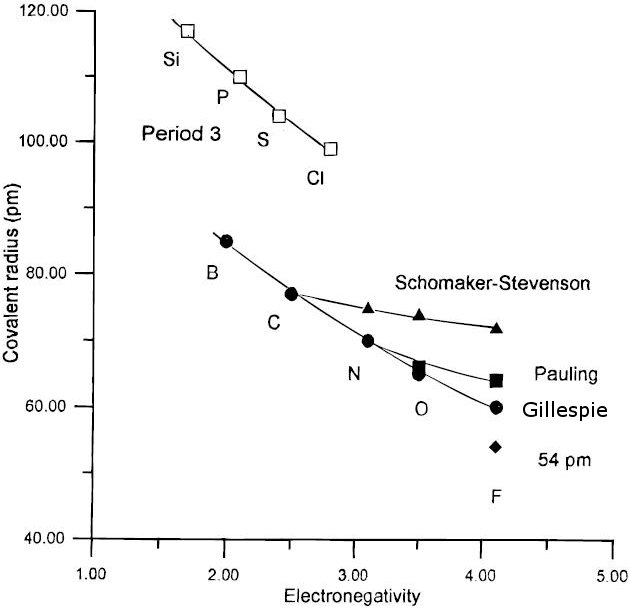
Тут n і m представляють два різних порядку зв'язків між однаковими видами атомів. Це говорить, наприклад, що різниця в довжині між потрійним і подвійним зв'язком, D (2) -D (3), повинна бути - 0,6 лог 10 (2/3) = 0,11 Å. Деякі довжини зв'язків і енергії зв'язку аномальні. Наприклад, довжина зв'язку F-F в F 2 становить 1,43 Å, що на 0,15 Å довше, ніж удвічі більше ковалентного радіуса атома F (0,64 Å). F-F зв'язок також досить слабка (енергія дисоціації зв'язку = 155 кДж/моль) щодо зв'язку Cl-Cl (242 кДж/моль). Вставляючи додаткову довжину зв'язку в формулу Полінга, ми обчислюємо, що порядок зв'язку в молекулі F 2 становить лише 0,6, тобто істотно слабкіше, ніж одиночний зв'язок F-F. Фізична причина цього полягає в тому, що зв'язок F-F «розтягується» відштовхуванням одиноких пар на атомах F. Ця скупченість викликана тим, що орбітальна ядро [He] 1s 2, а також валентні орбіталі атомів фтору скорочуються високим ядерним зарядом. Атом Cl 2, з його більшим [Ne] (1s 2 2s 2 2p 6) ядром, навпаки, має «нормальну» довжину одного зв'язку (1,98 Å), яка вдвічі перевищує ковалентний радіус атома Cl (0,99 Å). Подібний ефект відштовхування одинокої пари пояснює аномально довгі та слабкі одиночні зв'язки N-N та O-O в гідразині (H 2 N-NH 2) та пероксиді водню (HO-OH), які обидва є високореактивними молекулами.
Важливі ролі відмінностей електронегативності та відштовхування одиноких пар очевидні при порівнянні тенденцій міцності зв'язків. У таблиці нижче показані середні однозв'язкові ентальпії p-блокових елементів з H і F. H робить більш міцні зв'язки з елементами 2-го ряду (C, N, O, F), ніж з елементами третього ряду (Si, P, S, Cl), оскільки валентні електрони 2p ближче до ядра і, таким чином, роблять більш міцні зв'язки, ніж електрони на 3p орбіталах. Зв'язки з Н також слідують очікуваній тенденції збільшення міцності зв'язку зі збільшенням різниці електронегативності. Однак зв'язки між елементами другого ряду (C, N, O, F) і F аномально слабкі через відштовхування однієї пари. З цієї причини зв'язок Si-F істотно міцніше, ніж зв'язок C-F, тоді як зв'язок C-H набагато міцніше, ніж зв'язок Si-H. Міцна зв'язок Si-F є причиною того, що HF травляє скло (для отримання SiF 6 2 - аніон), а міцна C-H зв'язок є важливим фактором стабільності вуглеводнів та інших органічних молекул.
| С-Ч 413 | Н-Ч 391 | О-Ч 483 | Ч-Ф 567 |
| Си-Н 323 | П-Ч 322 | С-Ч 339 | Н-Кл 431 |
| С-Ф 485 | Н-Ф 272 | О-Ф 190 | Ф-Ф 155 |
| Сі-Ф 565 | П-Ф 490 | С-Ф 327 | Кл-Ф 253 |
Аномально слабкий зв'язок в F 2 відповідає за високу електронегативність фтору, а також легендарну реакційну здатність елементного газу фтору, який вибухонебезпечно реагує з воднем і порошкоподібними металами. Через нестабільність елементного фтору та полярну природу його зв'язків з більшою кількістю електропозитивних елементів сполуки фтору, як правило, дуже стабільні. Наприклад, благородні гази Xe і Kr реагують з фтором з утворенням ковалентних сполук, тоді як інші галогени не реагують. Фторуглеродні сполуки містять міцні C-F зв'язки і мають високу термічну і хімічну стабільність. Перфторуглеці, такі як тефлон (полі (тетрафторетилен), - (CF 2 CF 2) n-, PTFE) також є високогідрофобними. Надзвичайна гідрофобність перфторуглеродів виникає через те, що групи -CF 2 - і -CF 3 «жирніші», ніж групи -CH 2 - і -CH 3; тому розчинення їх у воді є більш руйнівним для мережі зв'язку водню, ніж розчинення вуглеводневий. [21]

