5.4.1: Біфторид аніон
- Page ID
- 32791
Пошук SALC та креслення діаграми МО для [F-H-F]\(^-\)
Лінійний аніон [F-H-F]\(^-\) є гарним місцем для початку як приклад, щоб проілюструвати процес генерації SALC підвісних атомів, а потім побудови молекулярної орбітальної діаграми для багатоатомної молекули. Ми продовжимо використовувати кроки, описані на попередній сторінці, для генерації SALC та молекулярної орбітальної діаграми.
Крок 1. Знайдіть точкову групу молекули і призначте декартові координати так, щоб z була головною віссю.
Починаємо з призначення відповідної групи точок для цієї молекули:\(D_{\infty h}\) (Рис.\(\PageIndex{1}\)). Як згадувалося на попередній сторінці, корисно замінити\(D_{2h}\)\(D_{\infty h}\) при генерації SALC та молекулярних орбітальних діаграм. \(z\)Вісь призначається бути колінійної з головною віссю, і в цьому випадку збігається з\(C_\infty\) віссю (рис.\(\PageIndex{1}\)).
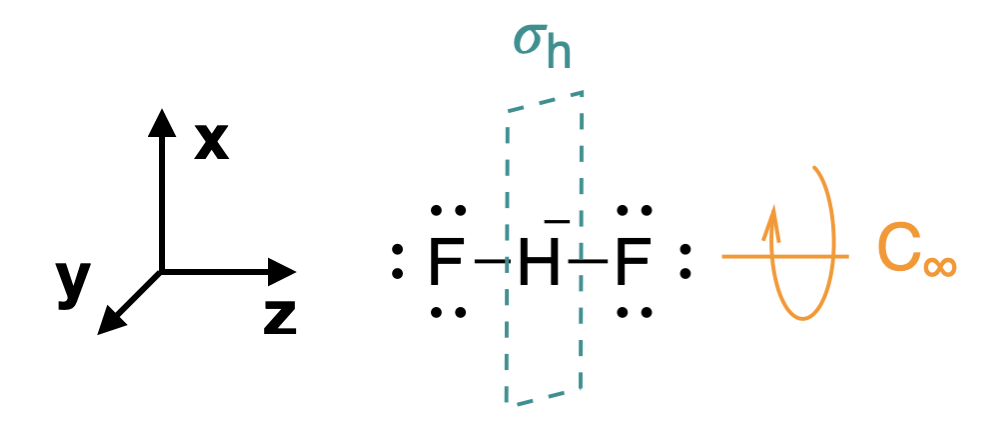
Крок 2. Визначте і підрахуйте валентні орбіталі підвісних атомів.
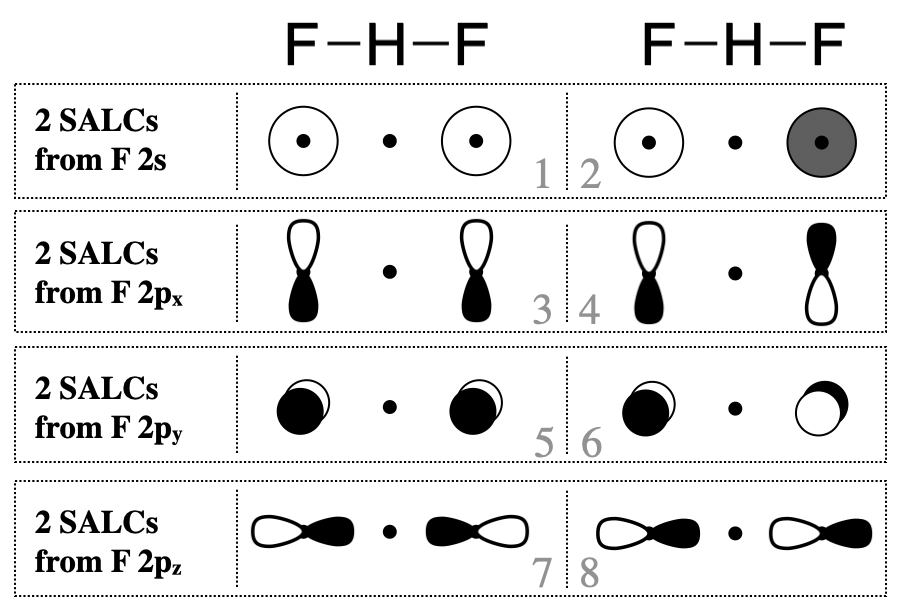
Наступним кроком є виявлення валентних орбіталів на підвісних атомах F, які утворюватимуть SALC. У більшості випадків слід розглянути всі валентні орбіталі. При цьому кожен з атомів фтору має чотири валентні орбіталі (\(2s\),\(2p_x\),\(2p_y\), і\(2p_z\)). Від цих восьми фторвалентних орбіталей слід очікувати восьми групових орбіталів (SALC).
3. - 5. Створити SALCS (ярлик)
Намалювати ці САЛК для цієї молекули досить просто, і нам не потрібно виконувати всі кроки пошуку та зменшення їх.\(\Gamma\) Швидше за все, ви можете діяти так, ніби ви створюєте склеювання та антизв'язуючі молекулярні орбіталі між двома атомами F, за винятком того, що орбіталі F розділені атомом H. Приблизні ескізи восьми САЛК з F валентних орбіталей наведені на рис\(\PageIndex{2}\).
6. Намалюйте діаграму МО, об'єднавши SALC з AO подібної симетрії.
SALC можуть продуктивно взаємодіяти з центральним атомом тільки тоді, коли симетрія сумісна. Лише деякі групи орбіталів на малюнку\(\PageIndex{2}\) мають відповідну симетрію для поєднання з валентною орбіталлю атома водню (H\(1s\)). У цьому простому випадку ви можете вирішити, чи мають орбіталі сумісну симетрію, візуально оглянувши форми групових орбіталей. F\(2p_y\) та\(2p_x\) орбіталі не мають відповідної симетрії для зв'язку з\(1s\) орбіталлю H, оскільки вузли цих орбіталів проходять через центр\(1s\) орбіталі H, таким чином ми можемо усунути всі SALC, що складаються з F\(2p_x\) і\(2p_y\) (це SALC пронумеровані 3-6 на малюнку\(\PageIndex{2}\)). З іншого боку, F\(2s\) та\(2p_z\) орбіталі окремо мають відповідну форму та напрямок у просторі для продуктивної взаємодії з\(1s\) орбіталлю H. Однак лише SALC, де вся група має відповідну симетрію, поєднуватимуться з Н\(1s\) для отримання склеювання або антизв'язуючих молекулярних орбіталів. Тільки САЛК, позначені цифрами 1 і 7, можуть поєднуватися з\(s\) орбіталлю в центрі групи. Способи, якими ці САЛК можуть поєднуватися з H,\(1s\) проілюстровані на малюнку\(\PageIndex{3}\).
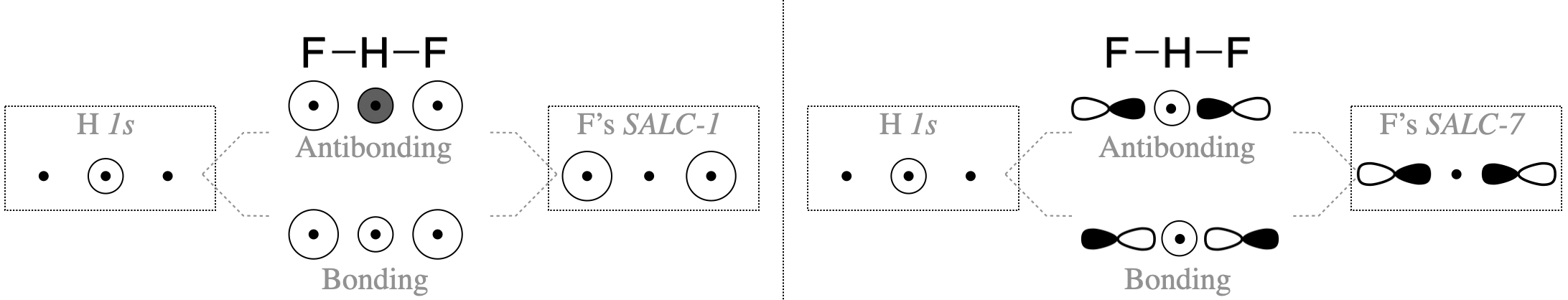
Перш ніж припустити, що і SALC-1, і SALC-7 будуть поєднуватися з\(1s\) орбіталлю H, ми повинні розглянути енергії всіх атомних орбіталей. \(2p_z\)Орбіталь F має потенційну енергію\(-18.7\) еВ (див. Таблицю 5.3.1). Це хороший збіг для\(1s\) орбітальної H (-13,6 еВ). Однак\(2s\) орбіталь F має набагато нижчу енергію\(-46.37\) еВ і мала б слабку взаємодію з H\(1s\).
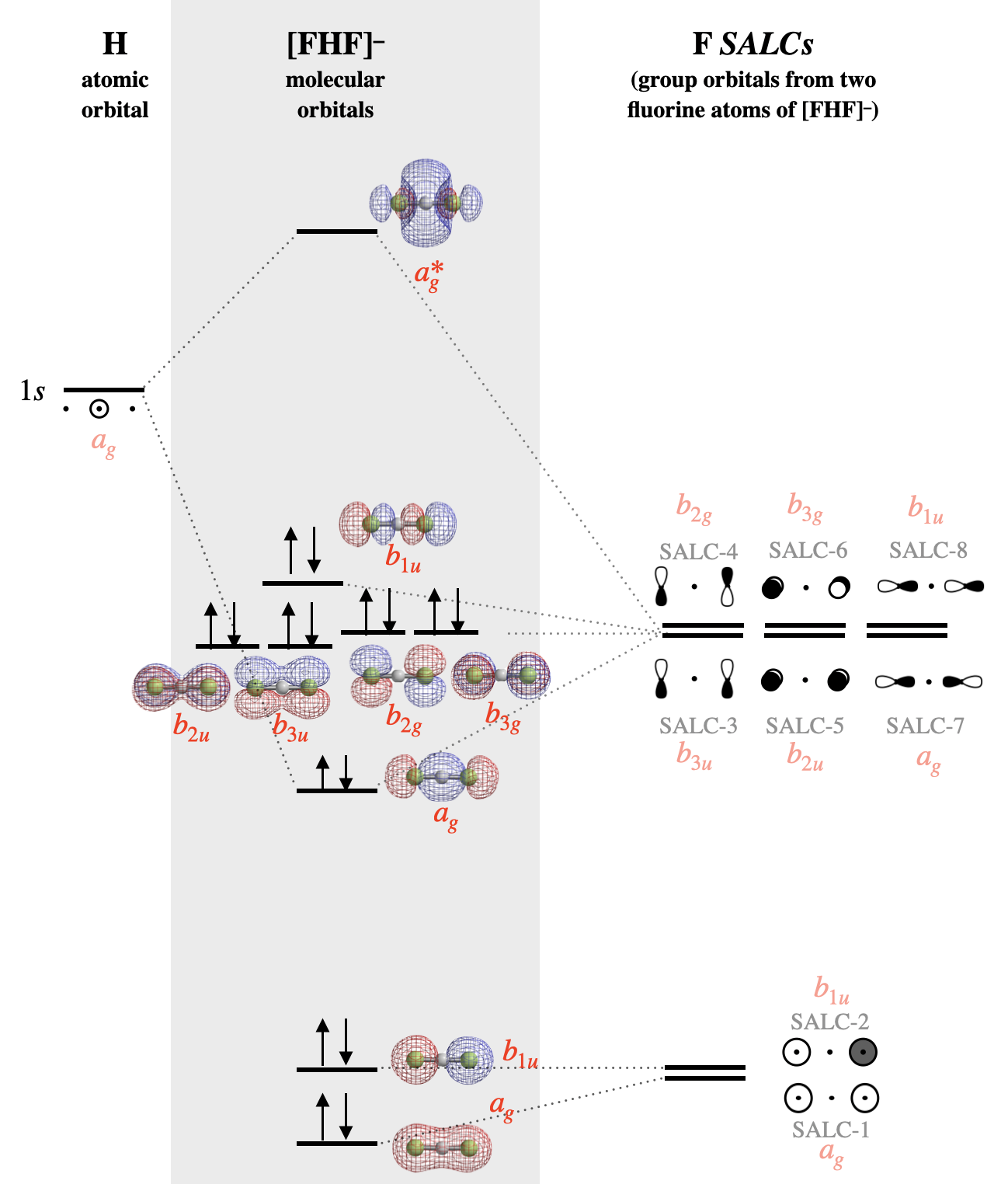
Молекулярна орбітальна діаграма для [F-H-F]\(^-\) показана на рис\(\PageIndex{4}\). Зверніть увагу, що всім атомним орбіталям, груповим орбіталям (SALC) та молекулярним орбіталям на малюнку\(\PageIndex{4}\) присвоюється мітка симетрії, яка відповідає симетрії кожного елемента під\(D_{2h}\) точковою групою. Молекулярні орбітальні мітки відповідають нижнім регістрам Mulliken Labels окремих скорочуваних уявлень з таблиці\(D_{2h}\) символів. Символи верхнього регістру використовуються для позначення симетрії та нескорочуваних уявлень, тоді як символи нижнього регістру використовуються для позначення ідентичності орбіти з цією симетрією. Методи маркування, описані для простих двоатомних лінійних молекул (\(\sigma, \pi\)), недостатньо для позначення більш складних симетрій молекулярних орбіталів у багатоатомних молекулах. Використання символів Mulliken у нижньому регістрі є найсуворішим способом маркування орбіталів. Зверніться до інструктора, як ви повинні позначити орбіталі для будь-якої градуйованої роботи.
- Клацніть тут для версії малюнка з\(\PageIndex{4}\) використанням\(D_{\infty h}\) маркування:
-
Для груп з високою симетрією ярликом є використання групи нижньої симетрії, яка підтримує критичні елементи симетрії. У випадку з\(D_{\infty h}\) точковою групою часто досить використовувати наближення групи\(D_{2h}\) точок і таблицю символів. Це та сама діаграма МО, як показано вище, але з використанням міток симетрії, відповідних для\(D_{2h}\) наближення.
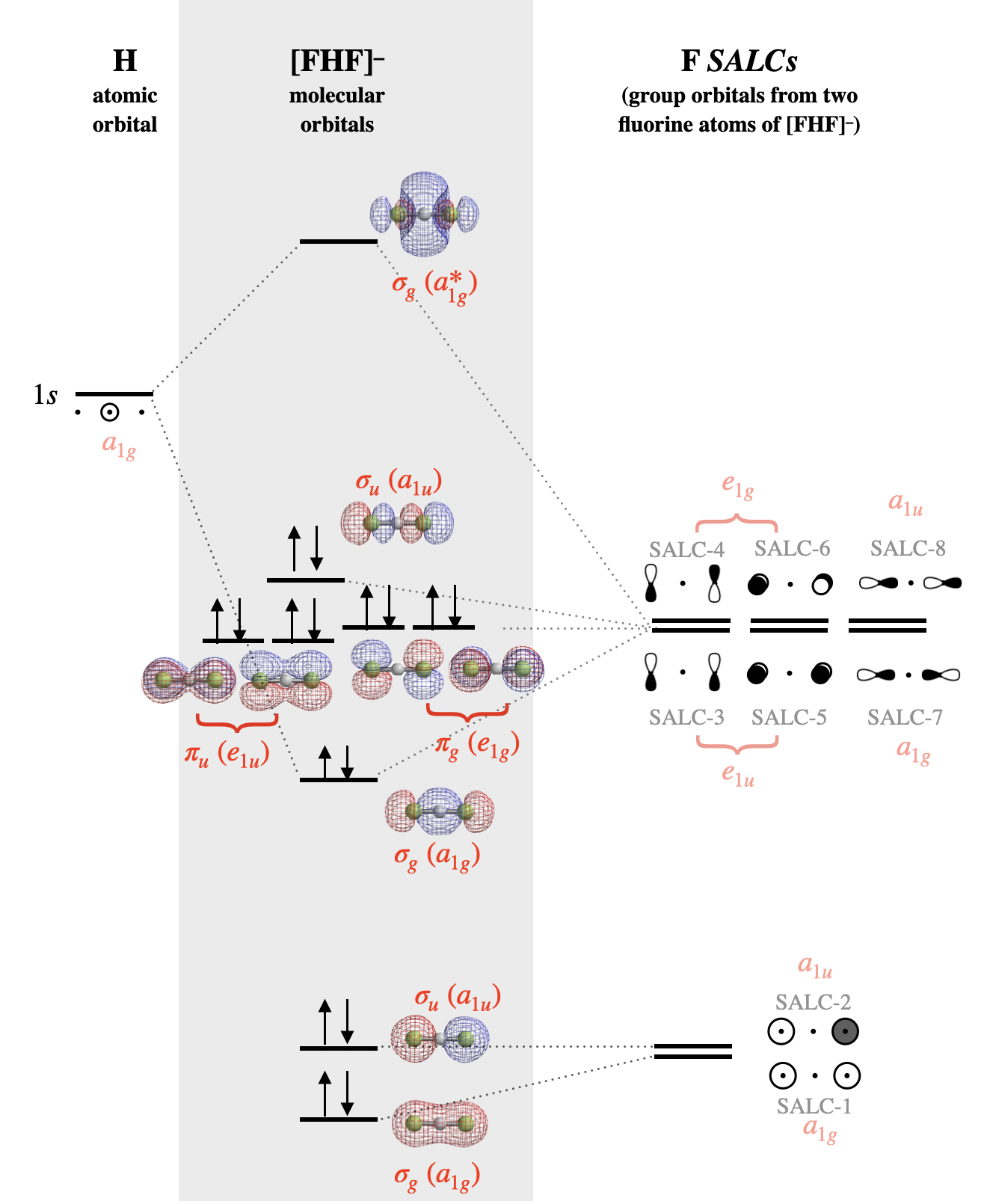
Альтернативний малюнок\(\PageIndex{4}\): Молекулярна орбітальна діаграма для [F-H-F]\(^-\). Молекулярні орбітальні поверхні та рівні відносної енергії були розраховані за допомогою програмного забезпечення Spartan. Сальк маркуються відповідно до номерів, призначених на рис\(\PageIndex{2}\). Симетрія кожного SALC і орбіталі під \(D_{2h}\)точковою групою показана червоним шрифтом. (CC-BY-NC-SA; Кетрін Хаас)
Побудова діаграми МО
Після ідентифікації атомних орбіталів і побудови SALC, помістіть атомні орбіталі H на одній стороні діаграми, а всі SALC з F на іншій стороні. Молекулярні орбіталі знаходяться в центрі.
Фторні САЛК з найменшою енергією будуть ті, що складаються з атомних орбіталів фтору з найнижчою енергією; це будуть SALC-1 (\(a_{1g}\)) та SALC-2 (\(a_{1u}\)), які побудовані з\(s\) атомних орбіталів фтору. З цих двох орбіталей та, що має нульові вузли, була б трохи нижчою за енергією, ніж та, що має один вузол. Коли ці дві орбіталі утворюють молекулярні орбіталі, повністю симетричний SALC-1 буде здебільшого не зв'язуватися з незначним характером зв'язку з незначною комбінацією з водневою\(1s\) орбіталлю. SALC-2, однак, симетрично несумісний з воднем\(1s\) і буде справді незв'язною орбіталлю, розподіленою над обома атомами F.
Шість SALC, побудованих з\(p\) фторорбіталів, матимуть вищу енергію, оскільки\(p\) атомні орбіталі фтору мають вищу енергію, ніж\(s\) орбіталі (SALC-3 через SALC-8). Знову ж таки, ми очікуємо, що SALC з більшою кількістю вузлів (SALC-4, -6, -8) матимуть трохи вищу енергію, ніж ті, у яких менше вузлів (SALC-3, -5, -7). SALC-7 сформує зв'язуючу та антизв'язуючу взаємодію з водневою\(1s\) орбіталлю. Всі інші SALCS справді не зв'язуються, але є невиродженими орбіталями, що не зв'язуються.
У біфториді існує важлива відмінність між структурою Льюїса та молекулярно-орбітальним описом одиноких пар. У теорії Льюїса одинокі пари локалізуються на окремі атоми фтору, тоді як в описі молекулярної орбіти кожна одинока пара розподілена по обом атомам фтору одночасно (див. Поверхневе зображення кожної молекулярної орбіталі на малюнку\(\PageIndex{4}\)).