5.2.1: Молекулярні орбіталі
- Page ID
- 32841
Є кілька випадків, коли наші більш елементарні моделі зв'язку (наприклад, теорія Льюїса та Теорія валентних зв'язків) не можуть передбачити фактичні молекулярні властивості та реакційну здатність. Класичним прикладом є випадок\(\ce{O_2}\) і його магнітні властивості. При дуже низьких температурах,\(\ce{O_2}\) притягується до магнітного поля, і при цьому воно повинно бути парамагнітним (непарні електрони породжують магнетизм). Дивіться відео нижче!
Магнітні властивості\(\ce{O_2}\) легко раціоналізуються його молекулярною орбітальною діаграмою. Молекулярна орбітальна діаграма - це діаграма, яка показує відносні енергії та ідентичності кожної молекулярної орбіталі в молекулі. \(\PageIndex{1}\)На малюнку показана спрощена і загальна молекулярна орбітальна діаграма для гомоядерної двоатомної молекули другого ряду. Діаграма спрощена тим, що передбачає, що взаємодії обмежуються виродженими орбіталями з двох атомів (див. Наступний розділ).
Є деякі речі, які ви повинні відзначити, коли ви оглядаєте малюнок\(\PageIndex{1}\) (і майте це на увазі, коли ви малюєте свої власні діаграми!). По-перше, зверніть увагу, що існує така ж кількість молекулярних орбіталей, як атомні орбіталі. По-друге, зверніть увагу, що кожна орбітальна на діаграмі строго позначена за допомогою міток (\(\sigma\)і\(\pi\)), які включають індекси\(u\) і\(g\). Ці мітки і індекси вказують на симетрію орбіталей. \(\sigma\)Символ вказує на те, що орбіта симетрична щодо міжядерної осі, тоді як\(\pi\) мітка вказує на те, що вздовж цієї осі є один вузол. The\(g\) і\(u\) стояти для gerade і ungerade, німецькі слова для рівних і нерівномірних, відповідно. Індекс\(g\) надається орбіталям, які є рівними або симетричними по відношенню до центру інверсії. Індекс\(u\) надається орбіталям, які є нерівномірними або антисиметричними по відношенню до центру інверсії. Зображення розрахованих молекулярних орбіталів показані на малюнку,\(\PageIndex{1}\) щоб проілюструвати симетрію кожної орбіти.
Ще одна важлива річ, яку слід зазначити, - це те, що діаграма на малюнку\(\PageIndex{1}\) не вистачає електронів (оскільки вона є загальною для будь-якої двоатомної молекули другого ряду). Якби це була повна молекулярна орбітальна діаграма, вона включала б електрони для кожного атома і для молекули. Електрони в молекулярних орбіталах заповнюються так само, як атомна орбітальна діаграма заповнюється, де електрони займають нижчу енергію орбіталів перед орбіталями вищої енергії, а електрони займають порожні вироджені орбіталі перед сполученням. Повна молекулярна орбітальна діаграма покаже, чи є молекула діамагнітною або парамагнітною. Він також може бути використаний для обчислення порядку зв'язку молекули (кількість зв'язків між атомами), використовуючи формулу нижче:
\[\text{Bond order } =\frac{1}{2}\left[\left(\begin{array}{c}\text { number of electrons } \\ \text { in bonding orbitals }\end{array}\right)-\left(\begin{array}{c}\text { number of electrons } \\ \text { in antibonding orbitals }\end{array}\right)\right] \nonumber \]
Загалом, невалентні (ядро) електрони можна ігнорувати, оскільки вони нічого не сприяють порядку зв'язку. Насправді багато молекулярних орбітальних діаграм ігнорують основні орбіталі, оскільки вони незначні для зв'язкових взаємодій та реактивності.

Тепер, щоб побачити, як ця молекулярна орбітальна діаграма може пояснити магнітну поведінку\(\ce{O2}\), заповніть приклад нижче.
Давайте змінимо малюнок\(\PageIndex{1}\), щоб зробити його специфічним для\(\ce{O2}\). Повторно намалюйте діаграму МО (не потрібно малювати форми орбіталей). Заповніть правильну кількість електронів для кожного атома кисню по обидва боки діаграми. Потім заповніть сумарні молекулярні електрони в центрі. Обчисліть порядок зв'язку і визначити, діамагнітний він або парамагнітний.
Рішення
Діаграма на малюнку\(\PageIndex{1}\) включає орбіталі ядра (1s) та валентні електрони (2s, 2p). Тому розглянемо всі електрони в атомі кисню і молекулі диоксигену. Атом кисню має вісім загальних електронів. Таким чином, ми заповнюємо вісім електронів в атомні орбіталі для атома кисню праворуч, а вісім електронів в атомні орбіталі для кисню ліворуч. Загальна кількість електронів для молекули становить шістнадцять, тому заповніть 16 електронів в молекулярні орбіталі, обов'язково застосовуючи правило Гунда і принцип Ауфбау. В результаті вийде діаграма, яка виглядає як намальована нижче на малюнку\(\PageIndex{2}\).
Порядок зв'язку обчислюється за допомогою молекулярних орбіталів (ми можемо ігнорувати атомні орбіталі). Є 10 електронів в зв'язуючих орбіталах і 6 електронів в антитілінгових орбіталах). Це дає порядок облігацій\(\frac{1}{2}(10-6)=2\). Цей порядок зв'язків узгоджується з теорією валентних зв'язків!
Ця діаграма вказує на те, що диоксиген є парамагнітним; він має два непарних електрона на\(\pi^*\) орбіталі. Ця парамагнітна електронна конфігурація пояснює, чому диоксиген приєднується до магнітних полів!

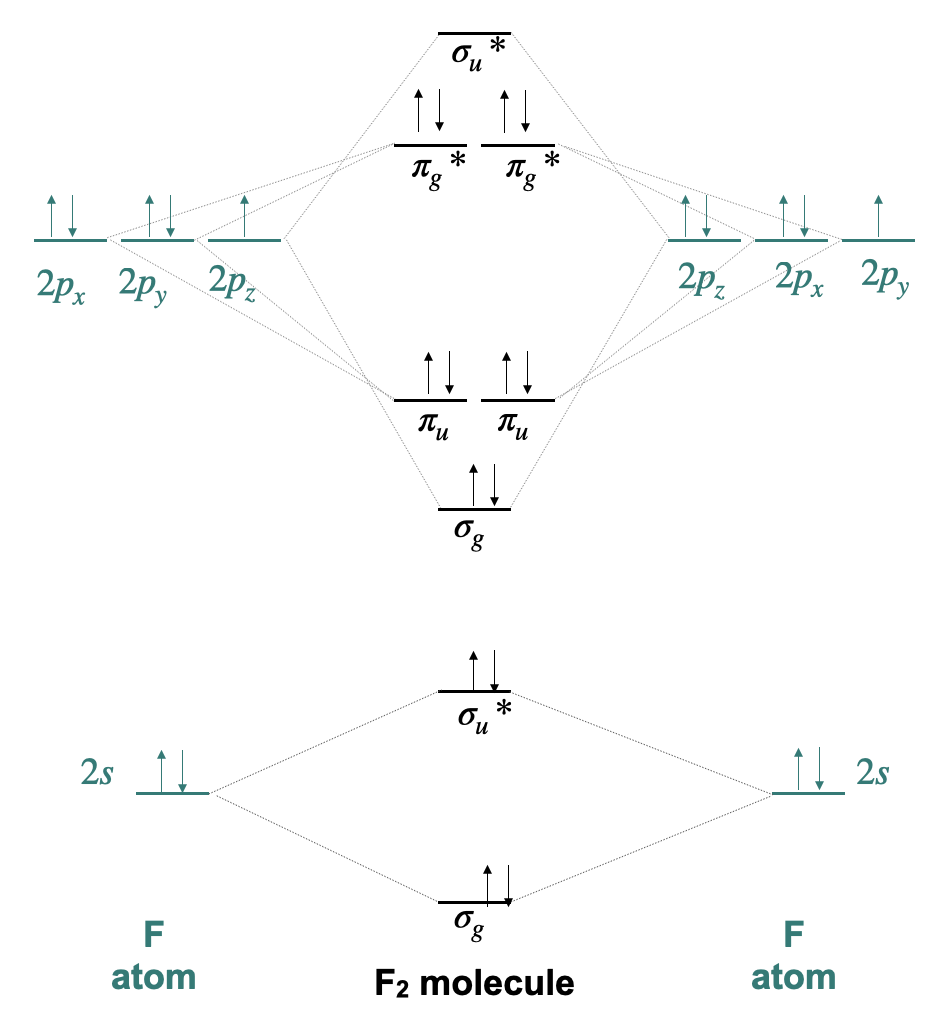
Намалюйте молекулярну орбітальну діаграму для\(\ce{F2}\); обов'язково позначте свої орбіталі відповідною симетрією та підрахуйте орбіталі, щоб переконатися, що загальна кількість атомних орбіталей та молекулярних орбіталів однакова. Як ярлик включають тільки валентні орбіталі і електрони. Що таке замовлення облігацій? Молекула діамагнітна або парамагнітна?
- Відповідь
-
Валентні орбіталі на атомі F становлять 2s і 2p. І, є сім валентних електронів в F. Це дає чотирнадцять загальних валентних електронів. Діаграма МО валентних молекулярних орбіталів може бути побудована шляхом об'єднання валентних 2s і валентних 2p орбіталей з кожного атома F. Порядок зв'язку дорівнює 1, а молекула діамагнітна.