5.1.4: Незв'язні орбіталі та інші фактори
- Page ID
- 32808
Найпростіший випадок - це коли існує парна кількість атомних орбіталів, які поєднуються, утворюючи міцні зв'язкові та антизв'язуючі орбіталі. Але що робити, якщо спостерігається нерівномірне число атомних орбіталей? Або що робити, якщо є якісь орбіталі, які не відповідають критеріям склеювання? Або що робити, якщо зв'язуючі взаємодії слабкі? У цих випадках на молекулі будуть молекулярні орбіталі, які мають незв'язуючий характер.
Важливо зазначити, що зв'язок, незв'язуючий та антизв'язуючий характер орбіталів існують на спектрі. Деякі зв'язкові та антизв'язкові орбіталі можуть мати певний незв'язуючий характер залежно від того, де лежать їх енергії щодо вихідних атомних орбітальних енергій. Коли молекулярні орбіталі мають енергії, подібні до своїх початкових атомних орбіталів, вони матимуть певний незв'язний характер. Чим ближче енергії атомних і молекулярних орбіталей, тим більше не зв'язуються молекулярні орбіталі.
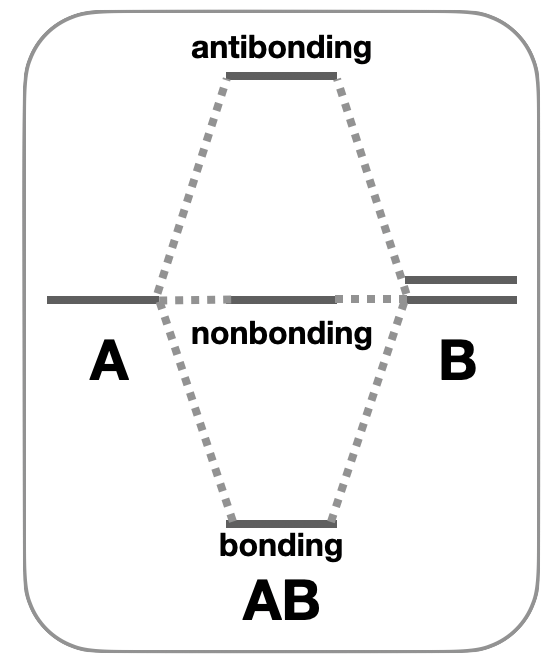
Нерівномірна кількість атомних орбіталей: У випадку, якщо існує нерівномірна кількість атомних орбіталей із сумісною симетрією, утворюються орбіталі з незв'язним характером. Наприклад, у випадку, коли три атомні орбіталі об'єднуються, найбільш поширеним результатом є утворення низькоенергетичної зв'язкової орбіти, високоенергетичної антібондинговой орбіти та незв'язної орбіти проміжної енергії (рис.\(\PageIndex{1}\)).
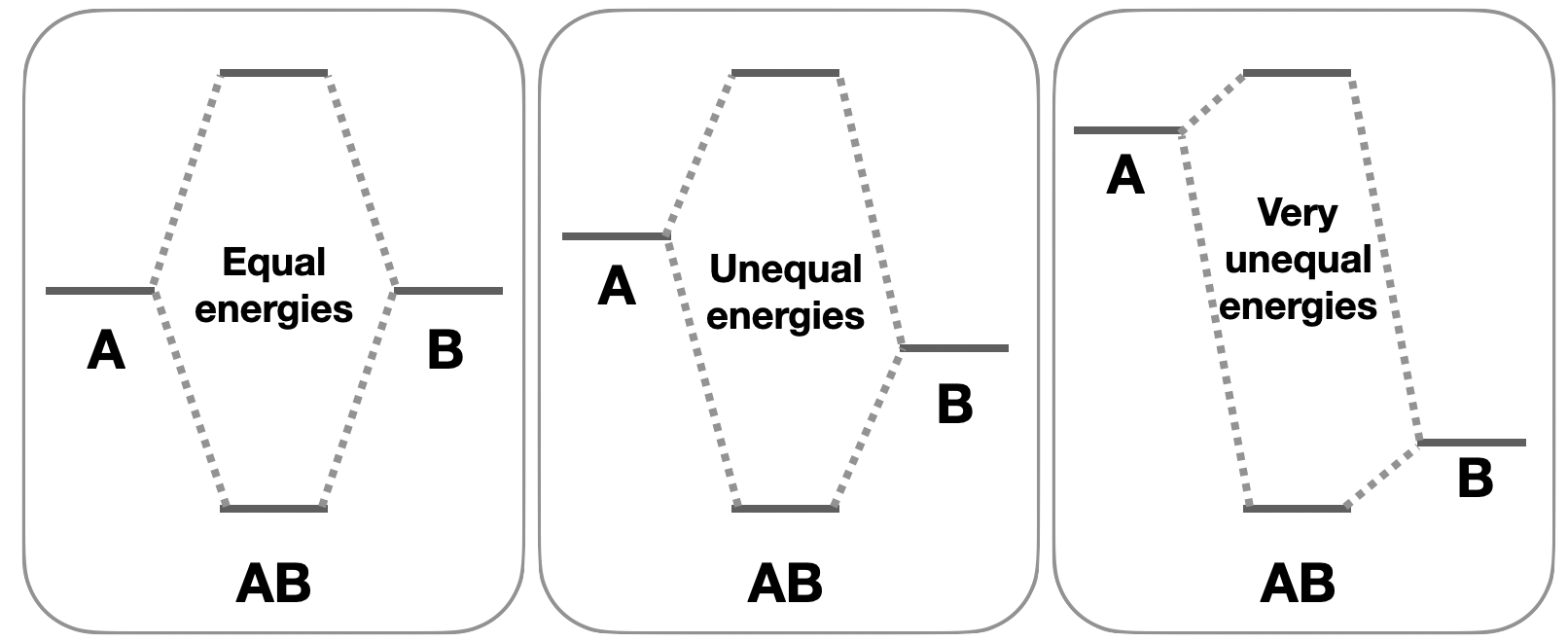
Відмінності в енергії: Поєднання орбіталів з різними енергіями може призвести до орбіталів з незв'язним характером. Атомні орбіталі, які мають подібні енергії, матимуть найсильніші взаємодії і призведуть до зв'язування молекулярних орбіталів з набагато нижчими енергіями, ніж компонент атомних орбіталів. З іншого боку, атомні орбіталі з дуже нерівною енергією мають слабшу взаємодію, оскільки молекулярні орбіталі ближче за енергією до атомних орбітальних енергій, таким чином, є менша енергетична користь для розміщення електронів у зв'язку молекулярних орбіталів (рис.\(\PageIndex{2}\)). Коли зв'язкові або антизв'язуючі орбіталі близькі до енергій атомних орбіталів, що сприяють, ці молекулярні орбіталі можуть мати певний незв'язуючий характер.