16.1: Спонтанність
- Page ID
- 22391
⟩
- Розрізняють спонтанні і неспонтанні процеси
- Опишіть розгін речовини і енергії, що супроводжує певні спонтанні процеси
У цьому розділі розглянемо відмінності між двома типами змін в системі: тими, що відбуваються спонтанно, і тими, що відбуваються лише при безперервному введенні енергії. При цьому ми отримаємо розуміння того, чому деякі системи природно схильні змінюватися в одному напрямку за певних умов. Ми також отримаємо уявлення про те, як спонтанність процесу впливає на розподіл енергії та речовини всередині системи.
Спонтанні і неспонтанні процеси
Процеси мають природну тенденцію протікати в одному напрямку при заданому наборі умов. Вода природним чином буде стікати вниз, але в гору потік вимагає зовнішнього втручання, такого як використання насоса. Спонтанний процес - це той, який відбувається природним шляхом за певних умов. Неспонтанний процес, з іншого боку, не відбудеться, якщо він не буде «керований» постійним введенням енергії із зовнішнього джерела. Процес, який є спонтанним в одному напрямку при певному наборі умов є неспонтанним у зворотному напрямку. При кімнатній температурі і типовому атмосферному тиску, наприклад, лід буде мимовільно танути, але вода мимовільно не замерзне.
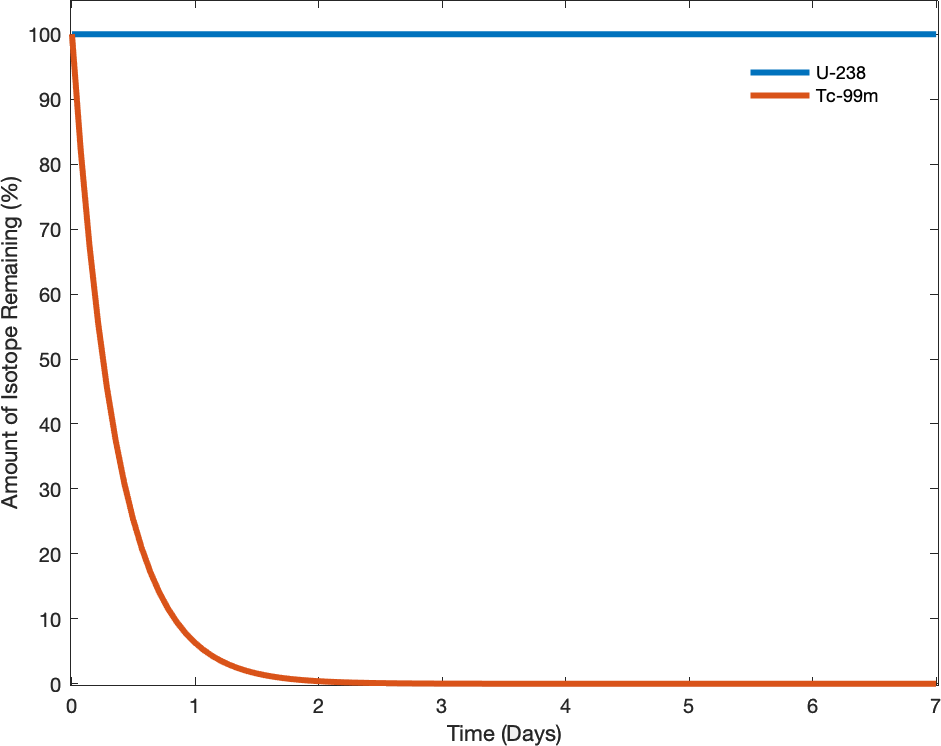
Спонтанність процесу не корелює зі швидкістю процесу. Спонтанна зміна може бути настільки швидкою, що вона по суті миттєва або настільки повільна, що її неможливо спостерігати протягом будь-якого практичного періоду часу. Щоб проілюструвати цю концепцію, розглянемо розпад радіоактивних ізотопів, тему більш ретельно розглянуту в розділі про ядерну хімію. Радіоактивний розпад - це за визначенням спонтанний процес, при якому ядра нестабільних ізотопів випромінюють випромінювання в міру перетворення в більш стабільні ядра. Всі процеси розпаду відбуваються спонтанно, але швидкості розпаду різних ізотопів різняться в широких межах. Technetium-99M є популярним радіоізотопом для медичних досліджень візуалізації, який зазнає відносно швидкого розпаду і демонструє період напіврозпаду близько шести годин. Уран-238 є найпоширенішим ізотопом урану, і його розпад відбувається набагато повільніше, проявляючи період напіврозпаду більше чотирьох мільярдів років (рис.\(\PageIndex{1}\)).
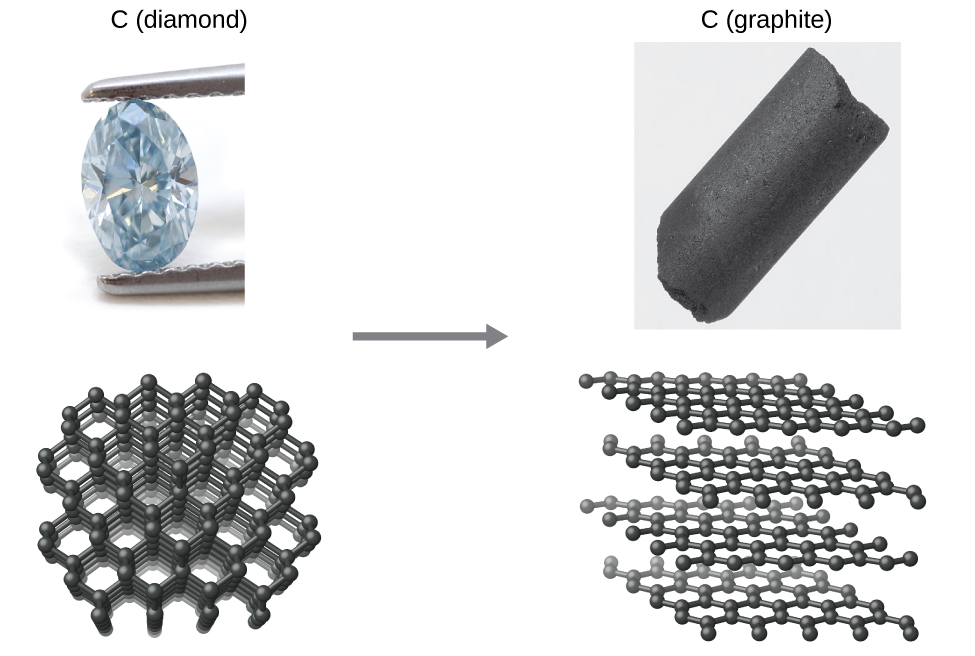
Як інший приклад розглянемо перетворення алмазу в графіт (рис.\(\PageIndex{2}\)).
\[\ce{C(s, diamond)}⟶\ce{C(s, graphite)} \label{Eq1} \]
Діаграма стану вуглецю вказує на те, що графіт є стабільною формою цього елемента під атмосферним тиском навколишнього середовища, тоді як алмаз є стабільним алотропом при дуже високих тисках, таких як ті, що присутні під час його геологічного формування. Термодинамічні розрахунки такого роду, описані в останньому розділі цієї глави, вказують на те, що перетворення алмазу в графіт при тиску навколишнього середовища відбувається спонтанно, проте алмази спостерігаються, як існують і зберігаються в цих умовах. Хоча процес є спонтанним в типових умовах навколишнього середовища, його швидкість надзвичайно повільна, і тому для всіх практичних цілей алмази дійсно «назавжди». Такі ситуації підкреслюють важливу відмінність між термодинамічним та кінетичним аспектами процесу. У цьому конкретному випадку алмази, як кажуть, термодинамічно нестабільні, але кінетично стабільні в умовах навколишнього середовища.
Розгін речовини та енергії
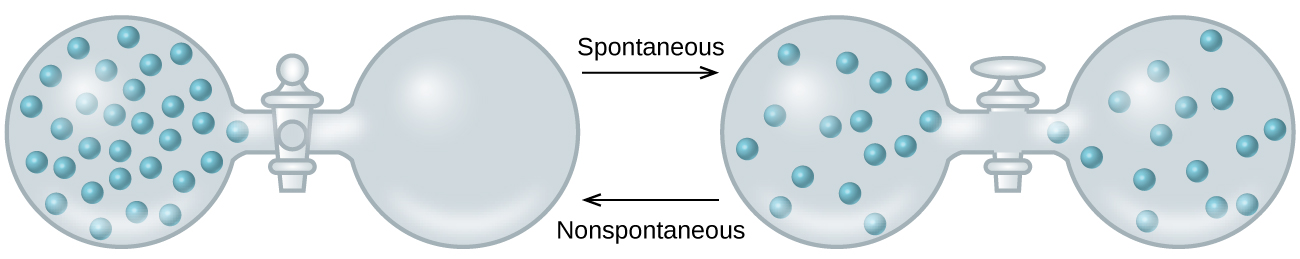
Коли ми розширюємо наше обговорення термодинамічних концепцій до мети прогнозування спонтанності, розглянемо тепер ізольовану систему, що складається з двох колб, з'єднаних із закритим клапаном. Спочатку зліва знаходиться ідеальний газ і розрідження праворуч (рис.\(\PageIndex{3}\)). При відкритті клапана газ мимовільно розширюється, щоб заповнити обидві колби. Згадуючи визначення тиску-об'ємну роботу з глави про термохімію, зверніть увагу, що жодної роботи не проводилося, оскільки тиск у вакуумі дорівнює нулю.
\[ \begin{align} w&=−PΔV \\[4pt]&=0 \,\,\, \mathrm{(P=0\: in\: a\: vaccum)} \label{Eq2} \end{align} \]
Зверніть увагу також, що оскільки система ізольована, тепло не обмінюється з навколишнім середовищем (q = 0). Перший закон термодинаміки підтверджує, що в результаті цього процесу не було змін внутрішньої енергії системи.
\[ \begin{align} ΔU&=q+w \tag{First Law of Thermodynamics} \\[4pt] &=0+0=0 \label{Eq3}\end{align} \]
Тому спонтанність цього процесу не є наслідком будь-якої зміни енергії, яка супроводжує процес. Натомість рух газу, здається, пов'язаний з більшим, більш рівномірним розгоном речовини, що призводить до того, коли газу дозволено розширюватися. Спочатку система складалася з однієї колби, що містить речовину, і іншої колби, що не містить нічого. Після того як відбувся спонтанний процес, матерія розподілялася як ширше (займаючи вдвічі більше початкового обсягу), так і більш рівномірно (присутня в рівних кількостях в кожній колбі).
Тепер розглянемо два об'єкти при різних температурах: об'єкт X при температурі T X і об'єкт Y при температурі T Y, з T X > T Y (рис.\(\PageIndex{4}\)). При зіткненні цих предметів тепло мимовільно перетікає від більш гарячого об'єкта (X) до більш холодного (Y). Це відповідає втраті теплової енергії на Х і посилення теплової енергії на Y.
\[q_\ce{X}<0 \hspace{20px} \ce{and} \hspace{20px} q_\ce{Y}=−q_\ce{X}>0 \label{Eq4} \]
З точки зору цієї двооб'єктної системи не було чистого посилення або втрати теплової енергії, скоріше наявна теплова енергія була перерозподілена між двома об'єктами. Цей спонтанний процес призвів до більш рівномірного розгону енергії.

Як ілюструють два описані процеси, важливим фактором у визначенні спонтанності процесу є ступінь, в якій він змінює розгін або розподіл речовини та/або енергії. У кожному конкретному випадку відбувався спонтанний процес, який приводив до більш рівномірного розподілу речовини або енергії.
Опишіть, як речовина і енергія перерозподіляються, коли відбуваються такі спонтанні процеси:
- А тверді піднесені.
- А газ конденсується.
- Крапля харчового барвника, додана в склянку води, утворює розчин з рівномірним кольором.
Рішення

- Сублімація - це перетворення твердого тіла (відносно високої щільності) в газ (набагато менша щільність). Цей процес дає набагато більший розгін речовини, так як молекули будуть займати набагато більший обсяг після переходу тверде тіло в газ. Однак вхід енергії з оточення s необхідний для того, щоб молекули покинули тверду фазу і увійшли в газову фазу.
- Конденсація - це перетворення газу (відносно низької щільності) в рідину (набагато більша щільність). Цей процес дає набагато менший розгін речовини, так як молекули будуть займати набагато менший обсяг після переходу газ-рідина. Коли молекули газу рухаються разом, утворюючи краплі рідини, вони утворюють міжмолекулярні сили і таким чином виділяють енергію в навколишнє середовище.
- Розглянутий процес - розведення. Молекули харчового барвника спочатку займають набагато менший обсяг (крапля розчину барвника), ніж вони займають після завершення процесу (в повній склянці води). Таким чином, процес тягне за собою більший розгін матерії. Процес також може дати більш рівномірне розсіювання речовини, оскільки початковий стан системи включає дві області різної концентрації барвника (висока в краплі, нуль у воді), а кінцевий стан системи містить одну концентрацію барвника на всьому протязі. Цей процес може відбуватися без зміни енергії, оскільки молекули мають кінетичну енергію щодо температури води, і тому будуть постійно перебувати в русі.
Опишіть, як речовина і енергія перерозподіляються, коли ви спорожняєте каністру стисненого повітря в кімнату.
- Відповідь
-
Цей процес тягне за собою як більший, так і більш рівномірний розгін речовини, оскільки стисненому повітрю в каністрі дозволяється розширюватися в повітря з нижчим тиском приміщення. Процес також вимагає введення енергії, щоб порушити міжмолекулярні сили між тісно розташованими молекулами газу, які спочатку стискаються в контейнер. Якби ви торкнулися сопла каністри, ви помітили б, що вона холодна, тому що виходять молекули забирають енергію від свого оточення, а каністра є частиною оточення.
Резюме
Хімічні і фізичні процеси мають природну тенденцію протікати в одному напрямку при певних умовах. Спонтанний процес відбувається без необхідності постійного надходження енергії з якогось зовнішнього джерела, тоді як неспонтанний процес вимагає такого. Системи, що проходять спонтанний процес, можуть або не можуть відчувати посилення або втрату енергії, але вони відчують зміну способу розподілу матерії та/або енергії всередині системи. У цьому розділі ми обговорювали лише ядерний розпад, фізичні зміни чистих речовин та макроскопічні події, такі як вода, що тече вниз. У наступних розділах ми обговоримо суміші та хімічні реакції, ситуації, в яких опис спонтанності стає більш складним завданням.
Глосарій
- неспонтанний процес
- процес, який вимагає постійного введення енергії від зовнішнього джерела
- спонтанна зміна
- процес, який відбувається без безперервного надходження енергії від зовнішнього джерела
