15.3: Зв'язані рівноваги
- Page ID
- 22676
- Опишіть приклади систем, що включають два (або більше) одночасних хімічних рівноваг
- Розрахуйте концентрації реагентів та продуктів для декількох рівноважних систем
- Порівняйте розчинення і слабке утворення електроліту
Бувають випадки, коли одна реакція рівноваги недостатньо описує досліджувану систему. Іноді у нас відбувається відразу не один тип рівноваги (наприклад, кислотно-лужна реакція і реакція опадів).
Океан є унікальним прикладом системи з множинними рівновагами, або декількома станами рівноваг розчинності, що працюють одночасно. Вуглекислий газ в повітрі розчиняється в морській воді, утворюючи вугільну кислоту (H 2 CO 3). Потім вугільна кислота іонізується, утворюючи іони водню та бікарбонатні іони\(\ce{(HCO3- )}\), які можуть додатково іонізуватися в більшу кількість іонів водню та карбонатних іонів\(\ce{(CO3^2- )}\):
\[\ce{CO2}(g)⇌\ce{CO2}(aq) \nonumber \]
\[\ce{CO2}(aq)+\ce{H2O}⇌\ce{H2CO3}(aq) \nonumber \]
\[\ce{H2CO3}(aq)⇌\ce{H+}(aq)+\ce{HCO3-}(aq) \nonumber \]
\[\ce{HCO3-}(aq)⇌\ce{H+}(aq)+\ce{CO3^2-}(aq) \nonumber \]
Надлишок іонів H + робить морську воду більш кислою. Збільшення підкислення океану може мати негативний вплив на корали, що будують рифи, оскільки вони не можуть поглинати карбонат кальцію, необхідний їм для вирощування та підтримки своїх скелетів (Рисунок\(\PageIndex{1}\)). Це, в свою чергу, порушує місцеву біосистему, яка залежить від здоров'я рифів для її виживання. Якщо аналогічним чином постраждало достатня кількість місцевих рифів, перебої в морському житті можна відчути глобально. Світові океани в даний час перебувають у розпалі періоду інтенсивного підкислення, який, як вважають, розпочався в середині дев'ятнадцятого століття, і який зараз прискорюється зі швидкістю швидше, ніж будь-яка зміна океанічного рН за останні 20 мільйонів років.

Дізнайтеся більше про закислення океану та про те, як воно впливає на інших морських істот.
Малорозчинні тверді речовини, отримані зі слабких кислот, зазвичай розчиняються в сильних кислотах, якщо тільки продукти їх розчинності вкрай малі. Наприклад, ми можемо розчиняти CuCo 3, FeS та Ca 3 (PO 4) 2 в HCl, оскільки їх основні аніони реагують на утворення слабких кислот (H 2 CO 3, H 2 S та\(\ce{H2PO4-}\)). Отримане в результаті зниження концентрації аніону призводить до зсуву рівноважних концентрацій вправо відповідно до принципу Ле Шательє.

Особливе значення для нас має розчинення гідроксилапатиту, Са 5 (РО 4) 3 ОН, в кислоті. Апатити - це клас мінералів фосфату кальцію (рис.\(\PageIndex{2}\)); біологічна форма гідроксилапатиту зустрічається як основний мінерал в емалі наших зубів. Суміш гідроксилапатиту і води (або слини) містить рівноважну суміш твердих Ca 5 (PO 4) 3 ОН і розчинених Ca 2 +\(\ce{PO4^3-}\), а ОН - іонів:
\[\ce{Ca5(PO4)3OH}(s)⟶\ce{5Ca^2+}(aq)+\ce{3PO4^3-}(aq)+\ce{OH-}(aq) \nonumber \]
Під впливом кислоти фосфатні іони реагують з іонами гідронію з утворенням іонів гідрофосфату і, зрештою, фосфорної кислоти:
\[\ce{PO4^3-}(aq)+\ce{H3O+}⇌\ce{H2PO4^2-}+\ce{H2O} \nonumber \]
\[\ce{PO4^2-}(aq)+\ce{H3O+}⇌\ce{H2PO4-}+\ce{H2O} \nonumber \]
\[\ce{H2PO4- + H3O+ ⇌ H3PO4 + H2O} \nonumber \]
Гідроксид-іон реагує на утворення води:
\[\ce{OH-}(aq)+\ce{H3O+}⇌\ce{2H2O} \nonumber \]
Ці реакції зменшують концентрацію фосфатних і гідроксидних іонів, а додатковий гідроксилапатит розчиняється в кислому розчині відповідно до принципу Ле Шательє. Наші зуби розвивають порожнини, коли кислотні відходи, що утворюються бактеріями, що ростуть на них, змушують гідроксилапатит емалі розчинятися. Фторидні зубні пасти містять фторид натрію, NaF або фторид олова [більш правильно названий фторид олова (II)], SnF 2. Вони функціонують шляхом заміни OH - іона в гідроксилапатиті на F — іон, виробляючи фторапатит, Ca 5 (PO 4) 3 F:
\[\ce{NaF + Ca5(PO4)3OH ⇌ Ca5(PO4)3F + Na+ + OH-} \nonumber \]
Отриманий Ca 5 (PO 4) 3 F трохи менш розчинний, ніж Ca 5 (PO 4) 3 OH, а F — є слабшою основою, ніж OH —. Обидва ці фактори роблять фтороапатит більш стійким до впливу кислот, ніж гідроксилапатит. Див. Хімія в повсякденному житті особливість про роль фтору у запобіганні карієсу для отримання додаткової інформації.
Як ми бачили раніше, іони фтору допомагають захистити наші зуби, вступаючи в реакцію з гідроксилапатитом з утворенням фторапатиту, Ca 5 (PO 4) 3 F. Оскільки йому не вистачає гідроксид-іона, фторапатіт більш стійкий до атак кислот у роті і, таким чином, менш розчинний, захищаючи наші зуби. Вчені виявили, що природно фторована вода може бути корисною для ваших зубів, і тому стало звичайною практикою додавання фтору в питну воду. Зубні пасти і засоби для полоскання рота також містять кількість фтору (рис.\(\PageIndex{3}\)).

На жаль, надлишок фтору може звести нанівець його переваги. Природні джерела питної води в різних куточках світу мають різну концентрацію фтору, і місця, де ця концентрація висока, схильні до певних ризиків для здоров'я, коли немає іншого джерела питної води. Найбільш серйозним побічним ефектом надлишку фтору є захворювання кісток, флюороз скелета. Коли надлишок фтору знаходиться в організмі, це може спричинити жорсткість суглобів, а кістки потовщуються. Це може сильно вплинути на рухливість і може негативно вплинути на щитовидну залозу. Скелетний флюороз - це стан, яким страждають понад 2,7 мільйона людей по всьому світу. Таким чином, хоча фтор може захистити наші зуби від карієсу, Агентство з охорони навколишнього середовища США встановлює максимальний рівень 4 ppm (4 мг/л) фтору в питній воді в США. Рівень фтору у воді регулюється не у всіх країнах, тому флюороз є проблемою в районах з високим вмістом фтору в підземних водах.
Коли кислотний дощ атакує вапняк або мармур, які є карбонатами кальцію, відбувається реакція, схожа на кислотну атаку на гідроксилапатит. Іон гідронію з кислотних дощів поєднується з карбонатним іоном з карбонатів кальцію і утворює іон гідрокарбонату, слабку кислоту:
\[\ce{H3O+}(aq)+\ce{CO3^2-}(aq)⟶\ce{HCO3-}(aq)+\ce{H2O}(l) \nonumber \]
Гідрокарбонат кальцію, Ca (HCO 3) 2, розчинний, тому вапнякові та мармурові предмети повільно розчиняються в кислотних дощах.
Якщо карбонат кальцію додати до концентрованої кислоти, іон гідронію реагує з карбонатним іоном відповідно до рівняння:
\[\ce{2H3O+}(aq)+\ce{CO3^2-}(aq)⟶\ce{H2CO3}(aq)+\ce{2H2O}(l) \nonumber \]
(Кислотні дощі зазвичай недостатньо кислі, щоб викликати цю реакцію; однак лабораторні кислоти є.) Розчин може просочитися слабким електролітом вугільною кислотою, яка є нестабільною, і може виділятися вуглекислий газ:
\[\ce{H2CO3}(aq)⟶\ce{CO2}(g)+\ce{H2O}(l) \nonumber \]
Ці реакції знижують концентрацію карбонатних іонів, а додатково розчиняється карбонат кальцію. Якщо присутня достатня кількість кислоти, концентрація карбонатного іона знижується до такого низького рівня, що коефіцієнт реакції на розчинення карбонату кальцію залишається меншим, ніж продукт розчинності карбонату кальцію, навіть після того, як весь карбонат кальцію розчинився.
Розрахуйте концентрацію іона амонію, яка необхідна для запобігання осадження Mg (ОН) 2 в розчині при [Mg 2 +] = 0,10 М і [NH 3] = 0,10 М.
Рішення
У цій системі беруть участь два рівноваги:
- Реакція (1):\(\ce{Mg(OH)2}(s)⇌\ce{Mg^2+}(aq)+\ce{2OH-}(aq); \hspace{20px} K_\ce{sp}=8.9×10^{−12}\)
- Реакція (2):\(\ce{NH3}(aq)+\ce{H2O}(l)⇌\ce{NH4+}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{sp}=1.8×10^{−5}\)
Щоб запобігти утворенню твердого Mg (OH) 2, ми повинні відрегулювати концентрацію OH - так, щоб коефіцієнт реакції для Рівняння (1), Q = [Mg 2 +] [OH -] 2, був меншим, ніж K sp для Mg (OH) 2 . (Для спрощення розрахунку визначаємо концентрацію ОН — коли Q = K sp.) [ОН —] можна зменшити додаванням\(\ce{NH4+}\), що зміщує реакцію (2) вліво і зменшує [ОН —].
- Визначаємо [ОН —] при якому Q = K sp при [Mg 2 +] = 0,10 М:\[Q=\ce{[Mg^2+][OH- ]^2}=(0.10)\ce{[OH- ]^2}=8.9×10^{−12} \nonumber \]
Тверді Mg (OH) 2 не утворюватимуться в цьому розчині, коли [ОН —] менше 9,4 × 10 —6 М.
- Розраховуємо\(\mathit{[NH_4^+]}\) необхідне зменшення [ОН —] до 9,4 × 10 —6 М при [NH 3] = 0,10. \[K_\ce{b}=\ce{\dfrac{[NH4+][OH- ]}{[NH3]}}=\dfrac{\ce{[NH4+]}(9.4×10^{−6})}{0.10}=1.8×10^{−5} \nonumber \]\[\ce{[NH4+]}=0.19\:M \nonumber \]
Коли\(\ce{[NH4+]}\) дорівнює 0,19 М, [ОН —] становитиме 9,4 × 10 —6 М. Будь-який\(\ce{[NH4+]}\) більше 0,19 М зменшить [ОН —] нижче 9,4 × 10 —6 М і запобіжить утворенню Mg (OH) 2.
Розглянемо дві рівноваги:
\[\ce{ZnS}(s)⇌\ce{Zn^2+}(aq)+\ce{S^2-}(aq) \hspace{20px} K_\ce{sp}=1×10^{−27} \nonumber \]
\[\ce{2H2O}(l)+\ce{H2S}(aq)⇌\ce{2H3O+}(aq)+\ce{S^2-}(aq) \hspace{20px} K=1.0×10^{−26} \nonumber \]
і розрахувати концентрацію іона гідронію, необхідну для запобігання осадження ZnS в розчині, який становить 0,050 М в Zn 2 + і насичений H 2 S (0,10 M H 2 S).
- Відповідь
-
\[\ce{[H3O+]}>0.2\:M \nonumber \]
([S 2—] менше 2 × 10 —26 М і осадження ZnS не відбувається.)
Тому точні розрахунки розчинності твердих речовин з продукту розчинності обмежуються випадками, в яких єдиною значущою реакцією, що відбувається при розчиненні твердого тіла, є утворення його іонів.
Неоголені галогеніди срібла видаляються з фотоплівки, коли вони реагують з тіосульфатом натрію (Na 2 S 2 O 3, званий гіпо) з утворенням комплексного іона\(\ce{Ag(S2O3)2^3-}\) (K f = 4,7 × 10 13). Реакція з бромідом срібла буває:
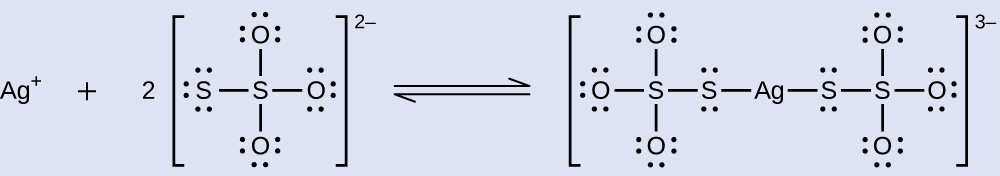
Яку масу Na 2 S 2 O 3 потрібно для приготування 1,00 л розчину, який розчинить 1,00 г AgBr при утворенні\(\ce{Ag(S2O3)2^3-}\)?
S рішення
Дві рівноваги беруть участь, коли AgBr розчиняється в розчині, що містить\(\ce{S2O3^2-}\) іон:
- Реакція (1):\(\ce{AgBr}(s)⇌\ce{Ag+}(aq)+\ce{Br-}(aq) \hspace{20px} K_\ce{sp}=5.0×10^{−13}\)
- Реакція (2):\(\ce{Ag+}(aq)+\ce{S2O3^2-}(aq)⇌\ce{Ag(S2O3)2^3-}(aq) \hspace{20px} K_\ce{f}=4.7×10^{13}\)
Для того, щоб 1,00 г AgBr розчинився, [Ag +] у розчині, що призводить, має бути достатньо низьким, щоб Q для Reaction (1) був меншим за K sp для цієї реакції. Ми зменшуємо [Ag +], додаючи\(\ce{S2O3^2-}\) і таким чином змушуємо Reaction (2) зміщуватися вправо. Нам потрібні наступні кроки, щоб визначити, яка маса Na 2 S 2 O 3 потрібна для забезпечення необхідного\(\ce{S2O3^2-}\).
- Розраховуємо [Br —] отримане повним розчиненням 1,00 г AgBr (5,33 × 10 —3 моль AgBr) в 1,00 л розчину:\[\ce{[Br- ]}=5.33×10^{−3}\:M \nonumber \]
- Ми використовуємо [Br —] і K sp для визначення максимально можливої концентрації Ag +, яка може бути присутнім, не викликаючи повторного осадження AgBr:\[\ce{[Ag+]}=9.4×10^{−11}\:M \nonumber \]
- Визначаємо\(\mathit{[S_2O_3^{2-}]}\) необхідне зробити [Ag +] = 9,4 × 10 —11 М після того, як залишився Ag + іон відреагував з\(\mathit{S_2O_3^{2-}}\) відповідно до рівняння:\[\ce{Ag+ + 2S2O3^2- ⇌ Ag(S2O3)2^3-} \hspace{20px} K_\ce{f}=4.7×10^{13} \nonumber \]
Оскільки 5,33 × 10 —3 моль AgBr розчиняється:
\ [(5.33×10^ {−3}) − (9.4×10^ {−11}) =5.33×10^ {−3}\ ce {\ :моль\ :Ag (S2O3) 2^3-}\\ nonumber]Таким чином, при рівновазі:\(\ce{[Ag(S2O3)2^3- ]}\) = 5,33 × 10 —3 М, [Ag +] = 9,4× 10 —11 М, і Q = K f = 4,7 × 10 13:
\[K_\ce{f}=\ce{\dfrac{[Ag(S2O3)2^3- ]}{[Ag+][S2O3^2- ]^2}}=4.7×10^{13} \nonumber \]\[\ce{[S2O3^2- ]}=1.1×10^{−3}\:M \nonumber \]Коли\(\ce{[S2O3^2- ]}\) 1,1 × 10 —3 М, [Ag +] дорівнює 9,4 × 10 —11 М, і всі AgBr залишаються розчиненими.
- Визначаємо загальну кількість родимок\(\mathit{S_2O_3^{2-}}\), які необхідно додати в розчин. Це дорівнює кількості, яка реагує з Ag + з\(\ce{Ag(S2O3)2^3-}\) утворенням плюс кількість вільного\(\ce{S2O3^2-}\) в розчині при рівновазі. Для формування 5,33 × 10 —3 моль\(\ce{Ag(S2O3)2^3-}\) потрібно 2 × (5,33 × 10 -3) моль\(\ce{S2O3^2-}\). Крім того, присутній 1,1 × 10 —3 моль не\(\ce{S2O3^2-}\) прореагували (Крок 3). Таким чином, загальна сума\(\ce{S2O3^2-}\), яку потрібно додати, становить:\[\mathrm{2×(5.33×10^{−3}mol\:S_2O_3^{2-}) + 1.1×10^{−3}\:mol\:S_2O_3^{2-} = 1.18×10^{−2}\: mol\:S_2O_3^{2-}} \nonumber \]
- Визначаємо масу Na 2 S 2 O 3, необхідну для отримання 1,18 × 10 —2 моль,\(\mathit{S_2O_3^{2-}}\) використовуючи молярну масу Na 2 S 2 O 3:\[\mathrm{1.18×10^{−2}\:mol\:S_2O_3^{2-}×\dfrac{158.1\:g\:Na_2S_2O_3}{1\:mol\:Na_2S_2O_3}=1.9\:g\:Na_2S_2O_3} \nonumber \]
Так, 1,00 л розчину, приготованого з 1,9 г Na 2 S 2 O 3, розчиняє 1,0 г AgBr.
AgCl (s), хлорид срібла, добре відомий тим, що має дуже низьку розчинність:\(\ce{Ag}(s)⇌\ce{Ag+}(aq)+\ce{Cl-}(aq)\), K sp = 1.6 × 10 —10. Додавання аміаку значно підвищує розчинність AgCl через те, що утворюється комплексний іон:\(\ce{Ag+}(aq)+\ce{2NH3}(aq)⇌\ce{Ag(NH3)2+}(aq)\), K f = 1,7 × 10 7. Яку масу NH 3 потрібно для приготування 1,00 л розчину, який розчинить 2,00 г AgCl при утворенні\(\ce{Ag(NH3)2+}\)?
- Відповідь
-
1,00 л розчину, приготованого з 4,81 г NH 3, розчиняє 2,0 г AgCl.
Розчинення проти слабкого утворення електроліту
Ми можемо визначити, як змістити концентрацію іонів в рівновазі між слаборозчинним твердим тілом і розчином його іонів, застосовуючи принцип Ле Шательє. Наприклад, одним із способів контролю концентрації іона марганцю (II), Mn 2 +, в розчині є регулювання рН розчину і, отже, маніпулювання рівновагою між слаборозчинним твердим гідроксидом марганцю (II), іоном марганцю (II) і гідроксид-іоном:
\[\ce{Mn(OH)2}(s) ⇌ \ce{Mn^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mn^2+][OH- ]^2} \nonumber \]
Це може бути важливим для білизни, оскільки одяг, вимитий у воді, яка має концентрацію марганцю, що перевищує 0,1 мг на літр, може бути забарвлений марганцем. Ми можемо зменшити концентрацію марганцю, збільшивши концентрацію гідроксид-іона. Ми могли б додати, наприклад, невелику кількість NaOH або якусь іншу основу, таку як силікати, що містяться в багатьох пральних порошках. Зі збільшенням концентрації ОН-іона рівновага реагує зміщенням вліво і зменшенням концентрації іона Mn 2 + при одночасному збільшенні кількості твердого Mn (OH) 2 в рівноважній суміші, як передбачено принципом Ле Шательє.
Який вплив на кількість твердого Mg (OH) 2, що розчиняється, і концентрації Mg 2 + і OH — коли кожен з наступних додається до суміші твердого Mg (OH) 2 у воді при рівновазі?
- MgCl 2
- КОН
- кислота
- нано 3
- Мг (ОН) 2
Рішення
Рівновага між твердими Mg (OH) 2 і розчином Mg 2 + і OH — становить:
\[\ce{Mg(OH)2}(s) ⇌ \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
(а) Реакція зміщується вліво, щоб зняти стрес, вироблений додатковим іоном Mg 2 +, відповідно до принципу Ле Шательє. У кількісному вираженні доданий Mg 2 + призводить до того, що коефіцієнт реакції буде більшим за продукт розчинності (Q > K sp), а Mg (OH) 2 утворює до тих пір, поки коефіцієнт реакції знову не дорівнює K sp. При новій рівновазі [ОН —] менше і [Mg 2 +] більше, ніж у розчині Mg (OH) 2 в чистій воді. Більш твердий Mg (OH) 2 присутній.
(б) Реакція зміщується вліво, щоб зняти стрес додаткового ОН - іона. Mg (OH) 2 утворює, поки коефіцієнт реакції знову не дорівнює K sp. При новій рівновазі [ОН —] більше і [Mg 2 +] менше, ніж у розчині Mg (OH) 2 в чистій воді. Більш твердий Mg (OH) 2 присутній.
(c) Концентрація OH - знижується, оскільки ОН - реагує з кислотою. Реакція зміщується вправо, щоб зняти стрес менше ОН — іон. У кількісному вираженні зменшення OH - концентрації призводить до того, що коефіцієнт реакції буде меншим за продукт розчинності (Q < K sp), а додатковий Mg (OH) 2 розчиняється до тих пір, поки коефіцієнт реакції знову не дорівнює K сп. При новій рівновазі [ОН —] менше і [Mg 2 +] більше, ніж у розчині Mg (OH) 2 в чистій воді. Більше Mg (OH) 2 розчиняється.
(d) NaNo 3 не містить жодного з видів, що беруть участь у рівновазі, тому слід очікувати, що він не має помітного впливу на концентрації Mg 2 + та OH -. (Як ми бачили раніше, розчинені солі змінюють діяльність іонів електроліту. Однак ефект солі, як правило, невеликий, і ми будемо нехтувати невеликими помилками, які можуть виникнути в результаті цього.)
(е) Додавання твердого Mg (OH) 2 не впливає на розчинність Mg (OH) 2 або на концентрацію Mg 2 + і OH -. Концентрація Mg (OH) 2 не відображається в рівнянні для коефіцієнта реакції:
\[Q=\ce{[Mg^2+][OH- ]^2} \nonumber \]
Таким чином, зміна кількості твердого гідроксиду магнію в суміші не впливає на величину Q, і не потрібно зсуву для відновлення Q до значення постійної рівноваги.
Який вплив впливає на кількість твердого NiCo 3, що розчиняється, і концентрації Ni 2 + і\(\ce{CO3^2-}\) коли кожен з наступних додається до суміші слаборозчинного твердого NiCo 3 і води при рівновазі?
- Ні (НІ 32)
- ККло 4
- Ніко 3
- К 2 СО 3
- HNO 3 (реагує з карбонатом, що дає\(\ce{HCO3-}\) або H 2 O і CO 2)
Відповідь
(а) маса NiCo 3 (s) збільшується, [Ni 2 +] збільшується,\(\ce{[CO3^2- ]}\) зменшується; (б) немає помітного ефекту; (c) ніякого ефекту, крім збільшення кількості твердого NiCo 3; (d) маса NiCo 3 (s) збільшується, [Ni 2 2 +] зменшується,\(\ce{[CO3^2- ]}\) збільшується; (е) маса NiCo 3 (s) зменшується, [Ni 2 +] збільшується,\(\ce{[CO3^2- ]}\) зменшується
Резюме
Кілька систем, з якими ми стикаємося, складаються з декількох рівноваг, систем, де два або більше процесів рівноваги відбуваються одночасно. Деякі поширені приклади включають кислотні дощі, фторування та розчинення вуглекислого газу в морській воді. Дивлячись на ці системи, нам потрібно розглянути кожну рівновагу окремо, а потім об'єднати окремі константи рівноваги в один продукт розчинності або вираження коефіцієнта реакції, використовуючи інструменти з першої глави рівноваги. Також слід враховувати принцип Ле Шательє, оскільки кожна реакція в системі множинних рівноваг буде зміщуватися в бік реагентів або продуктів на основі того, що додається до початкової реакції та того, як вона впливає на кожну наступну реакцію рівноваги.
Глосарій
- множинна рівновага
- система характеризується більш ніж одним станом балансу між слаборозчинним іонним твердим тілом і водним розчином іонів, що працюють одночасно
