15.1: Опади та розчинення
- Page ID
- 22675
- Написати хімічні рівняння та вирази рівноваги, що представляють рівноваги
- Провести розрахунки рівноваги, що включають розчинність, вирази рівноваги та концентрації розчинених речовин
Збереження медичних лабораторних зразків крові, видобуток морської води на магній, рецептура безрецептурних лікарських засобів, таких як молоко магнезії та антациди, а також лікування наявності жорсткої води у водопостачанні вашого будинку - лише деякі з багатьох завдань, які передбачають контроль рівноваги між слаборозчинним іонним твердим тілом і водним розчином його іонів.
У деяких випадках ми хочемо запобігти розчиненню. Карієс, наприклад, виникає, коли гідроксилапатит кальцію, який має формулу Ca 5 (PO 4) 3 (OH), в наших зубах розчиняється. Процес розчинення допомагає, коли бактерії в роті ласують цукрами в наших раціоні, щоб виробляти молочну кислоту, яка реагує з гідроксилапатітом кальцію іонів. Запобігання розчиненню перешкоджає гниттю. З іншого боку, іноді ми хочемо, щоб речовина розчинилася. Ми хочемо, щоб карбонат кальцію в жувальному антациді розчинився, оскільки\(\ce{CO3^2-}\) іони, що утворюються в цьому процесі, допомагають заспокоїти розлад шлунка.
У цьому розділі ми дізнаємося, як ми можемо контролювати розчинення слабо розчинної іонної твердої речовини за допомогою принципу Ле Шательє. Ми також навчимося використовувати константу рівноваги реакції для визначення концентрації іонів, присутніх в розчині.
Постійна розчинність продукту
Хлорид срібла - це те, що відомо як помірно розчинна іонна тверда речовина (рис.\(\PageIndex{1}\)). Нагадаємо з правил розчинності в попередньому розділі, що галогеніди Ag + нормально не розчинні. Однак, коли ми додаємо надлишок твердого AgCl у воду, вона розчиняється в невеликій мірі і утворює суміш, що складається з дуже розведеного розчину Ag + і Cl — іонів в рівновазі з нерозчиненим хлоридом срібла:
\[\ce{AgCl}(s)\mathrm{\xrightleftharpoons[\:precipitation\:]{\:dissolution\:}}\ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
Ця рівновага, як і інші рівноваги, є динамічним; частина твердого тіла AgCl продовжує розчинятися, але в той же час Ag + і Cl — іони в розчині об'єднуються, утворюючи рівну кількість твердого тіла. При рівновазі протилежні процеси мають рівні темпи.
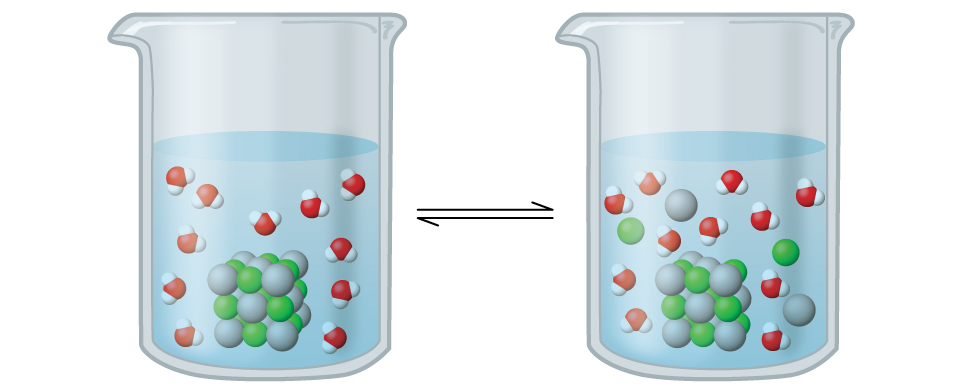
Константа рівноваги для рівноваги між слаборозчинним іонним твердим тілом і розчином його іонів називається продуктом розчинності (K sp) твердого тіла. Нагадаємо з глави про розчини і колоїди, що ми використовуємо концентрацію іона як наближення його активності в розведеному розчині. Для хлориду срібла, при рівновазі:
\[\ce{AgCl}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{Cl-}(aq) \nonumber \]
із
\[K_\ce{sp}=[\ce{Ag+}(aq)][\ce{Cl-}(aq)] \nonumber \]
При розгляді таких реакцій розчинення, як ця, тверда речовина перераховується як реагент, тоді як іони перераховані як продукти. Константа продукту розчинності, як і при кожному рівноважному постійному вираженні, записується як добуток концентрацій кожного з іонів, піднятих до потужності їх стехіометричних коефіцієнтів. Тут константа розчинності продукту дорівнює Ag + і Cl — коли розчин хлориду срібла знаходиться в рівновазі з нерозчиненим AgCl. У цьому вираженні рівноваги немає знаменника, що представляє реагенти, оскільки реагент є чистим твердим тілом; тому [AgCl] не відображається у виразі для K sp.
| Речовина | К сп при 25° С |
|---|---|
| CuCl | 1,2 × 10 -6 |
| Кубр | 6,27 × 10 -9 |
| GAI | 1,5 × 10 —16 |
| ПБс | 7 × 10 —29 |
| Аль (ОН) 3 | 2 × 10 —32 |
| Фе (ОН) 3 | 4 × 10 —38 |
Деякі загальні продукти розчинності перераховані в таблиці\(\PageIndex{1}\) відповідно до їх значень K sp, тоді як більш широка компіляція продуктів відображається в таблиці E3. Кожна з цих констант рівноваги набагато менше 1, оскільки перераховані сполуки лише слабо розчинні. Невеликий K sp являє собою систему, в якій рівновага лежить ліворуч, так що відносно мало гідратованих іонів було б присутнє в насиченому розчині.
Напишіть іонне рівняння для розчинення та вираження продукту розчинності для кожного з наступних слаборозчинних іонних сполук:
- AGI, йодид срібла, тверда речовина з антисептичними властивостями
- CaCo 3, карбонат кальцію, активний інгредієнт у багатьох безрецептурних жувальних антацидів
- Mg (OH) 2, гідроксид магнію, діюча речовина в молоці магнезії
- Mg (NH 4) PO 4, фосфат амонію магнію, по суті нерозчинна речовина, що використовується в тестах на магній
- Ca 5 (PO 4) 3 OH, мінеральний апатит, джерело фосфорів для добрив
(Підказка: При визначенні способу розбивання (d) і (e) на іони зверніться до переліку багатоатомних іонів в розділі про хімічну номенклатуру.)
Рішення
- \(\ce{AgI}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{I-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ag+][I- ]}\)
- \(\ce{CaCO3}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{CO3^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ca^2+][CO3^2- ]}\)
- \(\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mg^2+][OH- ]^2}\)
- \(\ce{Mg(NH4)PO4}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{NH4+}(aq)+\ce{PO4^3-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Mg^2+][NH4+][PO4^3- ]}\)
- \(\ce{Ca5(PO4)3OH}(s) \rightleftharpoons \ce{5Ca^2+}(aq)+\ce{3PO4^3-}(aq)+\ce{OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ca^2+]^5[PO4^3- ]^3[OH- ]}\)
Напишіть іонне рівняння для розчинення і продукту розчинності для кожного з наступних слаборозчинних сполук:
- Басо 4
- 2 ст. СО 4
- Аль (ОН) 3
- Пб (ОН) Cl
- Відповідь на
-
\(\ce{BaSO4}(s) \rightleftharpoons \ce{Ba^2+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ba^2+][SO4^2- ]}\)
- Відповідь б
-
\(\ce{Ag2SO4}(s) \rightleftharpoons \ce{2Ag+}(aq)+\ce{SO4^2-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Ag+]^2[SO4^2- ]}\)
- Відповідь c
-
\(\ce{Al(OH)3}(s) \rightleftharpoons \ce{Al^2+}(aq)+\ce{3OH-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Al^3+][OH- ]^3}\)
- Відповідь d
-
\(\ce{Pb(OH)Cl}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{OH-}(aq)+\ce{Cl-}(aq) \hspace{20px} K_\ce{sp}=\ce{[Pb^2+][OH- ][Cl- ]}\)
Зараз ми продовжимо обговорення K sp і покажемо, як визначається постійна продукту розчинності з розчинності його іонів, а також як K sp можна використовувати для визначення молярної розчинності речовини.
K sp і розчинність
Нагадаємо, що визначення розчинності - це максимально можлива концентрація розчиненої речовини в розчині при заданій температурі і тиску. Ми можемо визначити продукт розчинності слаборозчинної твердої речовини з тієї міри його розчинності при заданій температурі і тиску, за умови, що єдиною значущою реакцією, яка виникає при розчиненні твердої речовини, є його дисоціація на сольватіониіони, тобто єдиною рівновагою, що бере участь, є:
\[\ce{M}_p\ce{X}_q(s) \rightleftharpoons p\mathrm{M^{m+}}(aq)+q\mathrm{X^{n−}}(aq) \nonumber \]
У цьому випадку ми розраховуємо продукт розчинності, взявши розчинність твердої речовини, виражену в одиницях молів на літр (моль/л), відому як його молярна розчинність.
Ми почали главу з неформального обговорення того, як утворюється мінерал флюорит. Флюорит, CaF 2, являє собою слаборозчинну тверду речовину, яка розчиняється відповідно до рівняння:
\[\ce{CaF2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2F-}(aq) \nonumber \]
Концентрація Са 2+ в насиченому розчині CaF 2 становить 2,1 × 10 —4 М; отже, концентрація F — 4,2 × 10 —4 М, тобто вдвічі більша концентрація Са 2 +. Що таке продукт розчинності флюориту?
Рішення
Спочатку випишіть вираз K sp, потім підставляйте в концентраціях і вирішіть для K sp:
\[\ce{CaF2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2F-}(aq) \nonumber \]
Насичений розчин - це розчин, що знаходиться в рівновазі з твердим тілом. Таким чином:
\[\begin{align*} K_\ce{sp} &=\ce{[Ca^2+][F^{-}]^2} \\[4pt] &=(2.1×10^{−4})(4.2×10^{−4})^2 \\[4pt] &=3.7×10^{−11} \end{align*} \nonumber \]
Як і в інших константах рівноваги, ми не включаємо одиниці з K sp.
У насиченому розчині, що контактує з твердим Mg (OH) 2, концентрація Mg 2 + становить 3,7 × 10 -5 М. Що таке розчинність продукту для Mg (OH) 2?
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
- Відповідь
-
2,0 × 10 —13
K sp броміду міді (I), CuBr, становить 6,3 × 10 -9. Обчисліть молярну розчинність броміду міді.
Рішення
Константа продукту розчинності броміду міді (I) становить\(6.3 \times 10^{–9}\).
Реакція така:
\[\ce{CuBr}(s) \rightleftharpoons \ce{Cu+}(aq)+\ce{Br-}(aq) \nonumber \]
Спочатку випишіть постійний вираз рівноваги продукту розчинності:
\[K_\ce{sp}=\ce{[Cu+][Br- ]} \nonumber \]
Створіть таблицю ICE (як введено в розділі про основні концепції рівноваги), залишивши стовпець CubR порожнім, оскільки він є твердим тілом і не сприяє K sp:
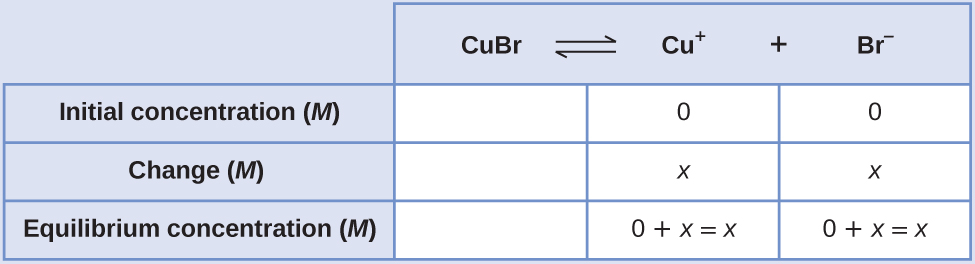
При рівновазі:
\[\begin{align*} K_{sp} &=\ce{[Cu+][Br- ]} \\[4pt] 6.3×10^{−9} &=(x)(x)=x^2 \\[4pt] x &=\sqrt{(6.3×10^{−9})}=7.9×10^{−5} \end{align*} \nonumber \]Тому молярна розчинність CuBR становить 7,9 × 10 —5 М.
K sp Агі дорівнює 1,5 × 10 —16. Обчисліть молярну розчинність йодиду срібла.
- Відповідь
-
1,2 × 10 -8 М
Визначення молярної розчинності з K sp, частина II K sp гідроксиду кальцію, Ca (OH) 2, становить 8,0 × 10 —6. Обчисліть молярну розчинність гідроксиду кальцію.
Рішення
Константа продукту розчинності гідроксиду кальцію становить 1,3 × 10 -6.
Реакція така:
\[\ce{Ca(OH)2}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
Спочатку випишіть постійний вираз рівноваги продукту розчинності:
\[K_\ce{sp}=\ce{[Ca^2+][OH- ]^2} \nonumber \]
Створіть таблицю ICE, залишивши стовпець Ca (OH) 2 порожнім, оскільки він є твердим і не сприяє K sp:
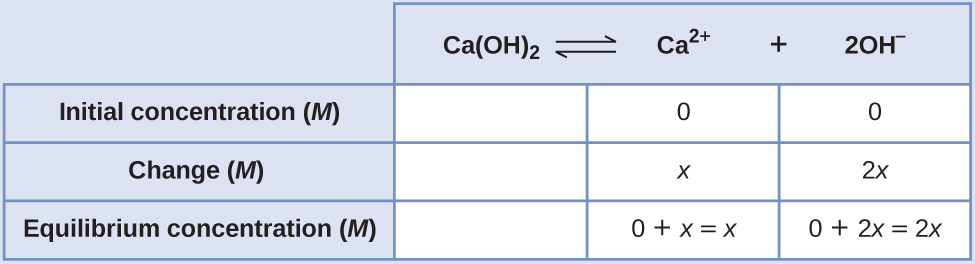
При рівновазі:
\[ \begin{align*} K_\ce{sp} &=\ce{[Ca^2+][OH- ]^2} \\[4pt] 1.3×10^{−6} &=(x)(2x)^2=(x)(4x^2)=4x^3 \\[4pt] x &=\sqrt[3]{\dfrac{1.3×10^{-6}}{4}}=6.9×10^{-3} \end{align*} \nonumber \]
Тому молярна розчинність Са (ОН) 2 становить 6,9 × 10 —3 М.
К сп pBi 2 дорівнює 1,4 × 10 —8. Обчисліть молярну розчинність йодиду свинцю (II).
- Відповідь
-
1,5 × 10 —3 М
Зверніть увагу, що розчинність не завжди задається як молярне значення. Коли розчинність сполуки дається в деякій одиниці, відмінній від молів на літр, ми повинні перетворити розчинність в молі на літр (тобто молярність), щоб використовувати його в постійному вираженні продукту розчинності. Приклад\(\PageIndex{5}\) показує, як виконати ці одиничні перетворення перед визначенням рівноваги продукту розчинності.
Багато з пігментів, що використовуються художниками в фарбах на масляній основі (рис.\(\PageIndex{2}\)), помірно розчиняються у воді. Наприклад, розчинність пігменту художника хромо-жовтого кольору, PbCrO 4, становить 4,6 × 10 —6 г/л. визначають константу рівноваги продукту розчинності для PbCrO 4.

Рішення
Нам дано розчинність PbCRo 4 в грамах на літр. Якщо перетворити цю розчинність в молі на літр, то можна знайти рівноважні концентрації Pb 2 + і\(\ce{CrO4^2-}\), то K sp:
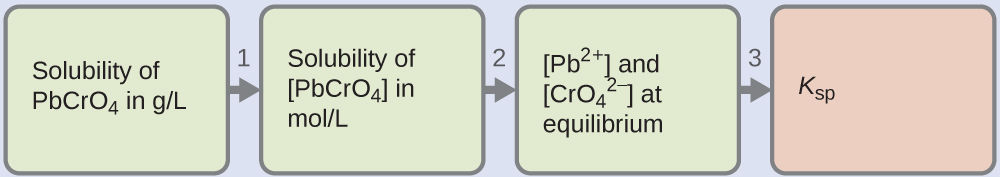
- Використовуйте молярну масу PbCrO 4\(\mathrm{\left(\dfrac{323.2\:g}{1\:mol}\right)}\) для перетворення розчинності PbCrO 4 в грамах на літр в молі на літр:
\(\mathrm{[PbCrO_4]=\dfrac{4.6×10^{−6}\:g\: PbCrO_4}{1\:L}×\dfrac{1\:mol\: PbCrO_4}{323.2\:g\: PbCrO_4}}\)
\(\mathrm{=\dfrac{1.4×10^{−8}\:mol\: PbCrO_4}{1\:L}}\)
\(=1.4×10^{−8}\:M\)
- Хімічне рівняння розчинення вказує на те, що 1 моль PbCrO 4 дає 1 моль Pb 2 + (aq) і 1 моль\(\ce{CrO_4^{2-}}(aq)\):
\(\ce{PbCrO4}(s) \rightleftharpoons \ce{Pb^2+}(aq)+\ce{CrO4^2-}(aq)\)
Таким чином, обидва [Pb 2 +] і\(\ce{[CrO4^2- ]}\) рівні молярної розчинності PbCrO 4:
\(\ce{[Pb^2+]}=\ce{[CrO4^2- ]}=1.4×10^{−8}\:M\) - Вирішити. К сп = [Пб 2 +]\(\ce{[CrO4^2- ]}\) = (1,4 × 10 —8) (1,4 × 10 —8) = 2,0 × 10 —16
Розчинність TlCl [хлориду талію (I)], проміжного продукту, що утворюється при виділенні талію з руд, становить 3,46 грама на літр при 20° C. який його продукт розчинності?
- Відповідь
-
2,08 × 10 -4
Calomel, Hg 2 Cl 2, являє собою сполуку, що складається з двоатомного іона ртуті (I)\(\ce{Hg2^2+}\), і хлоридних іонів, Cl -. Хоча зараз відомо, що більшість сполук ртуті отруйні, лікарі вісімнадцятого століття використовували каломель як ліки. Їхні пацієнти рідко страждали від отруєння ртуттю від лікування, оскільки каломель досить нерозчинний:
\[\ce{Hg2Cl2}(s) \rightleftharpoons \ce{Hg2^2+}(aq)+\ce{2Cl-}(aq) \hspace{20px} K_\ce{sp}=1.1×10^{−18} \nonumber \]
Обчисліть молярну розчинність Hg 2 Cl 2.
Рішення
Молярна розчинність Hg 2 Cl 2 дорівнює концентрації\(\ce{Hg2^2+}\) іонів, тому що на кожну 1 моль Hg 2 Cl 2, яка розчиняється, 1 моль\(\ce{Hg2^2+}\) утворює:
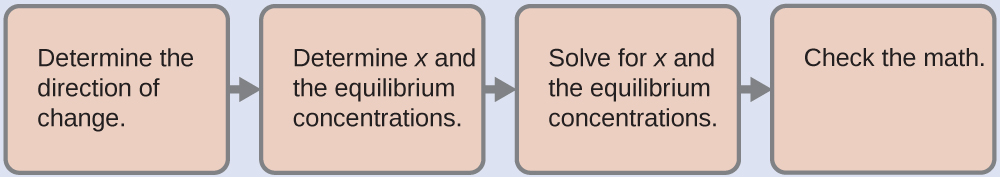
- Визначте напрямок змін. Перш ніж будь-який Hg 2 Cl 2 розчиниться, Q дорівнює нулю, і реакція зміститься вправо, щоб досягти рівноваги.
- Визначте х і рівноважні концентрації. Концентрації та зміни наведені в наступній таблиці ДВС:
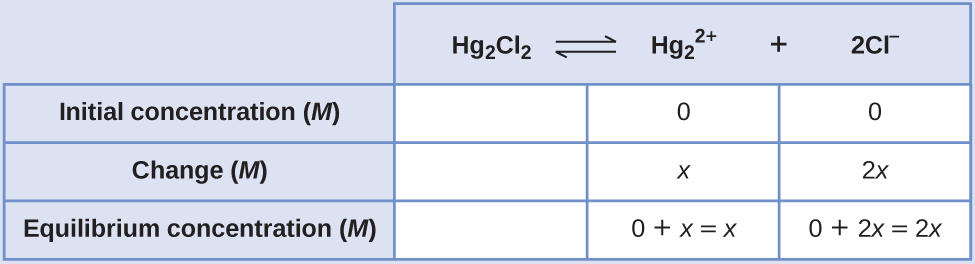
Зверніть увагу, що зміна концентрації Cl - (2 x) вдвічі більша за зміну концентрації\(\ce{Hg2^2+}\) (х), оскільки 2 моль Cl - утворюється для кожної 1 моль\(\ce{Hg2^2+}\) цієї форми. Hg 2 Cl 2 є чистим твердим тілом, тому в розрахунку воно не фігурує.
- Вирішити для x і рівноважних концентрацій. Підставимо рівноважні концентрації в вираз для K sp і обчислимо значення x:
\[\begin{align*} K_\ce{sp} &=\ce{[Hg2^2+][Cl- ]^2} \\[4pt] 1.1×10^{−18} &=(x)(2x)^2 \\[4pt] 4x^3 &=1.1×10^{−18} \\[4pt] x &=\sqrt[3]{\left(\dfrac{1.1×10^{-18}}{4}\right)}=6.5×10^{-7}\:M \end{align*} \nonumber \]
Отже, концентрації
\[\begin{align*} \ce{[Hg2^2+]} &=6.5×10^{−7}\:M=6.5×10^{−7}\:M \\[4pt] \ce{[Cl- ]} &=2x=2(6.5×10^{−7})=1.3×10^{−6}\:M \end{align*} \nonumber \]
Молярна розчинність Hg 2 Cl 2 дорівнює\(\ce{[Hg2^2+]}\), або 6,5 × 10 -7 М.
Перевірте роботу.
При рівновазі Q = K sp:
\[Q=\ce{[Hg2^2+][Cl- ]^2}=(6.5×10^{−7})(1.3×10^{−6})^2=1.1×10^{−18} \nonumber \]
Перевіряємо розрахунки.
Визначте молярну розчинність MgF 2 з продукту його розчинності: K sp = 6,4 × 10 -9.
- Відповідь
-
1,2 × 10 —3 М
Табличні значення K sp також можна порівняти з коефіцієнтами реакції, обчисленими за експериментальними даними, щоб визначити, чи буде тверда речовина осаджуватися в реакції за певних умов: Q дорівнює K sp при рівновазі; якщо Q менше K sp, тверда речовина буде розчинятися, поки Q не дорівнює K sp; якщо Q більше, ніж K sp, опади будуть відбуватися при заданій температурі, поки Q не дорівнює K sp.
Різні види медичних методів візуалізації використовуються для допомоги діагнозу захворювань в неінвазивний спосіб. Одна з таких методик використовує потрапляння сполуки барію перед тим, як зробити рентгенівське зображення. Хворий потрапляє в організм суспензія сульфату барію, крейдяний порошок. Оскільки K sp сульфату барію становить 1,1 × 10 —10, дуже мало його розчиняється, оскільки покриває слизову оболонку кишкового тракту пацієнта. Потім ділянки травного тракту, покриті барієм, з'являються на рентгенівському знімку як білі, що дозволяє отримати більшу візуальну деталізацію, ніж традиційний рентген (рис.\(\PageIndex{3}\)).
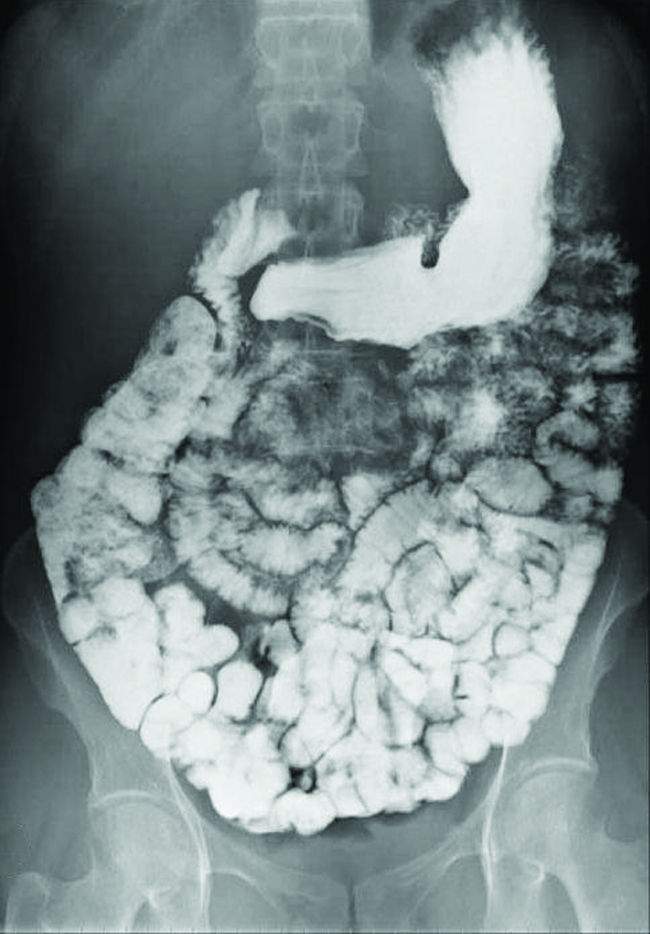
Подальше діагностичне тестування можна провести за допомогою сульфату барію та рентгеноскопії. При рентгеноскопії безперервний рентген проходить через тіло, щоб лікар міг контролювати на екрані телевізора або комп'ютера рух сульфату барію, коли він проходить через травний тракт. Медична візуалізація з використанням сульфату барію може бути використана для діагностики кислотної рефлюксної хвороби, хвороби Крона та виразки на додаток до інших станів.
Прогнозування опадів
Рівняння, що описує рівновагу між твердим карбонатом кальцію і його сольватированими іонами, таке:
\[\ce{CaCO3}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{CO3^2-}(aq) \nonumber \]
Ми можемо встановити цю рівновагу або додаючи до води твердий карбонат кальцію, або змішавши розчин, що містить іони кальцію, з розчином, який містить іони карбонату. Якщо додати в воду карбонат кальцію, тверде речовина буде розчинятися до тих пір, поки концентрації не будуть такими, що значення коефіцієнта реакції\(\ce{(Q=[Ca^2+][CO3^2- ])}\) дорівнює продукту розчинності (K sp = 4,8 × 10 -9). Якщо змішати розчин нітрату кальцію, який містить іони Са 2 +, з розчином карбонату натрію, який містить\(\ce{CO3^2-}\) іони, то малорозчинний іонний твердий CaCo 3 випаде в осад, за умови, що концентрації Са 2 + і \(\ce{CO3^2-}\)іони такі, що Q більше, ніж K sp для суміші. Реакція зсувається вліво і концентрації іонів зменшуються утворенням твердого тіла до тих пір, поки значення Q не дорівнює K sp. Насичений розчин в рівновазі з нерозчиненим твердим речовиною призведе. Якщо концентрації такі, що Q менше K sp, то розчин не насичується і осад не утворюється.
Ми можемо порівняти числові значення Q з K sp, щоб передбачити, чи відбуватимуться опади, як\(\PageIndex{7}\) показує приклад. (Примітка: Оскільки всі форми констант рівноваги залежать від температури, ми будемо вважати, що середовище кімнатної температури йде вперед у цьому розділі, якщо не вказано інше значення температури.)
Першим кроком в отриманні магнієвого металу є осадження Mg (OH) 2 з морської води додаванням вапна, Са (ОН) 2, легкодоступного недорогого джерела ОН — іона:
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=8.9×10^{−12} \nonumber \]
Концентрація Mg 2 + (aq) в морській воді становить 0,0537 М. Чи буде Mg (OH) 2 осад, коли буде додано достатньо Ca (OH) 2, щоб дати [ОН -] 0,0010 М?
Рішення
Ця проблема запитує, чи є реакція:
\[\ce{Mg(OH)2}(s) \rightleftharpoons \ce{Mg^2+}(aq)+\ce{2OH-}(aq) \nonumber \]
зсувається вліво і утворює твердий Mg (OH) 2 при [Mg 2 +] = 0,0537 М і [ОН —] = 0,0010 М. Реакція зміщується вліво, якщо Q більше K sp. Розрахунок коефіцієнта реакції за цих умов наведено тут:
\[\mathrm{Q=[Mg^{2+}][OH^-]^2=(0.0537)(0.0010)^2=5.4×10^{−8}} \nonumber \]
Оскільки Q більше, ніж K sp (Q = 5.4 × 10 —8 більше, ніж K sp = 8.9 × 10 —12), ми можемо очікувати, що реакція зміститься вліво і утворює твердий гідроксид магнію. Mg (OH) 2 (s) утворюється до тих пір, поки концентрації іона магнію і гідроксид-іона не будуть знижені в достатній мірі, щоб значення Q дорівнювало K sp.
Використовуйте продукти розчинності в таблиці Е3, щоб визначити, чи буде CaHPO 4 осад з розчину з [Са 2 +] = 0,0001 М і\(\ce{[HPO4^2- ]}\) = 0,001 М.
- Відповідь
-
Без опадів CaHPO 4; Q = 1 × 10 —7, що менше, ніж K сп
Чи випадає хлорид срібла в осад при змішуванні рівних обсягів 2,0 × 10 -4 - М розчину AgNO 3 і 2,0 × 10 -4 - М розчину NaCl?
(Примітка: Розчин також містить Na + та\(\ce{NO3-}\) іони, але, посилаючись на правила розчинності, можна побачити, що нітрат натрію дуже розчинний і не може утворювати осад.)
Рішення
Рівняння рівноваги між твердим хлоридом срібла, іоном срібла та хлоридним іоном є:
Продукт розчинності становить 1,8 × 10 —10 (табл. Е3).
AgCl випаде в осад, якщо коефіцієнт реакції, розрахований з концентрацій в суміші AgNO 3 і NaCl, більше, ніж K sp. Обсяг подвоюється при змішуванні рівних обсягів розчинів AgNO 3 і NaCl, тому кожна концентрація зменшується до половини своєї початкової величини. Отже, відразу після змішування [Ag +] і [Cl —] обидва рівні:
Коефіцієнт реакції, Q, на мить більший, ніж K sp для AgCl, тому утворюється перенасичений розчин:
Оскільки пересичені розчини нестійкі, AgCl буде осаджуватися з суміші до тих пір, поки розчин не повернеться до рівноваги, причому Q дорівнює K sp.
Чи випаде KClO 4 в осад при додаванні 20 мл 0,050- М розчину К + до 80 мл 0,50- М розчину\(\ce{ClO4-}\)? (Не забудьте обчислити нову концентрацію кожного іона після змішування розчинів перед включенням в експресію коефіцієнта реакції.)
- Відповідь
-
Ні, Q = 4,0 × 10 —3, що менше K сп = 1,07 × 10 —2
У попередніх двох прикладах ми бачили, що Mg (OH) 2 або AgCl випадають в осад, коли Q більше, ніж K sp. Загалом, при змішуванні розчину розчинної солі іона M m+ з розчином розчинної солі іона X n— тверда речовина M p X q випадає в осад, якщо значення Q для суміші M m+ і X n— більше, ніж K sp для M р X q. Таким чином, якщо ми знаємо концентрацію одного з іонів слаборозчинного іонного твердого тіла і значення продукту розчинності твердого тіла, то ми можемо обчислити концентрацію, яку повинен перевищити інший іон для початку осадження. Для спрощення розрахунку будемо вважати, що осадження починається тоді, коли коефіцієнт реакції стає рівним постійній продукту розчинності.
Кров не згорнеться, якщо з її плазми видалити іони кальцію. Деякі пробірки для збору крові містять солі оксалат-іона\(\ce{C2O4^2-}\), для цього (рис.\(\PageIndex{4}\)). При досить високих концентраціях іони кальцію і оксалату утворюють твердий, CaC 2 O 4 •H 2 O (який також містить воду, пов'язану в твердому тілі). Концентрація Са 2+ в зразку сироватки крові становить 2,2 × 10 —3 М. Яку концентрацію\(\ce{C2O4^2-}\) іона необхідно встановити до того, як CaC 2 O 4 •H 2 O почне осаджуватися?
Рішення
Вираз рівноваги таке:
\[\ce{CaC2O4}(s) \rightleftharpoons \ce{Ca^2+}(aq)+\ce{C2O4^2-}(aq) \nonumber \]
Для цієї реакції (табл. Е3):
\[K_\ce{sp}=\ce{[Ca^2+][C2O4^2- ]}=1.96×10^{−8} \nonumber \]
CaC 2 O 4 не відображається в цьому виразі, оскільки він є твердим тілом. Вода не з'являється, оскільки вона є розчинником.
Твердий CaC 2 O 4 не починає утворюватися до тих пір, поки Q не дорівнює K sp. Оскільки ми знаємо K sp і [Ca 2 +], ми можемо вирішити для концентрації\(\ce{C2O4^2-}\), яка необхідна для отримання першого сліду твердого тіла:
Концентрація\(\ce{[C2O4^2- ]}\) = 8,9 × 10 -6 М необхідна для ініціювання осадження СаС 2 О 4 в цих умовах.
Якщо розчин містить 0,0020 моль\(\ce{CrO4^2-}\) на літр, яку концентрацію іона Ag + необхідно досягти, додаючи твердий AgNO 3 до того, як Ag 2 CrO 4 почне осаджуватися? Нехтуйте будь-яким збільшенням обсягу при додаванні твердого нітрату срібла.
- Відповідь
-
4,5 × 10 —9 М
Іноді корисно знати концентрацію іона, який залишається в розчині після осадження. Ми також можемо використовувати продукт розчинності для цього розрахунку: Якщо ми знаємо значення K sp і концентрацію одного іона в розчині, ми можемо обчислити концентрацію другого іона, що залишився в розчині. Розрахунок такого ж типу, що і в прикладі\(\PageIndex{8}\) —розрахунок концентрації виду в рівноважній суміші від концентрацій інших видів та постійної рівноваги. Однак концентрації різні; ми розраховуємо концентрації після завершення опадів, а не на початку опадів.
Одяг, вимитий у воді, що має концентрацію марганцю [Mn 2 + (aq)], що перевищує 0,1 мг/л (1,8 × 10 —6 М), може бути забарвлений марганцем при окисленні, але кількість Mn 2 + у воді може бути зменшена шляхом додавання база. Якщо людина, яка займається білизною, хоче додати буфер, щоб зберегти рН достатньо високим, щоб осаджувати марганець як гідроксид, Mn (OH) 2, який рН потрібно, щоб зберегти [Mn 2 +] рівним 1,8 × 10 —6 М?
Рішення
Розчинення Mn (OH) 2 описується рівнянням:
\[\ce{Mn(OH)2}(s) \rightleftharpoons \ce{Mn^2+}(aq)+\ce{2OH-}(aq) \hspace{20px} K_\ce{sp}=2×10^{−13} \nonumber \]
Потрібно розрахувати концентрацію ОН — коли концентрація Mn 2 + становить 1,8 × 10 —6 М. З цього обчислюємо рН. При рівновазі:
або
\[ (1.8×10^{−6})\ce{[OH- ]^2}=2×10^{−13} \nonumber \]
тому
Тепер обчислюємо рН від pH:
Якщо людина, яка виконує прання, додає основу, наприклад силікат натрію (Na 4 SiO 4) в деяких миючих засобах, до води для прання, поки рН не підвищиться до 10,52, іон марганцю зменшиться до концентрації 1,8 × 10 —6 М; при цій концентрації або менше іон не забруднить одяг.
Першим кроком в отриманні магнієвого металу є осадження Mg (OH) 2 з морської води додаванням Са (ОН) 2. Концентрація Mg 2 + (aq) в морській воді становить 5,37 × 10 —2 М. Обчисліть рН, при якому [Mg 2 +] зменшується до 1,0 × 10 —5 М шляхом додавання Са (ОН) 2.
- Відповідь
-
10.97
Завдяки своїй світлочутливості суміші галогенідів срібла використовуються у волоконній оптиці для медичних лазерів, у фотохромних лінзах для окулярів (скляних лінз, які автоматично темніють під впливом сонячного світла) та - до появи цифрової фотографії - у фотоплівці. Незважаючи на те, що AgCl (K sp = 1.6 × 10 —10), AgBr (K sp = 5.0 × 10 —13) та AgI (K sp = 1,5 × 10 —16) є досить нерозчинними, ми не можемо приготувати однорідну тверду суміш з них, додавши Ag + до розчину Cl -, Br - і I -; по суті, всі AgI випадуть в осад перед тим, як будь-який з інших твердих галогенідів утворюється через його меншу величину для K sp. Однак ми можемо приготувати однорідну суміш сухих речовин, повільно додаючи розчин Cl —, Br — і I — до розчину Ag +.
Коли два аніони утворюють слаборозчинні сполуки з однаковим катіоном, або коли два катіони утворюють слаборозчинні сполуки з тим же аніоном, менш розчинна сполука (як правило, з'єднання з меншим K sp) зазвичай випадає в осад спочатку, коли ми додаємо осаджуючий агент до розчин, що містить обидва аніони (або обидва катіона). Коли значення K sp двох сполук відрізняються на два порядки або більше (наприклад, 10 —2 проти 10 —4), майже вся менш розчинна сполука випадає в осад раніше, ніж будь-яка з більш розчинних. Це приклад селективного осадження, де в розчин розчинених іонів додається реагент, в результаті чого один з іонів випадає в осад раніше інших.
Роль опадів у очищенні стічних вод
Рівноваги розчинності є корисними інструментами при очищенні стічних вод, що проводяться на об'єктах, які можуть обробляти муніципальну воду у вашому місті або місті (рис.\(\PageIndex{5}\)). Зокрема, селективні опади використовуються для видалення забруднень зі стічних вод перед їх викидом назад у природні водойми. Наприклад,\(\ce{(PO4^2- )}\) фосфатні іони часто присутні у воді, що скидається з виробничих потужностей. Велика кількість фосфатів призводить до зростання надлишкових водоростей, що впливає на кількість кисню, доступного для морських мешканців, а також робить воду непридатною для споживання людиною.

Одним із поширених способів видалення фосфатів з води є додавання гідроксиду кальцію, відомого як вапно, Ca (OH) 2. Вапно перетворюється в карбонат кальцію, міцну основу, у воді. Оскільки вода стає більш основною, іони кальцію реагують з фосфатними іонами з утворенням гідроксилапатиту, Ca 5 (PO4) 3 (OH), який потім випадає з розчину:
\[\ce{5Ca^2+ + 3PO4^3- + OH- \rightleftharpoons Ca10(PO4)6⋅(OH)2}(s) \nonumber \]
Потім осад видаляється фільтрацією і вода повертається до нейтрального рН шляхом додавання СО 2 в процесі рекарбонації. Інші хімічні речовини також можуть бути використані для видалення фосфатів шляхом осадження, включаючи хлорид заліза (III) і сульфат алюмінію.
Селективні опади також можуть бути використані в якісному аналізі. При цьому методі до невідомої хімічної суміші додають реагенти з метою викликати осадження. Деякі реагенти викликають осад специфічних іонів; тому додавання реагенту може бути використано для визначення того, чи присутній іон в розчині.
Розчин містить 0,0010 моль КІ і 0,10 моль ККл на літр. У цей розчин поступово додають AgNO 3. Що утворює перший, твердий AgI або твердий AgCl?
Рішення
Два рівноваги беруть участь:
Якби розчин містив приблизно однакові концентрації Cl - і I -, то спочатку випала б сіль срібла з найменшим K sp (AgI). Однак концентрації не рівні, тому ми повинні знайти [Ag +], при якому AgCl починає осаджуватися, і [Ag +], при якому AgI починає осаджуватися. Сіль, яка утворюється в нижній [Ag +], випадає в осад першою.
Для AgI: AgI випадає в осад, коли Q дорівнює K sp для AgI (1,5 × 10 —16). Коли [I —] = 0,0010 М:
AGI починає випадати в осад, коли [Ag +] становить 1,5 × 10 —13 М.
Для AgCl: AgCl випадає в осад, коли Q дорівнює K sp для AgCl (1,6 × 10 —10). Коли [Cl —] = 0,10 М:
AgCl починає випадати в осад, коли [Ag +] становить 1,6 × 10 —9 М.
AgI починає осаджуватися при більш низькому [Ag +], ніж AgCl, тому AgI починає осаджуватися першим.
Якщо розчин нітрату срібла додати до розчину, який становить 0,050 М як в іоні Cl - так і Br, при чому [Ag +] почнеться осадження, і якою буде формула осаду?
- Відповідь
-
[Ag +] = 1,0 × 10 —11 М; AgBr випадає в осад першим
Загальний іонний ефект
Як ми бачили, коли ми обговорювали буферні розчини, концентрація іонів гідронію водного розчину оцтової кислоти зменшується при додаванні сильного електроліту ацетату натрію, NaCH 3 CO 2. Ми можемо пояснити цей ефект за допомогою принципу Ле Шательє. Додавання ацетатних іонів призводить до зміщення рівноваги вліво, зменшуючи концентрацію\(\ce{H3O+}\) для компенсації підвищеної концентрації ацетатних іонів. При цьому підвищується концентрація СН 3 СО 2 Н:
\ [\ ce {CH3CO2H + H2O\ правий лівий гарпуни H3O+ + CH3CO2-}\)]
Оскільки ацетат натрію та оцтова кислота мають загальний ацетатний іон, вплив на рівновагу називається загальним іонним ефектом. Загальний іонний ефект також може мати прямий вплив на рівноваги розчинності. Припустимо, ми дивимося на реакцію, де розчиняється йодид срібла:
\[\ce{AgI}(s) \rightleftharpoons \ce{Ag+}(aq)+\ce{I-}(aq) \nonumber \]
Якби ми додали йодид калію (KI) до цього розчину, ми б додали речовину, яка поділяє загальний іон з йодидом срібла. Принцип Ле Шательє говорить нам, що коли змінюється система в рівновазі, реакція зміститься, щоб протидіяти цій зміні. У цьому прикладі було б надлишок іонів йодиду, тому реакція змістилася б вліво, внаслідок чого з розчину випадає більше йодиду срібла.
Обчисліть молярну розчинність сульфіду кадмію (CdS) в 0,010- М розчині броміду кадмію (CdBr 2). K sp компакт-дисків дорівнює 1,0 × 10 —28.
Рішення
Перше, що ви повинні помітити, це те, що сульфід кадмію розчиняється в розчині, який містить іони кадмію. Нам потрібно використовувати таблицю ICE, щоб встановити цю проблему та включити концентрацію CdBr 2 як внесок іонів кадмію:
\[\ce{CdS}(s) \rightleftharpoons \ce{Cd^2+}(aq)+\ce{S^2-}(aq) \nonumber \]
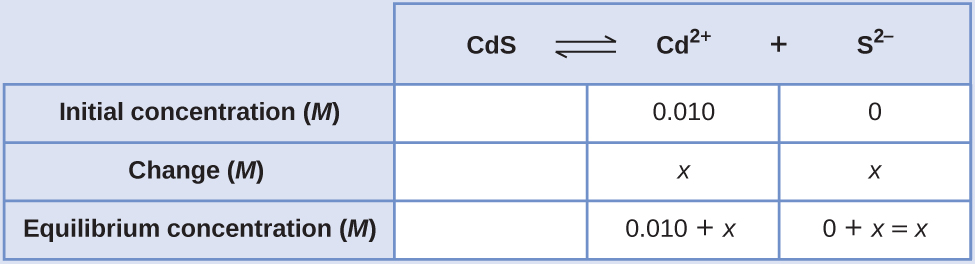
\( (0.010+x)(x)=1.0×10^{−28}\)\(x^2+0.010x−1.0×10^{−28}=0\)
Ми можемо вирішити це рівняння за допомогою квадратичної формули, але ми також можемо зробити припущення, щоб зробити цей розрахунок набагато простішим. Оскільки значення K sp настільки мале в порівнянні з концентрацією кадмію, можна припустити, що зміна між початковою концентрацією і рівноважною концентрацією мізерно мала, так що 0,010+ х ~ 0,010. Повертаючись до нашого виразу K sp, ми тепер отримаємо:
Тому молярна розчинність CdS в цьому розчині становить 1,0 × 10 —26 М.
Обчисліть молярну розчинність гідроксиду алюмінію, Al (OH) 3, в 0,015- М розчині нітрату алюмінію, Al (NO 3) 3. К сп Ал (ОН) 3 дорівнює 2 × 10 —32.
- Відповідь
-
4 × 10 —11
Резюме
Константа рівноваги для рівноваги, що передбачає осадження або розчинення слабо розчинного іонного твердого тіла, називається продуктом розчинності, K sp, твердого тіла. Коли ми маємо гетерогенну рівновагу за участю слаборозчинного твердого тіла M p X q та його іонів M m+ та X n—:
\[\ce{M}_p\ce{X}_q(s) \rightleftharpoons p\mathrm{M^{m+}}(aq)+q\mathrm{X^{n−}}(aq) \nonumber \]
Пишемо вираз розчинності продукту як:
\[K_\ce{sp}=\mathrm{[M^{m+}]}^p\mathrm{[X^{n−}]}^q \nonumber \]
Продукт розчинності слаборозчинного електроліту можна розрахувати по його розчинності; навпаки, його розчинність можна розрахувати по його K sp за умови, що єдиною значною реакцією, що виникає при розчиненні твердого тіла, є утворення його іонів. Малорозчинний електроліт починає випадати в осад, коли величина коефіцієнта реакції для реакції розчинення перевищує величину продукту розчинності. Осадження триває до тих пір, поки коефіцієнт реакції не дорівнює продукту розчинності. Реагент може бути доданий до розчину іонів, щоб дозволити одному іону вибірково випасти в осад з розчину. Загальний іонний ефект також може відігравати певну роль у реакціях опадів. При наявності іона, спільного з одним з іонів у розчині, застосовується принцип Ле Шательє, і з розчину виходить більше осаду, так що молярна розчинність зменшується.
Глосарій
- загальний іонний ефект
- вплив на рівновагу при додаванні до розчину речовини з іоном, спільним з розчиненим видом; викликає зниження розчинності іонного виду, або зниження іонізації слабкої кислоти або основи
- молярна розчинність
- розчинність сполуки, виражена в одиницях молів на літр (моль/л)
- вибіркові опади
- процес, в якому іони відокремлюються з використанням відмінностей їх розчинності з заданим осаджуючим реагентом
- продукт розчинності (K sp)
- постійна рівноваги для розчинення слаборозчинного електроліту
