2.2: Еволюція атомної теорії
- Page ID
- 22524
- Окреслення етапів розвитку сучасної атомної теорії
- Узагальнити та інтерпретувати результати експериментів Томсона, Міллікана та Резерфорда
- Опишіть три субатомні частинки, що складають атоми
- Ввести термін ізотопи
За два століття з тих пір, як Далтон розвивав свої ідеї, вчені досягли значного прогресу в просуванні нашого розуміння атомної теорії. Значна частина цього вийшла з результатів декількох насіннєвих експериментів, які виявили деталі внутрішньої будови атомів. Тут ми обговоримо деякі з цих ключових розробок, з акцентом на застосування наукового методу, а також розуміння того, як аналізувалися експериментальні докази. Хоча історичні особи та дати, що стоять за цими експериментами, можуть бути досить цікавими, найважливіше зрозуміти поняття, що випливають з їхньої роботи.
Атомна теорія після дев'ятнадцятого століття
Якби матерія складалася з атомів, з чого складаються атоми? Чи були вони найдрібнішими частинками, або було щось менше? Наприкінці 1800-х років ряд вчених, зацікавлених у подібних питаннях, досліджували електричні розряди, які могли вироблятися в газах низького тиску, з найбільш значущим відкриттям, зробленим англійським фізиком Джей Джей Томсоном за допомогою електронно-променевої трубки. Цей апарат складався з герметичної скляної трубки, з якої було видалено майже все повітря; трубка містила два металевих електрода. Коли на електроди подавалася висока напруга, між ними з'явився видимий промінь, званий електронним променем. Цей промінь відхилявся в бік позитивного заряду і подалі від негативного заряду, і вироблявся таким же чином з однаковими властивостями, коли для електродів використовувалися різні метали. У подібних експериментах промінь одночасно відхилявся прикладеним магнітним полем, а вимірювання ступеня відхилення і напруженості магнітного поля дозволили Томсону обчислити відношення заряду до маси частинок електронного променя. Результати цих вимірювань вказували на те, що ці частинки були набагато легше атомів (рис.\(\PageIndex{1}\)).
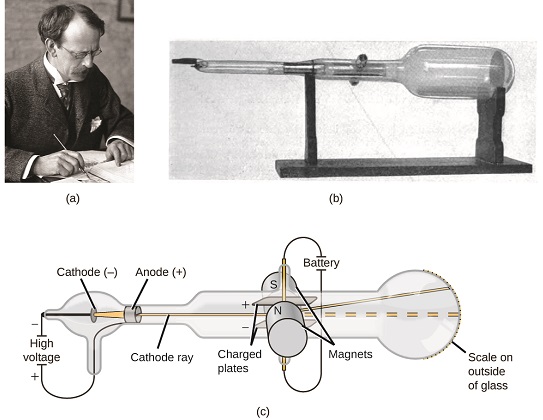
Виходячи з його спостережень, ось що запропонував Томсон і чому: Частинки притягуються позитивними (+) зарядами і відштовхуються негативними (−) зарядами, тому вони повинні бути негативно заряджені (як заряди відштовхуються і на відміну від зарядів притягуються); вони менш масивні, ніж атоми і не відрізняються, незалежно від вихідний матеріал, тому вони повинні бути фундаментальними, субатомними складовими всіх атомів. Хоча тоді суперечлива ідея Томсона була поступово прийнята, і його електронно-променева частка - це те, що ми зараз називаємо електроном, негативно зарядженою субатомною частинкою з масою більш ніж в тисячу разів менше атома. Термін «електрон» був придуманий в 1891 році ірландським фізиком Джорджем Стоуні, від «electr ic in on».
У 1909 році більше інформації про електрон було розкрито американським фізиком Робертом Мілліканом через його експерименти «краплі нафти». Міллікан створив мікроскопічні краплі олії, які могли бути електрично заряджені тертям у міру їх утворення або за допомогою рентгенівських променів. Ці краплі спочатку падали через гравітацію, але їх низхідний прогрес міг бути сповільнений або навіть скасований електричним полем нижче в апараті. Регулюючи напруженість електричного поля і роблячи ретельні вимірювання і відповідні розрахунки, Міллікан зміг визначити заряд по окремих краплях (рис.\(\PageIndex{2}\)).
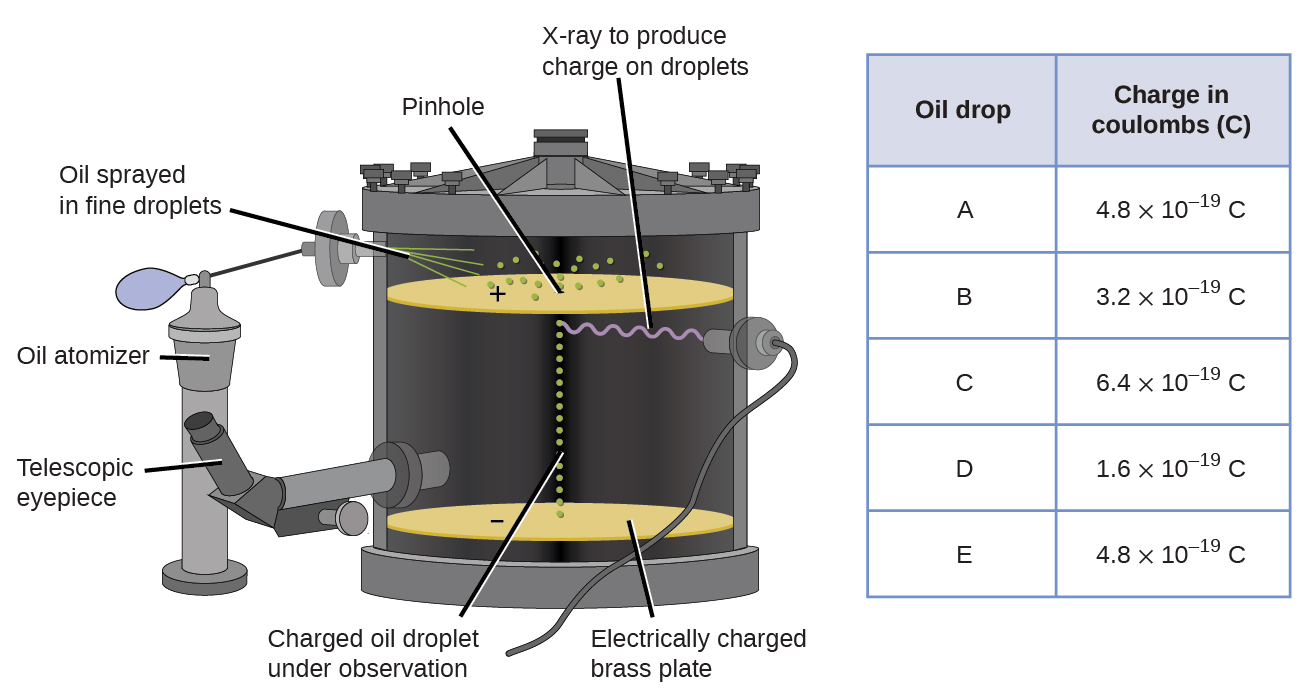
Дивлячись на дані заряду, які зібрав Міллікан, ви, можливо, визнали, що заряд краплі олії завжди кратний конкретному заряду, 1.6\(\times\) 10 −19 C. Міллікан зробив висновок, що ця величина повинна бути фундаментальним зарядом - заряд одного електрона - з його виміряним зарядів за рахунок надлишку одного електрона (1 раз 1,6\(\times\) 10 −19 С), двох електронів (2 рази 1,6\(\times\) 10 −19 С), трьох електронів (3 рази 1,6\(\times\) 10 −19 С) тощо на заданій масляній крапельці. Оскільки заряд електрона тепер був відомий завдяки дослідженням Міллікана, а відношення заряду до маси вже було відоме завдяки дослідженням Томсона (1.759\(\times\) 10 11 C/кг), для визначення маси електрона також знадобився лише простий розрахунок.
\[\mathrm{Mass\: of\: electron=1.602\times 10^{-19}\:\cancel{C}\times \dfrac{1\: kg}{1.759\times 10^{11}\:\cancel{C}}=9.107\times 10^{-31}\:kg} \tag{2.3.1} \]
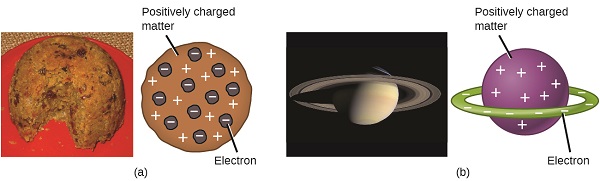
Зараз вчені встановили, що атом не є неподільним, як вважав Далтон, і завдяки роботі Томсона, Міллікана та інших, були відомі заряд і маса негативних, субатомних частинок - електронів. Однак позитивно заряджена частина атома ще не була добре зрозуміла. У 1904 році Томсон запропонував модель атомів «сливового пудингу», яка описувала позитивно заряджену масу з рівною кількістю негативного заряду у вигляді вбудованих в неї електронів, так як всі атоми електрично нейтральні. Конкуруюча модель була запропонована в 1903 році Хантаро Нагаока, який постулював сатурноподібний атом, що складається з позитивно зарядженої сфери, оточеної ореолом електронів (рис.\(\PageIndex{3}\)).
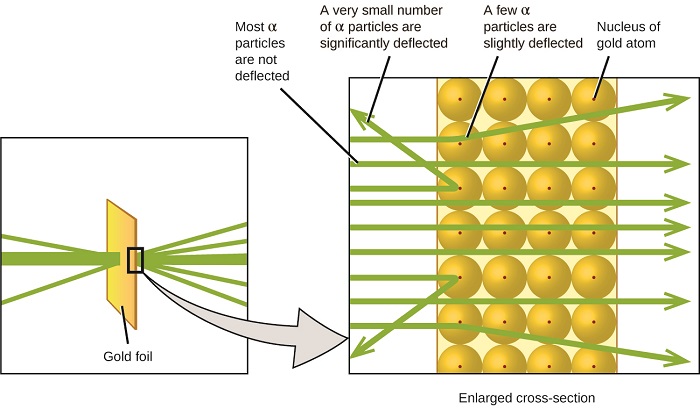
Наступний великий розвиток у розумінні атома прийшов від Ернеста Резерфорда, фізика з Нової Зеландії, який значною мірою провів свою наукову кар'єру в Канаді та Англії. Він виконав серію експериментів з використанням пучка високошвидкісних, позитивно заряджених альфа-частинок (α частинок), які були отримані в результаті радіоактивного розпаду радію; частинки α складаються з двох протонів і двох нейтронів (докладніше про радіоактивний розпад ви дізнаєтеся в розділі про ядерну хімія). Резерфорд і його колеги Ганс Гейгер (пізніше прославився лічильником Гейгера) і Ернест Марсден направили пучок α частинок, джерело яких був вбудований в свинцевий блок для поглинання більшої частини випромінювання, на дуже тонкий шматок золотої фольги і дослідили результуюче розсіювання частинки α за допомогою люмінесцентного екрану, який світиться коротко там, де потрапила частинка α.
Що вони виявили? Більшість частинок проходили прямо через фольгу, не відхиляючись взагалі. Однак деякі були трохи відволені, а дуже невелика кількість відхилялася майже прямо назад до джерела (рис.\(\PageIndex{4}\)). Резерфорд описав пошук цих результатів: «Це була найнеймовірніша подія, яка коли-небудь траплялася зі мною в моєму житті. Це було майже так само неймовірно, ніби ви випустили 15-дюймовий снаряд по шматочку цигаркового паперу, і він повернувся і вдарив вас» 1 (стор. 68).
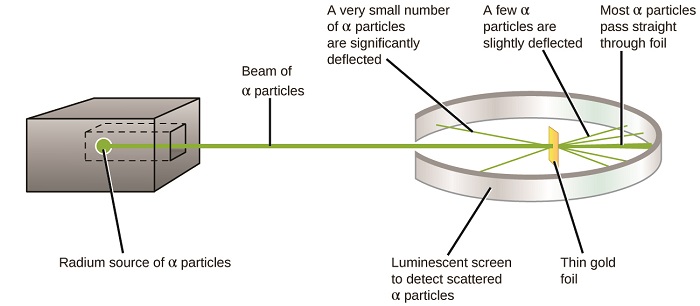
Ось що вивів Резерфорд: Оскільки більшість швидкохідних α частинок пройшли через атоми золота, вони, мабуть, пройшли по суті порожній простір всередині атома. Альфа-частинки заряджені позитивно, тому прогини виникли при зіткненні з іншим позитивним зарядом (як заряди відштовхують один одного). Оскільки, як заряди відштовхуються один від одного, кілька позитивно заряджених α частинок, які різко змінювали шляхи, повинні вдарити або близько наблизилися до іншого тіла, яке також мало висококонцентрований позитивний заряд. Так як прогини відбувалися невелику частку часу, цей заряд займав лише невелику кількість простору в золотій фользі. Детально аналізуючи серію таких експериментів, Резерфорд зробив два висновки:
- Обсяг, зайнятий атомом, повинен складатися з великої кількості порожнього простору.
- Невелике, відносно важке, позитивно заряджене тіло - ядро, повинно знаходитися в центрі кожного атома.
Цей аналіз змусив Резерфорда запропонувати модель, в якій атом складається з дуже малого, позитивно зарядженого ядра, в якому зосереджена більша частина маси атома, оточена негативно зарядженими електронами, так що атом є електрично нейтральним (рис.\(\PageIndex{5}\)).
Після багатьох інших експериментів Резерфорд також виявив, що ядра інших елементів містять водневе ядро як «будівельний блок», і він назвав цю більш фундаментальну частинку протоном, позитивно зарядженою субатомною частинкою, знайденою в ядрі. З одним доповненням, яке ви дізнаєтеся далі, ця ядерна модель атома, запропонована понад століття тому, використовується і сьогодні.
Ще однією важливою знахідкою стало відкриття ізотопів. Протягом початку 1900-х років вчені виявили кілька речовин, які виявилися новими елементами, виділивши їх з радіоактивних руд. Наприклад, «новий елемент», що утворюється в результаті радіоактивного розпаду торію, спочатку отримав назву мезоторій. Однак більш детальний аналіз показав, що мезоторій хімічно ідентичний радію (іншому продукту розпаду), незважаючи на те, що він мав іншу атомну масу. Цей результат, поряд з подібними висновками для інших елементів, змусив англійського хіміка Фредеріка Содді зрозуміти, що елемент може мати типи атомів з різною масою, які хімічно не відрізняються. Ці різні типи називаються ізотопами —атомами одного і того ж елемента, які відрізняються масою. Содді був удостоєний Нобелівської премії з хімії в 1921 році за це відкриття.
Залишилася одна загадка: Ядро, як відомо, містить майже всю масу атома, причому кількість протонів забезпечує лише половину або менше цієї маси. Були зроблені різні пропозиції, щоб пояснити, що являє собою залишилася масу, включаючи існування нейтральних частинок в ядрі. Як і слід було очікувати, виявлення незаряджених частинок є дуже складним завданням, і лише в 1932 році Джеймс Чедвік знайшов докази нейтронів, незаряджених субатомних частинок з масою приблизно такою ж, як у протонів. Існування нейтронів також пояснювало ізотопи: Вони відрізняються масою, оскільки мають різну кількість нейтронів, але вони хімічно ідентичні, оскільки мають однакову кількість протонів. Це буде більш детально пояснено далі в цьому розділі.
Резюме
Хоча ніхто насправді не бачив всередині атома, експерименти продемонстрували багато про атомну структуру. Електронно-променева трубка Томсона показала, що атоми містять невеликі, негативно заряджені частинки, звані електронами. Міллікан виявив, що існує фундаментальний електричний заряд - заряд електрона. Експеримент Резерфорда із золотої фольги показав, що атоми мають невелике, щільне, позитивно заряджене ядро; позитивно заряджені частинки всередині ядра називаються протонами. Чедвік виявив, що ядро також містить нейтральні частинки, звані нейтронами. Содді продемонстрував, що атоми одного і того ж елемента можуть відрізнятися за масою; вони називаються ізотопами.
Виноски
- Ернест Резерфорд, «Розвиток теорії атомної будови», ред. Дж. Раткліфф, на тлі сучасної науки, ред. Джозеф Нідхем та Уолтер Пейджел, (Кембридж, Великобританія: Кембриджська університетська преса, 1938), 61—74. Доступ до 22 вересня 2014 р. https://ia600508.us.archive.org/3/it...e032734mbp.pdf.
Глосарій
- альфа-частинка (α частка)
- позитивно заряджена частка, що складається з двох протонів і двох нейтронів
- електрон
- негативно заряджена, субатомна частка відносно низької маси, розташована поза ядром
- ізотопів
- атоми, які містять однакову кількість протонів, але різну кількість нейтронів
- нейтрон
- незаряджена, субатомна частка, розташована в ядрі
- протона
- позитивно заряджена, субатомна частка, розташована в ядрі
- ядра
- масивний, позитивно заряджений центр атома, що складається з протонів і нейтронів
