1.2: Фази та класифікація речовини
- Page ID
- 22666
- Опишіть основні властивості кожного фізичного стану речовини: твердого, рідкого та газового.
- Визначте і наведіть приклади атомів і молекул.
- Класифікуйте речовину як елемент, сполуку, однорідну суміш або неоднорідну суміш щодо її фізичного стану та складу.
- Використовуйте символічні, тверді частинки або макроскопічні зображення для опису або класифікації різних типів матерії.
- Розрізняють масу і вагу.
- Застосовують закон збереження матерії.
Матерія визначається як все, що займає простір і має масу, і це все навколо нас. Тверді речовини та рідини більш очевидно мають значення: ми бачимо, що вони займають місце, і їх вага говорить нам, що вони мають масу. Гази також мають значення; якби гази не займали місця, повітряна куля залишався б звалився, а не надувався при заповненні газом.
Тверді речовини, рідини та гази - це три стани речовини, які зазвичай зустрічаються на землі (рис.\(\PageIndex{1}\)). Тверда є жорсткою і володіє певною формою. Рідина тече і приймає форму контейнера, за винятком того, що вона утворює плоску або злегка вигнуту верхню поверхню під дією сили тяжіння. (При невагомості рідини приймають сферичну форму.) Як рідкі, так і тверді зразки мають обсяги, які дуже майже не залежать від тиску. Газ приймає як форму, так і об'єм свого контейнера.
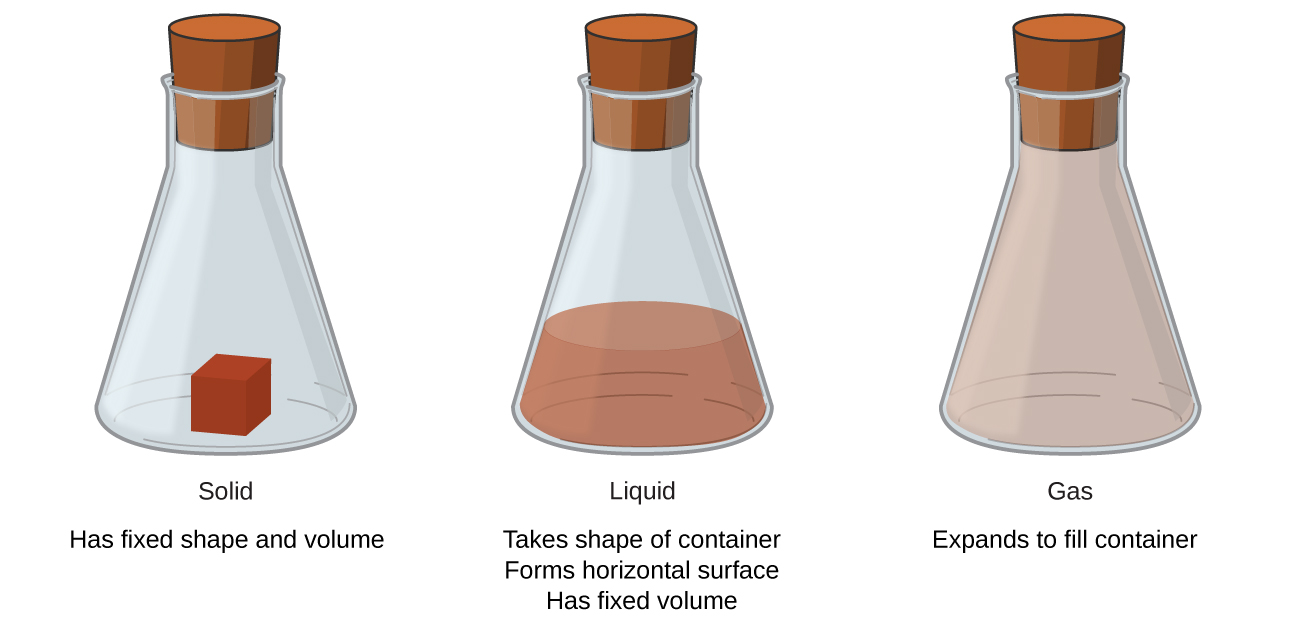
Четвертий стан речовини, плазма, виникає природним чином в інтер'єрах зірок. Плазма - це газоподібний стан речовини, що містить помітну кількість електрично заряджених частинок (рис.\(\PageIndex{2}\)). Наявність цих заряджених частинок надає унікальні властивості плазмі, які виправдовують їх класифікацію як стан речовини, відмінного від газів. Окрім зірок, плазма зустрічається в деяких інших високотемпературних середовищах (як природних, так і техногенних), таких як удари блискавки, певні телевізійні екрани та спеціалізовані аналітичні прилади, що використовуються для виявлення слідових кількостей металів.

Відео\(\PageIndex{1}\): У крихітній камері в плазмовому телевізорі плазма випромінює ультрафіолетове світло, що, в свою чергу, призводить до того, що дисплей в цьому місці з'являється певний колір. Композит цих крихітних кольорових крапок складає зображення, яке ви бачите. Перегляньте це відео, щоб дізнатися більше про плазму та місця, де ви зіткнулися з нею.
Деякі зразки речовини, здається, мають властивості твердих речовин, рідин та/або газів одночасно. Це може статися, коли зразок складається з безлічі дрібних шматочків. Наприклад, ми можемо насипати пісок так, ніби це рідина, оскільки він складається з багатьох дрібних крупинок твердого піску. Матерія також може мати властивості більш ніж одного стану, коли це суміш, наприклад, з хмарами. Хмари, здається, поводяться дещо як гази, але насправді вони є сумішами повітря (газу) та крихітних частинок води (рідкої або твердої).
Маса предмета - це міра кількості речовини в ньому. Одним із способів вимірювання маси об'єкта є вимірювання сили, необхідної для прискорення об'єкта. Для розгону автомобіля потрібно набагато більше сил, ніж велосипед, тому що автомобіль має набагато більше маси. Більш поширеним способом визначення маси предмета є використання балансу для порівняння його маси зі стандартною масою.
Хоча вага пов'язана з масою, це не одне і те ж. Вага відноситься до сили, яку сила тяжіння чинить на предмет. Ця сила прямо пропорційна масі предмета. Вага предмета змінюється в міру зміни сили тяжіння, але його маса - ні. Маса космонавта не змінюється тільки тому, що вона йде на Місяць. Але її вага на Місяці становить лише одну шосту її земну вагу, оскільки гравітація Місяця становить лише одну шосту від земної, вона може відчувати себе «невагомою» під час своєї подорожі, коли відчуває незначні зовнішні сили (гравітаційні чи будь-які інші), хоча вона, звичайно, ніколи не «безмасова».
Закон збереження речовини узагальнює багато наукових спостережень щодо матерії: Він стверджує, що немає виявленої зміни загальної кількості речовини, присутньої, коли речовина перетворюється з одного типу в інший (хімічна зміна) або зміни серед твердих, рідких або газоподібних станів ( фізична зміна). Пивоваріння пива і робота акумуляторів наводять приклади збереження речовини (рис.\(\PageIndex{4}\)). Під час варіння пива інгредієнти (вода, дріжджі, зерна, солод, хміль та цукор) перетворюються на пиво (воду, алкоголь, карбонізацію та смакові речовини) без фактичної втрати речовини. Найбільш чітко це видно в процесі розливу, коли глюкоза перетворюється в етанол і вуглекислий газ, а загальна маса речовин не змінюється. Це також можна побачити в свинцево-кислотному автомобільному акумуляторі: вихідні речовини (свинець, оксид свинцю та сірчана кислота), які здатні виробляти електроенергію, перетворюються на інші речовини (сульфат свинцю та воду), які не виробляють електрику, без зміни фактичної кількості речовини.
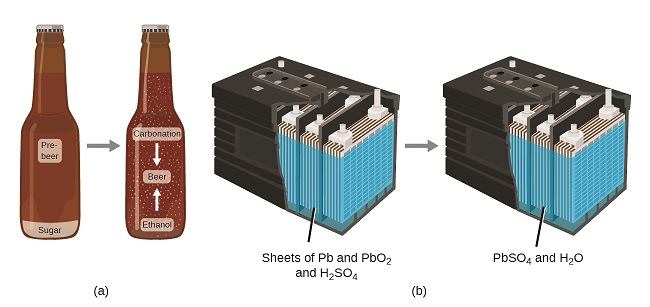
Хоча цей закон збереження справедливо для всіх перетворень матерії, переконливих прикладів мало і далеко між ними, оскільки, поза контрольованими умовами в лабораторії, ми рідко збираємо весь матеріал, який виробляється під час певного перетворення. Наприклад, коли ви їсте, перетравлюєте та засвоюєте їжу, вся справа в вихідній їжі зберігається. Але оскільки деяка частина питання включена у ваше тіло, і багато виводиться як різні види відходів, це важко перевірити шляхом вимірювання.
Атоми і молекули
Атом - це найдрібніша частинка елемента, яка має властивості цього елемента і може вступати в хімічну комбінацію. Розглянемо елемент золото, наприклад. Уявіть, як розрізати золотий самородок навпіл, потім розрізати одну з половинок навпіл і повторювати цей процес, поки не залишиться шматок золота, який був настільки малий, що його неможливо було розрізати навпіл (незалежно від того, наскільки крихітним може бути ваш ніж). Цей мінімально розмірний шматок золота є атомом (від грецького atomos, що означає «неподільний») (рис. 1.2.4). Цей атом більше не був би золотом, якби його розділили далі.

Перше припущення про те, що матерія складається з атомів, приписується грецьким філософам Левкіппу і Демокріту, які розвивали свої ідеї в 5 столітті до нашої ери. Однак лише на початку дев'ятнадцятого століття Джон Далтон (1766—1844), британський шкільний вчитель з гострим інтересом до науки, підтримав цю гіпотезу кількісними вимірами. З того часу неодноразові експерименти підтвердили багато аспектів цієї гіпотези, і вона стала однією з центральних теорій хімії. Інші аспекти атомної теорії Дальтона все ще використовуються, але з незначними ревізіями (деталі теорії Дальтона наведені в главі про атоми і молекули).
Атом настільки малий, що його розмір важко уявити. Однією з найменших речей, яку ми можемо побачити неозброєним оком, є одна нитка павутини: Ці нитки мають діаметр близько 1/10 000 сантиметра (0,0001 см). Хоча перетин однієї нитки практично неможливо побачити без мікроскопа, воно величезне в атомному масштабі. Один атом вуглецю в павутині має діаметр близько 0,000000015 сантиметра, і потрібно близько 7000 атомів вуглецю, щоб охопити діаметр нитка. Щоб поставити це в перспективі, якби атом вуглецю був розміром з копійки, перетин однієї нитки був би більшим, ніж футбольне поле, для покриття якого потрібно близько 150 мільйонів атомів вуглецю «копійки». (Малюнок\(\PageIndex{5}\)) показує все більш близькі мікроскопічні та атомні види звичайної бавовни.
Атом настільки легкий, що його масу теж важко уявити. Мільярд атомів свинцю (1 000 000 000 атомів) важать близько\(3 \times 10^{−13}\) грамів, маса, яка є занадто легкою, щоб її можна було зважувати навіть на найбільш чутливих балансах у світі. Буде потрібно зважити понад 300 000 000 000 атомів свинцю (300 трильйонів, або 3 × 10 14), і вони важать лише 0.0000001 грам.
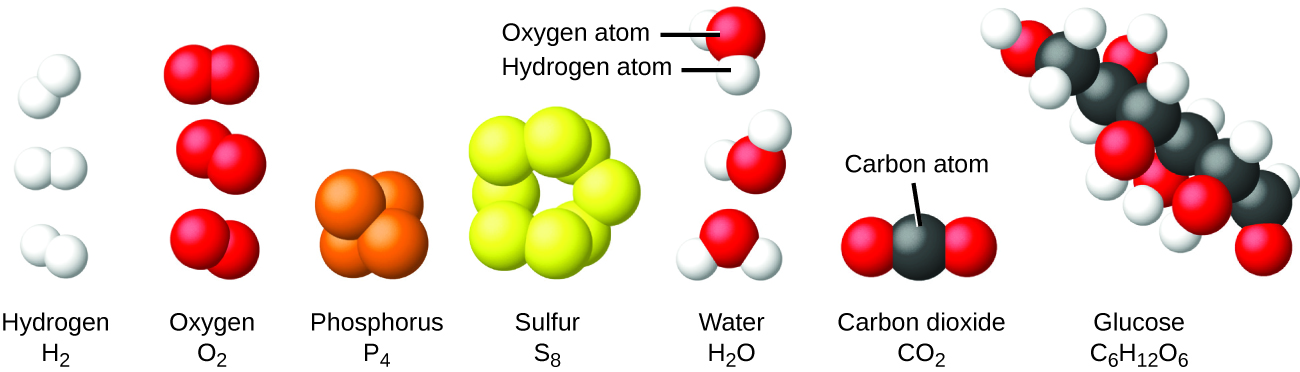
Рідко можна зустріти колекції окремих атомів. Лише кілька елементів, таких як гази гелій, неон та аргон, складаються з колекції окремих атомів, які рухаються незалежно один від одного. Інші елементи, такі як гази водень, азот, кисень і хлор, складаються з одиниць, які складаються з пар атомів (рис.\(\PageIndex{6}\)). Одна з форм елемента фосфор складається з одиниць, що складаються з чотирьох атомів фосфору. Елемент сірка існує в різних формах, одна з яких складається з одиниць, що складаються з восьми атомів сірки. Ці одиниці називаються молекулами. Молекула складається з двох або більше атомів, з'єднаних сильними силами, званими хімічними зв'язками. Атоми в молекулі рухаються як одиниця, так само, як банки з содою в шести упаковці або зв'язка ключів, з'єднаних разом на одному брелоку. Молекула може складатися з двох або більше однакових атомів, як у молекулах, що містяться в елементах водню, кисню та сірки, або вона може складатися з двох або більше різних атомів, як у молекулах, що містяться у воді. Кожна молекула води - це одиниця, яка містить два атома водню і один атом кисню. Кожна молекула глюкози - це одиниця, яка містить 6 атомів вуглецю, 12 атомів водню та 6 атомів кисню. Як і атоми, молекули неймовірно малі і легкі. Якби звичайний стакан води був збільшений до розміру землі, молекули води всередині нього були б приблизно розміром з м'ячі для гольфу.
Класифікація матерії
Ми можемо класифікувати речовину на кілька категорій. Дві великі категорії - це суміші і чисті речовини. Чиста речовина має постійний склад. Всі екземпляри чистої речовини мають абсолютно однаковий склад і властивості. Будь-яка проба сахарози (столового цукру) складається з 42,1% вуглецю, 6,5% водню і 51,4% кисню по масі. Будь-яка проба сахарози також має такі ж фізичні властивості, як температура плавлення, колір і солодкість, незалежно від джерела, з якого вона виділена.
Ми можемо розділити чисті речовини на два класи: елементи і сполуки. Чисті речовини, які не можуть бути розщеплені на більш прості речовини хімічними змінами, називаються елементами. Залізо, срібло, золото, алюміній, сірка, кисень і мідь - знайомі приклади більш ніж 100 відомих елементів, з яких близько 90 зустрічаються природним шляхом на землі, а два десятка або близько того були створені в лабораторіях.
Чисті речовини, які можуть бути розщеплені хімічними змінами, називаються сполуками. Ця поломка може виробляти або елементи, або інші сполуки, або обидва. Оксид ртуті (II), помаранчеве, кристалічне тверде тіло, може розщеплюватися теплом на елементи ртуть і кисень (рис.\(\PageIndex{7}\)). При нагріванні при відсутності повітря з'єднання сахарози розщеплюється на елемент вуглецю і з'єднання води. (Початкова стадія цього процесу, коли цукор стає коричневим, відомий як карамелізація - це те, що надає характерний солодкий і горіховий смак карамельним яблукам, карамелізованій цибулі та карамелі). Хлорид срібла (I) - це біла тверда речовина, яка може бути розщеплена на його елементи, срібло та хлор, шляхом поглинання світла. Ця властивість є основою для використання даного з'єднання в фотоплівках і фотохромних окулярах (тих, у яких лінзи, які темніють при впливі світла).

Властивості комбінованих елементів відрізняються від тих, що знаходяться у вільному, або некомбінованому стані. Наприклад, білий кристалічний цукор (сахароза) - це з'єднання, отримане в результаті хімічної комбінації елемента вуглецю, який є чорним твердим тілом в одній з його некомбінованих форм, і двох елементів водню і кисню, які є безбарвними газами при некомбінованому з'єднанні. Вільний натрій, елемент, який є м'якою, блискучою металевою твердою речовиною та вільним хлором, елементом, який є жовто-зеленим газом, поєднуються з утворенням хлориду натрію (кухонної солі), сполуки, яка є білою кристалічною твердою речовиною.
Суміш складається з двох або більше типів матерії, які можуть бути присутніми в різних кількостях і можуть бути розділені фізичними змінами, такими як випаровування (про це ви дізнаєтеся пізніше). Суміш зі складом, який змінюється від точки до точки, називається неоднорідною сумішшю. Італійська заправка - приклад неоднорідної суміші (рис.\(\PageIndex{1a}\)). Його склад може відрізнятися, оскільки ми можемо зробити його з різної кількості олії, оцту та трав. Це не те ж саме від точки до точки по всій суміші - одна крапля може бути в основному оцтом, тоді як інша крапля може бути переважно маслом або травами, оскільки олія та оцет відокремлюються, а трави осідають. Іншими прикладами гетерогенних сумішей є шоколадне печиво (ми можемо побачити окремі шматочки шоколаду, горіхів та тіста для печива) та граніт (ми можемо побачити кварц, слюду, польовий шпат тощо).
Однорідна суміш, яку також називають розчином, проявляє однорідний склад і зовні зовні зовні однаковою. Прикладом розчину є спортивний напій, що складається з води, цукру, барвника, ароматизатора і електролітів, змішаних між собою рівномірно (рис.\(\PageIndex{1b}\)). Кожна крапля спортивного напою має однаковий смак, оскільки кожна крапля містить однакову кількість води, цукру та інших компонентів. Зверніть увагу, що склад спортивного напою може відрізнятися - він може бути зроблений з дещо більшою або меншою кількістю цукру, ароматизаторів або інших компонентів, і все ж бути спортивним напоєм. Інші приклади однорідних сумішей включають повітря, кленовий сироп, бензин та розчин солі у воді.

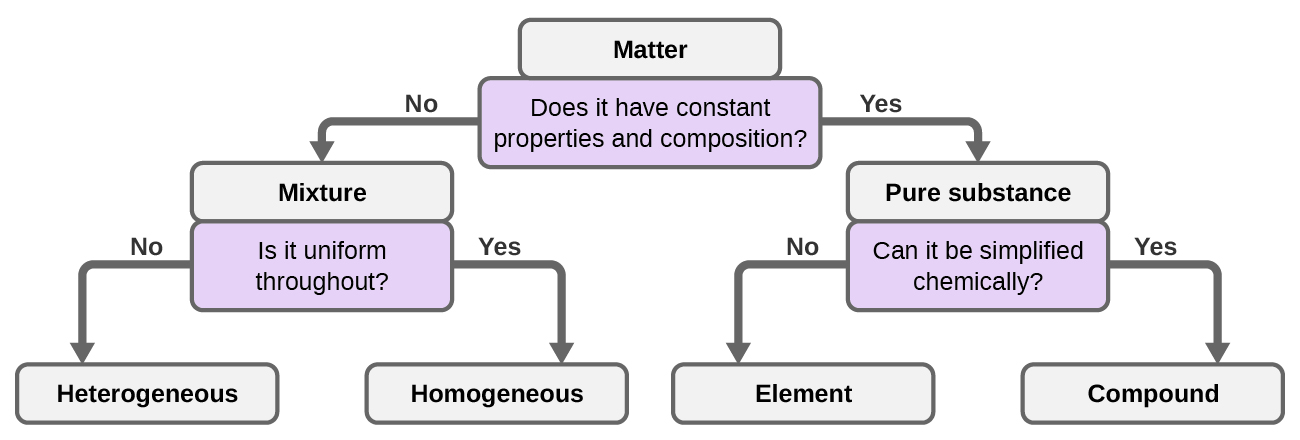
Хоча існує трохи більше 100 елементів, десятки мільйонів хімічних сполук є результатом різних комбінацій цих елементів. Кожне з'єднання має певний склад і володіє певними хімічними і фізичними властивостями, за якими ми можемо відрізнити його від всіх інших сполук. І, звичайно, існує незліченна кількість способів комбінування елементів і з'єднань для утворення різних сумішей. Короткий опис того, як розрізняти різні основні класифікації речовини, наведено на (рис. 1.2.8).
Одинадцять елементів становлять близько 99% земної кори і атмосфери (табл.\(\PageIndex{1}\)). Кисень становить майже половину, а кремній - близько чверті від загальної кількості цих елементів. Більшість елементів на землі знаходяться в хімічних комбінаціях з іншими елементами; близько чверті елементів також знаходяться у вільному стані.
| Елемент | Символ | Відсоток маси | Елемент | Символ | Відсоток маси | |
|---|---|---|---|---|---|---|
| кисень | O | 49.20 | хлору | Cl | 0,19 | |
| кремній | СІ | 25.67 | фосфор | Р | 0,11 | |
| алюміній | Аль | 7.50 | марганцю | Мн | 0,09 | |
| залізо | Fe | 4.71 | вуглець | C | 0,08 | |
| кальцій | Ca | 3.39 | сірки | S | 0,06 | |
| натрію | Na | 2.63 | барію | Ба | 0,04 | |
| калій | К | 2.40 | азоту | П | 0,03 | |
| магній | Мг | 1.93 | фтору | F | 0,03 | |
| водню | Ч | 0,87 | стронцій | Sr | 0,02 | |
| титан | Ti | 0,58 | всі інші | - | 0,47 |
Розкладання води/Виробництво водню
Вода складається з елементів водню і кисню, об'єднаних в співвідношенні 2 до 1. Вода може бути розщеплена на водень і кисневі гази шляхом додавання енергії. Один із способів зробити це - з акумулятором або блоком живлення, як показано на (рис.\(\PageIndex{9}\)).
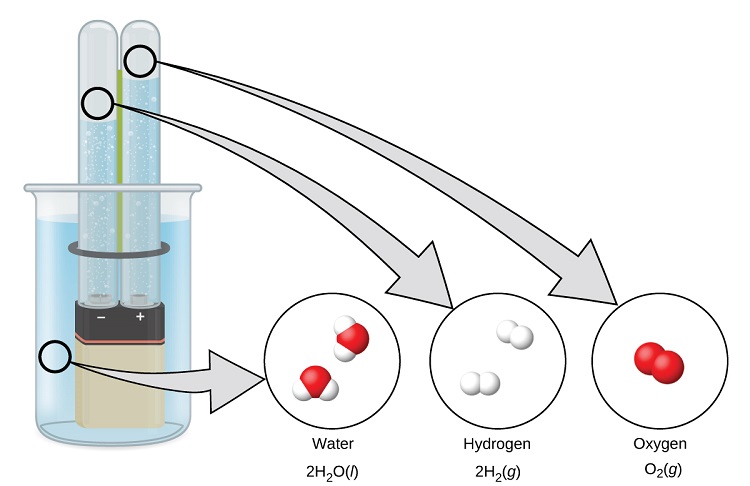
Розпад води передбачає перестановку атомів у молекулах води на різні молекули, кожна з яких складається з двох атомів водню та двох атомів кисню відповідно. Дві молекули води утворюють одну молекулу кисню і дві молекули водню. Представлення того, що відбувається\(\ce{2H2O}(l)\rightarrow \ce{2H2}(g)+\ce{O2}(g)\), буде вивчено більш глибоко в наступних розділах.
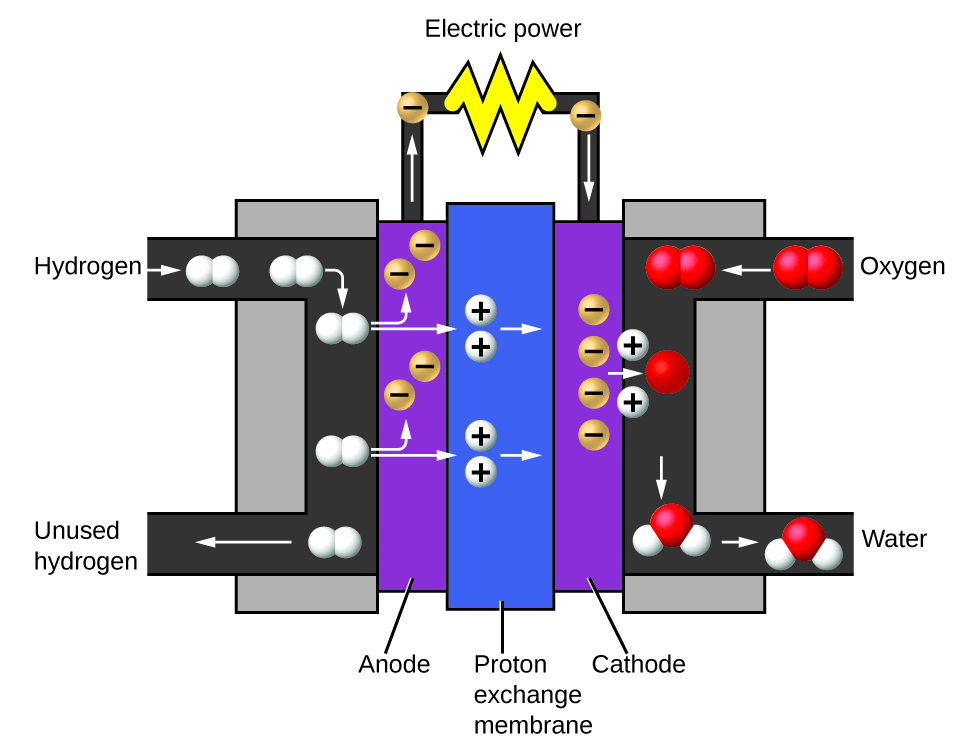
Два вироблені гази мають чітко різні властивості. Кисень не горючий, але необхідний для спалювання палива, а водень є легкозаймистим і потужним джерелом енергії. Як ці знання можуть бути застосовані в нашому світі? Одне застосування передбачає дослідження більш ефективного транспортування палива. Транспортні засоби на паливних елементах (FCV) працюють на водні замість бензину (рис.\(\PageIndex{10}\)). Вони ефективніші, ніж транспортні засоби з двигунами внутрішнього згоряння, екологічно чисті та зменшують викиди парникових газів, що робить нас менш залежними від викопного палива. Однак FCV ще не є економічно життєздатними, а поточне виробництво водню залежить від природного газу. Якщо ми зможемо розробити процес економічного розкладання води або виробництва водню іншим екологічно безпечним способом, FCV можуть бути шляхом майбутнього.
Хімія стільникових телефонів
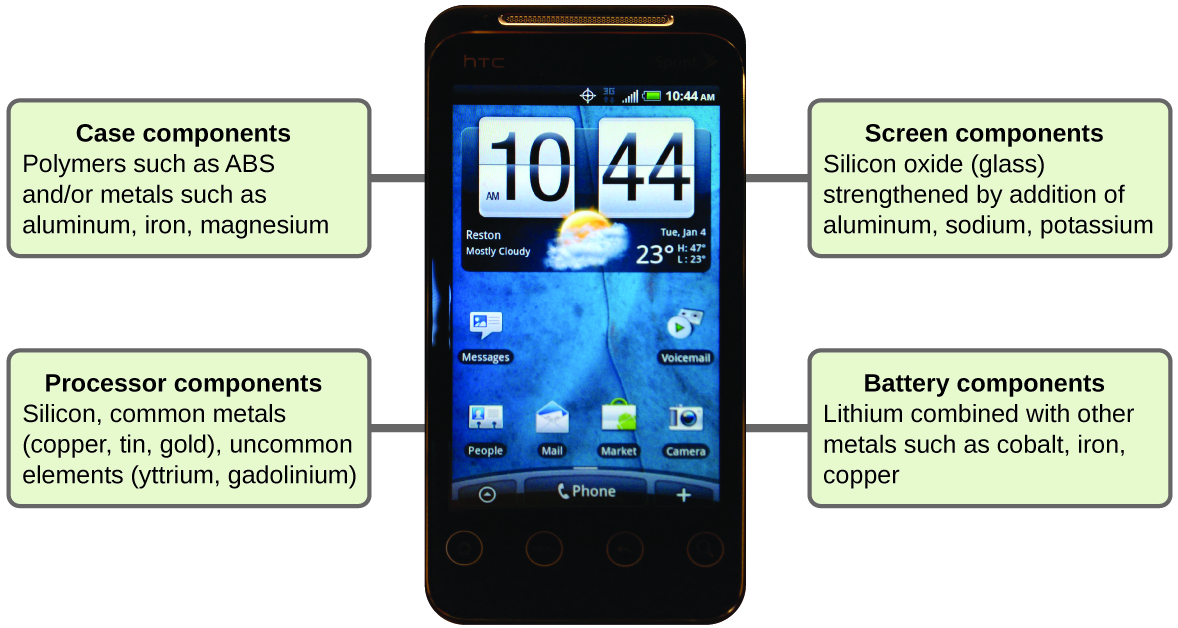
Уявіть, наскільки різною була б ваше життя без стільникових телефонів (рис.\(\PageIndex{11}\)) та інших розумних пристроїв. Стільникові телефони виготовляються з численних хімічних речовин, які витягуються, очищені, очищені та зібрані, використовуючи широке і глибоке розуміння хімічних принципів. Близько 30% елементів, які зустрічаються в природі, знаходяться в межах типового смартфона. Корпус/корпус/рама складається з комбінації міцних, міцних полімерів, що складаються в основному з вуглецю, водню, кисню та азоту [акрилонітрилбутадієнстирол (ABS) та полікарбонатні термопласти], а також легких, міцних конструкційних металів, таких як алюміній, магній та залізо. Екран дисплея виготовлений із спеціально загартованого скла (кремнеземного скла, зміцненого додаванням алюмінію, натрію та калію) і покритий матеріалом, щоб зробити його провідним (наприклад, оксид індію олова). На друкованій платі використовується напівпровідниковий матеріал (зазвичай кремній); зазвичай використовуються метали, такі як мідь, олово, срібло та золото; і більш незнайомі елементи, такі як ітрій, празеодим та гадоліній. Акумулятор спирається на іони літію та різноманітні інші матеріали, включаючи залізо, кобальт, мідь, поліетиленоксид та поліакрилонітрил.
Резюме
Матерія - це все, що займає простір і має масу. Основним будівельним блоком речовини є атом, найменша одиниця елемента, яка може вступати в комбінації з атомами тих же або інших елементів. У багатьох речовині атоми об'єднуються в молекули. На землі матерія зазвичай існує у трьох станах: тверді речовини фіксованої форми та об'єму; рідини змінної форми, але фіксованого об'єму; і гази змінної форми та об'єму. У високотемпературних умовах речовина також може існувати у вигляді плазми. Більшість матерії - це суміш: вона складається з двох або більше типів матерії, які можуть бути присутніми в різних кількостях і можуть бути розділені фізичними засобами. Гетерогенні суміші розрізняються за складом від точки до точки; однорідні суміші мають однаковий склад від точки до точки. Чисті речовини складаються тільки з одного виду матерії. Чиста речовина може бути елементом, який складається тільки з одного типу атома і не може бути розщеплений хімічною зміною, або сполукою, яка складається з двох і більше типів атомів.
Глосарій
- атом
- найменша частинка елемента, яка може увійти в хімічну комбінацію
- з'єднання
- чиста речовина, яка може розкладатися на два або більше елементів
- елемент
- речовина, яка складається з одного типу атома; речовина, яка не може бути розкладена хімічною зміною
- газ
- стан, в якому матерія не має ні певного обсягу, ні форми
- неоднорідна суміш
- поєднання речовин зі складом, який змінюється від точки до точки
- однорідна суміш
- (також, розчин) поєднання речовин зі складом, який є рівномірним по всьому
- рідкий
- стан речовини, що має певний об'єм, але невизначену форму
- закон збереження речовини
- коли речовина перетворюється з одного типу в інший або змінює форму, немає виявлених змін у загальній кількості присутньої речовини
- маси
- фундаментальне властивість із зазначенням кількості речовини
- матерія
- все, що займає простір і має масу
- суміш
- матерія, яка може бути розділена на її складові фізичними засобами
- молекули
- зв'язкова колекція двох або більше атомів одного і того ж або різних елементів
- плазма
- газоподібний стан речовини, що містить велику кількість електрично заряджених атомів і/або молекул
- чиста речовина
- однорідна речовина, що має постійний склад
- твердий
- стан речовини, яке є жорстким, має певну форму і має досить постійний обсяг
- вага
- сила, яку сила тяжіння чинить на об'єкт
