22.10: Хелатуючі агенти
- Page ID
- 24211
Хоча ми обмежилися нашим обговоренням до цих пір простими лігандами, такими як Cl -, NH 3 або H 2 O, набагато більші та складніші молекули також можуть пожертвувати електронні пари іонам металів. Важливим і цікавим прикладом цього є хелатуючі агенти -ліганди, які здатні утворювати дві або більше координатних ковалентних зв'язків з іоном металу. Одним з найпоширеніших з них є 1,2-діаміноетан (зазвичай називають етилендіамін і скорочено en.)
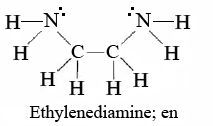
Коли обидва азоту узгоджуються з іоном металу, утворюється стійке п'ятичленне кільце. Слово chelating, що походить від грецького chele, «кіготь», описує щипцеподібний спосіб, за допомогою якого такий ліганд може захопити іон металу.
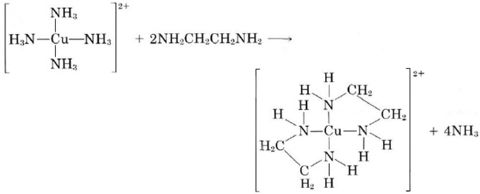
Хелатуючий агент, який утворює кілька зв'язків з металом, не надмірно напружуючи власну структуру, зазвичай здатний замінити аналогічний простіший ліганд. Наприклад, хоча обидва утворюють координатні ковалентні зв'язки через групи, етилендіамін може легко замінити аміак з більшості комплексів:
групи, етилендіамін може легко замінити аміак з більшості комплексів:
Для металів, які відображають координаційне число 6, особливо потужним лігандом є e thylene d iaminete t raa a cetate ion (скорочено ЕДТА):
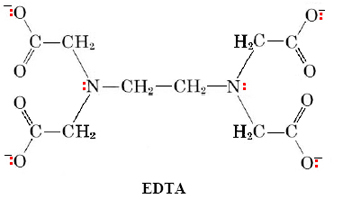
Всі шість електронних пар, позначені кольором, здатні координуватися з іоном металу, в цьому випадку іон ЕДТА повністю обертається навколо металу і його дуже важко вибити. ЕДТА використовується для лікування отруєння свинцем і ртуттю через його здатність хелатувати ці метали і допомогти їх видалення з організму.
Хелатні комплекси часто важливі в живих системах. Координація заліза в білках, таких як міоглобін або гемоглобін, включає чотири азоту групи гема і один з бічного ланцюга гістидину. Так як залізо в нормі має координаційне число 6, це залишає один відкритий ділянку, до якого може зв'язуватися кисень. Наявність чадного газу, більш сильного ліганда, ніж кисень, викликає витіснення кисню з гемоглобіну. Це запобігає транспортуванню кисню з легенів до мозку, викликаючи сонливість, втрату свідомості і навіть смерть при тривалому впливі чадного газу. Отже, експлуатація автомобіля в закритому гаражі, варильна плита в наметі або спалювання будь-якого викопного палива в закритому приміщенні може бути небезпечним для здоров'я.
Іншим важливим застосуванням хелатів є транспортування іонів металів через мембрани. Внутрішня частина біологічних мембран містить неполярні, гідрофобні хвости ліпідних молекул. Це ускладнює переміщення іонних видів, таких як K + і Na +, з одного боку мембрани на іншу. Одним із способів обійти цей бар'єр є молекулами-носіями, які називаються іонофорами. Іонофори здатні хелатувати іон, але також мають гідрофобний зовнішній вигляд.
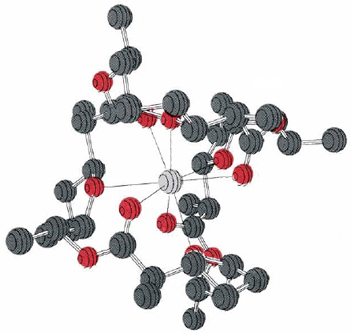
Одним з таких іонофорів є антибіотик нонактин, органічна молекула середнього розміру з формулою
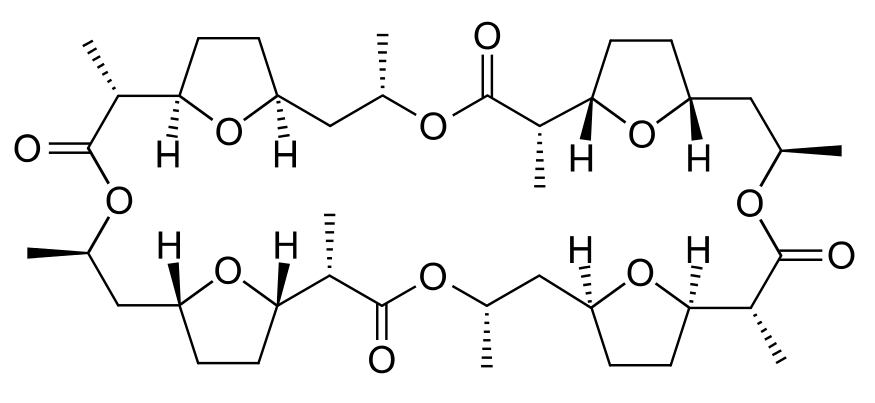
Ця молекула здатна транспортувати іони K +, але не іони Na +. Мабуть, іон Na + занадто малий, щоб поміститися серед восьми координаційних O, тоді як іон K + може (рис. 1). Крім цих О, більша частина молекули неактину є вуглеводневим ланцюгом. Тому, як тільки К + хелатний, зовнішня частина комплексу досить гідрофобна. Він може легко пройти через внутрішню частину мембрани, звільняючи K + з іншого боку. Токсична дія нонактину та кількох супутніх антибіотиків є результатом їх здатності транспортувати іони лужних металів до областей клітини, де їх не повинно бути. Це розбиває іонні градієнти, створені клітиною для виконання завдань та накопичення енергії. Отже, клітина витрачає енергію, викачуючи K + та інші іони знову.