16.2: Гальванічні елементи та електроди
- Page ID
- 19189
Фізично неможливо виміряти різницю потенціалів між шматком металу і розчином, в який він занурений. Ми можемо, однак, виміряти різницю між потенціалами двох електродів, які занурюються в один і той же розчин, або більш корисно, знаходяться в двох різних рішеннях. В останньому випадку кожна пара електрод-розчин являє собою половину осередку окислювально-відновного, і ми вимірюємо суму двох потенціалів півкомірки.
Таке розташування називається гальванічним елементом. Типова комірка може складатися з двох шматків металу, одного цинку та іншої міді, кожен занурений у розчин, що містить розчинену сіль відповідного металу. Два розчини розділені пористим бар'єром, який запобігає їх швидкому змішуванню, але дозволяє іонам розсіюватися.
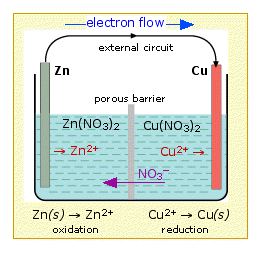
Якщо ми з'єднаємо цинк і мідь за допомогою металевого провідника, надлишкові електрони, які залишаються, коли іони Zn 2 + виходять з цинку в лівій комірці, зможуть протікати через зовнішній ланцюг і в правий електрод, де вони могли б бути доставлені до Cu 2 + іони, які стають «розрядженими», тобто перетворюються в атоми Cu на поверхні мідного електрода. Чиста реакція - окислення цинку іонами міді (II):
\[Zn_{(s)} + Cu^{2+} \rightarrow Zn^{2+} + Cu_{(s)}\]
але на цей раз етапи окислення і відновлення (половинні реакції) відбуваються в окремих місцях:
|
лівий електрод:
|
Zn (и) → Zn 2 + 2 е — | окислення |
|
правий електрод:
|
Cu 2 + 2 е — → Cu (s) | скорочення |
Електрохімічні клітини дозволяють вимірювати та контролювати окислювально-відновну реакцію
Реакцію можна запустити і зупинити, підключивши або від'єднавши два електроди. Якщо ми розмістимо змінний опір в ланцюзі, ми можемо навіть контролювати швидкість реакції чистої клітини, просто повернувши ручку. Підключивши батарею або інше джерело струму до двох електродів, ми можемо змусити реакцію протікати в її неспонтанному або зворотному напрямку. Помістивши амперметр у зовнішній ланцюг, ми можемо виміряти кількість електричного заряду, який проходить через електроди, і, таким чином, кількість молів реагентів, які перетворюються в продукти реакції клітини.
Електричний заряд q вимірюється в кулоні. Кількість заряду, що переноситься одним молем електронів, відомо як Фарадей, який ми позначимо F. Ретельні експерименти визначили, що 1 F = 96467 C. Для більшості цілей можна просто використовувати 96 500 кулонів як значення фарадея. Коли ми вимірюємо електричний струм, ми вимірюємо швидкість, з якою електричний заряд транспортується по ланцюгу. Струм в один ампер відповідає витраті одного кулона в секунду.
Зарядний транспорт всередині осередку
Щоб комірка працювала, між двома електродами не тільки повинна бути зовнішня електрична ланцюг, але два електроліти (розчини) повинні контактувати. Необхідність цього можна зрозуміти, розглянувши, що станеться, якби два рішення були фізично розділені. Позитивний заряд (у вигляді Zn 2 +) додається до електроліту в лівому відсіку і видаляється (як Cu 2 +) з правого боку, внаслідок чого розчин, що контактує з цинком, придбає чистий позитивний заряд, тоді як чистий негативний заряд буде накопичуватися в розчині на мідній стороні осередку. Ці порушення електронейтральності ускладнили б (вимагали більшої роботи) введення додаткових іонів Zn 2 + в позитивно заряджений електроліт або перетікання електронів в правий відсік, де вони потрібні для зменшення Cu 2. + іони, таким чином ефективно зупиняючи реакцію після того, як відбулася лише хімічно незначна кількість.
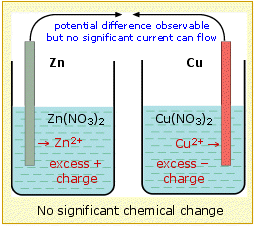
Для підтримки реакції клітини заряд, що переноситься електронами через зовнішній ланцюг, повинен супроводжуватися компенсуючим транспортом іонів між двома клітинами. Це означає, що ми повинні забезпечити шлях для переміщення іонів безпосередньо з однієї клітини в іншу. Цей іонний транспорт включає в себе не тільки електроактивні види Cu 2 + і Zn 2 +, але і контрійони, які в даному прикладі є нітратами, NO 3 -. Таким чином, надлишок Cu 2 + в лівому відсіку може бути полегшений дрейфом цих іонів в праву сторону, або однаково добре шляхом дифузії нітратних іонів ліворуч. Більш детальні дослідження показують, що обидва процеси відбуваються, і що відносна кількість заряду, що переноситься через розчин позитивними і негативними іонами, залежить від їх відносної рухливості, які виражають швидкість, з якою іони здатні пробиратися через розчин. Оскільки негативні іони, як правило, більші за позитивні іони, як правило, мають більш високу рухливість і несуть більшу частку заряду.

У найпростіших осередках бар'єром між двома розчинами може бути пориста мембрана, але для точних вимірювань використовується більш складне розташування, відоме як соляний міст. Соляний міст складається з проміжного відсіку, заповненого концентрованим розчином KCl і забезпеченого пористими бар'єрами на кожному кінці. Метою соляного моста є мінімізація природної різниці потенціалів, відомої як потенціал переходу, яка розвивається (як згадувалося в попередньому розділі), коли будь-які дві фази (наприклад, два розчини) контактують. Ця різниця потенціалів буде поєднуватися з двома потенціалами напівклітинки, щоб ввести ступінь невизначеності в будь-яке вимірювання потенціалу клітини. З соляним містком у нас є два потенціали переходу рідини замість одного, але вони, як правило, скасовують один одного.
Умовності щодо опису комірок
Для того щоб було простіше описати дану електрохімічну осередок, прийнято спеціальне символічне позначення. У цьому позначенні осередок, який ми описали вище, буде
Zn (s) | Zn 2 + (aq) || Су 2 + (ак) | Cu (и)
Існує кілька інших умовностей, що стосуються позначення клітин та номенклатури, які ви повинні знати:
- Анод - це місце, де відбувається окислення, а катод - місце відновлення. У реальній клітині ідентичність електродів залежить від напрямку, в якому відбувається реакція сітчастої клітини.
- Якщо електрони перетікають від лівого електрода до правого електрода (як зображено в наведених вище позначеннях осередку), коли осередок працює в своєму спонтанному напрямку, потенціал правого електрода буде вище, ніж у лівого, а потенціал клітини буде позитивним.
- «Звичайний потік струму» - від позитивного до негативного, що протилежно напрямку потоку електронів. Це означає, що якщо електрони течуть від лівого електрода направо, гальванометр, розміщений у зовнішньому ланцюзі, вказував би на потік струму справа наліво.
Електроди та електродні реакції
Реакція електрода відноситься до чистого процесу окислення або відновлення, який відбувається на електроді. Ця реакція може відбуватися в одній стадії передачі електронів, або у вигляді послідовності з двох і більше кроків. Речовини, які отримують і втрачають електрони, називаються електроактивними видами.
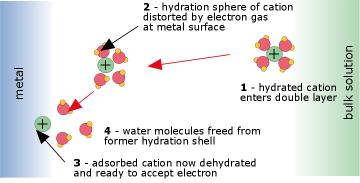
Цей процес відбувається в межах дуже тонкої міжфазної області на поверхні електрода і включає квантово-механічне тунелювання електронів між електродом і електроактивним видом. Робота, необхідна для витіснення молекул Н 2 О в сферах гідратації іонів, становить частину енергії активації процесу.
У прикладі використовуваної нами клітини Zn/Cu електрода реакція включає метал і його гідратований катіон; ми називаємо такі електроди метал-метал іонними електродами. Існує ряд інших видів електродів, які широко зустрічаються в електрохімії та аналітичній хімії.
Іонно-іонні електроди
Багато електродних реакцій включають тільки іонні види, такі як\(Fe^{2+}\) і\(Fe^{3+}\). Якщо жоден з електроактивних видів не є металом, якийсь інший метал повинен служити каналом для подачі або видалення електронів з системи. Щоб уникнути ускладнень, які можуть виникнути внаслідок електродних реакцій за участю цього металу, зазвичай використовується відносно інертна речовина, така як платина. Така половина осередку була б представлена як
Пт (и) | Fe 3 + (ак), Fe 2 + (aq) ||...
і реакція половини клітин буде
\[Fe^{2+}(aq) \rightarrow Fe^{3+} (aq) + e^-\]
Реакція відбувається на поверхні електрода (рис. 4 вище). Електроактивний іон дифундує на поверхню електрода і адсорбується (прикріплюється) до неї вандер-Ваальсом і кулонівськими силами. При цьому води гідратації, які зазвичай прикріплюються до будь-яких іонних видів, повинні бути витіснені. Цей процес завжди ендотермічний, іноді до такої міри, що лише мала частка іонів зможе досить тісно контактувати з поверхнею, щоб зазнати перенесення електронів, і реакція буде повільною. Фактична передача електронів відбувається квантово-механічним тунелюванням.
Газові електроди
Деякі реакції електродів включають газоподібні види, такі як\(H_2\)\(O_2\), або\(Cl_2\). Такі реакції також повинні проводитися на поверхні електрохімічно інертного провідника типу платини. Типовою реакцією, що має значне комерційне значення, є
\[Cl^-(aq) \rightarrow ½ Cl_2(g) + e^- \]
Подібні реакції, пов'язані з окисленням\(Br_2\) або\(I_2\) також відбуваються на платинових поверхнях.
Нерозчинні - сольові електроди
Типовий електрод такого роду складається з срібного дроту, покритого тонким покриттям з хлориду срібла, який нерозчинний у воді. Реакція електрода полягає в окисленні і відновленні срібла:
\[AgCl(s) + e^– → Ag(s) + Cl^–(aq)\]
Половина осередку буде представлена як
\[ ... || Cl^– (aq) | AgCl (s) | Ag (s)\]
Хоча корисність такого електрода може бути очевидною не відразу, цей вид електрода знаходить дуже широке застосування в електрохімічних вимірах, як ми побачимо пізніше.
Еталонні електроди
У більшості електрохімічних експериментів наш інтерес зосереджений лише на одній з електродних реакцій. Оскільки всі вимірювання повинні проводитися на повній комірці за участю двох електродних систем, звичайною практикою є використання еталонного електрода як іншої половини комірки. Основними вимогами еталонного електрода є те, що його легко підготувати та обслуговувати, а також щоб його потенціал був стабільним. Остання вимога по суті означає, що концентрація будь-яких іонних видів, що беруть участь в реакції електрода, повинна утримуватися на фіксованій величині. Найпоширенішим способом досягнення цього є використання реакції електрода за участю насиченого розчину нерозчинної солі іона. Одна з таких систем, електрод сріблясто-сріблястий хлорид вже згадувалася:
\[Ag | AgCl(s) | Cl^–(aq) || ...\]
\[Ag(s) + Cl^–(aq) →AgCl(s) + e^–\]
Цей електрод зазвичай приймає форму шматка срібного дроту, покритого AgCl. Покриття робиться шляхом виготовлення срібла анодом в електролітичній комірці, що містить HCl; іони Ag + поєднуються з іонами Cl так само швидко, як вони утворюються на поверхні срібла.

Іншим поширеним еталонним електродом є каломельний електрод; каломель - загальна назва хлориду ртуті (I). Така половина осередку була б представлена як
\[Hg | Hg^{2+}(aq) | KCl || ...\]
і реакція половини клітин буде
\[Hg(l) + Cl^– → ½ HgCl2(s) + e^–\]
Потенціали обох цих електродів були дуже точно визначені проти водневого електрода. Останній рідко використовується в звичайних електрохімічних вимірах, оскільки його складніше підготувати; поверхню платини доводиться спеціально обробляти попереднім електролізом. Також існує потреба в подачі водневого газу, що робить його дещо громіздким і небезпечним.
Резюме та додаткові примітки
Переконайтеся, що ви добре розумієте наступні основні ідеї, які були представлені вище. Особливо важливо, щоб ви знали точні значення всіх виділених термінів в контексті даної теми.
- Гальванічний елемент (іноді доцільніше називати вольтаїчним елементом) складається з двох напівклітин, з'єднаних соляним містком або якимось іншим шляхом, який дозволяє іонам проходити між двома сторонами для підтримки електронейтральності.
- Звичайний спосіб представлення електрохімічної клітини будь-якого виду - написати половину реакції окислення зліва та зменшення праворуч. Таким чином, для реакції
Zn (и) + Cu 2 + → Zn 2 + Cu (и)
пишемо
Zn (s) | Zn 2 + (aq) || Су 2 + (ак) | Cu (и)
в якому поодинокі вертикальні смуги представляють межі фаз. Подвійний брусок позначає межу рідина-рідина, яка в лабораторних осередках складається з соляного містка або в іонно-проникному бар'єрі. Якби реакція сітчастої клітини була записана в зворотному порядку, позначення клітини стали б
Cu (и) | Cu 2 + (aq) || Zn 2+ (aq) | Zn (s)
Пам'ятайте: процес зменшення R завжди відображається на правій частині R.
-
на поверхні електрода. Енергія, необхідна для витіснення молекул води з гідратаційної оболонки іона, коли він наближається до поверхні електрода, становить енергію активації, яка може уповільнити процес. Ще більші енергії активації (і більш повільні реакції) виникають, коли утворюється або споживається така молекула, як O 2.
