8.2: Термодинаміка розчинів
- Page ID
- 19296
Переконайтеся, що ви добре розумієте наступні основні ідеї:
- Опишіть два основні процеси, які повинні відбуватися кожного разу, коли розчинена речовина розчиняється в розчиннику, і обговоріть вплив поглинання або вивільнення енергії на ступінь цих процесів.
- Ще одним фактором, що входить в процес утворення розчину, є збільшення (або зрідка, зниження) ентропії — тобто ступеня, до якої теплова енергія розсіюється або «розріджується». Поясніть це своїми словами.
- Поясніть, як прислів'я «як розчиняється, як» відображає згадані вище ефекти. Яке основне фізичне властивість молекули, що визначає це «подобу»?
- Що ми маємо на увазі, коли описуємо таку рідину, як вода, як «асоційовану»? Поясніть, як це пов'язано з розчинністю розчинених речовин в таких рідинях.
Ви можете згадати, що в попередній одиниці фазових рівноваг ми вказували, що агрегації молекул, які є більш невпорядкованими, як правило, є тими, які віддають перевагу при більш високій температурі, тоді як ті, які мають найнижчу потенційну енергію, сприятливі при більш низьких температурах. Це загальний принцип, який застосовується у всьому світі матерії; стабільна форма при будь-якій заданій температурі завжди буде такою, що призводить до найкращого балансу між низькою потенційною енергією та високомолекулярним розладом. Щоб побачити, як ці міркування застосовуються до розчинів, подумайте про окремі кроки, які необхідно виконати при розчиненні розчиненої речовини в розчиннику:

- Якщо розчиненою речовиною є тверда речовина або рідина, його потрібно спочатку диспергувати - тобто його молекулярні одиниці повинні бути розірвані. Для цього потрібна енергія, і тому цей крок завжди працює проти утворення розчину.

- Потім розчинену речовину необхідно ввести в розчинник. Чи є це енергетично сприятливим або несприятливим, залежить від природи розчиненого речовини і розчинника. Якщо розчиненою речовиною є A, а розчинник - B, то важливим є сила сил притягання між молекулами A-A та B-B порівняно з парами A-B; якщо останні більші, то потенційна енергія буде нижчою, коли речовини змішуються, і утворення розчину буде сприяти.
Якщо крок 2 виділяє більше енергії, ніж споживається на етапі 1, це сприятиме утворенню розчину, і ми, як правило, можемо очікувати розчинення розчиненої речовини в розчиннику. Навіть якщо процес розчинення трохи ендотермічний, є третій важливий фактор - збільшення ентропії, що дуже часто сприятиме розчиненому стану.
Ентропія розчину
Як знає кожен, хто перетасував колоду карт, невпорядковані розташування об'єктів статистично більш прихильні просто тому, що є більше способів, за допомогою яких вони можуть бути реалізовані. І зі збільшенням кількості об'єктів, тим більше статистика регулює їх найбільш ймовірні механізми. Кількість об'єктів (молекул), з якими ми маємо справу в хімії, настільки величезна, що їх схильність до якомога більшого поширення стає переважною. Однак при цьому теплова енергія, яку вони несуть з собою, також поширюється і розсіюється, тому доступність цієї енергії, як вимірюється температурою, також має значення. Хіміки використовують термін «ентропія» для позначення цього аспекту молекулярної випадковості.
Читачі цього розділу, які мали певний вплив термодинаміки, будуть знати, що розчинність, як і всі рівноваги, регулюється зміною вільної енергії Гіббса для процесу, який включає зміну ентропії на фундаментальному рівні. Правильне розуміння цих міркувань вимагає деякого знайомства з термодинамікою, з якою більшість студентів не стикаються до їх другого семестру хімії. Якщо ви ще не там, не впадайте у відчай; цим вам надається тимчасовий дозвіл думати про молекулярний «розлад» та ентропію просто з точки зору «поширення».
Таким чином, у дуже поширеному випадку, коли невелика кількість твердої речовини або рідини розчиняється в набагато більшому обсязі розчинника, розчинена речовина стає більш розкинутою в просторі, і кількість еквівалентних способів, за допомогою яких розчинена речовина може бути розподілена в межах цього об'єму, значно збільшується. Це те саме, що говорити про те, що ентропія розчиненої речовини збільшується.
Якщо енергетика розчинення сприятлива, це збільшення ентропії означає, що умови розчинності завжди будуть дотримані. Навіть якщо енергетика трохи ендотермічна, ефект ентропії все одно може дозволити розчину сформуватися, хоча, можливо, обмежуючи максимальну концентрацію, яку можна досягти. У такому випадку ми можемо описати розчинену речовину як малорозчинну в певному розчиннику. Що це означає, що для повного розчинення даної маси розчиненої речовини буде потрібно більший обсяг розчинника.
Ентальпія розчину
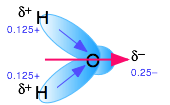
Полярні молекули - це ті, в яких електричний заряд розподілений асиметрично. Найбільш звичним прикладом є звичайна вода, в якій високоелектронегативний атом кисню тягне частину хмари електричного заряду, пов'язаного з кожним зв'язком O—H ближче до себе. Хоча молекула H 2 O в цілому електрично нейтральна, цей дисбаланс заряду породжує постійний електричний дипольний момент.
Хіміки використовують термін «асоційовані» рідини для позначення рідин, в яких вплив водневого зв'язку домінує над місцевою структурою. Вода є найважливішим з них, але аміак NH 3 та ціаністий водень HCN - інші поширені приклади.
Таким чином, рідка вода складається з розширеної мережі молекул Н 2 О, пов'язаних між собою дипольно-дипольними атракціонами, які ми називаємо водневими зв'язками. Оскільки вони набагато слабкіші, ніж звичайні хімічні зв'язки, вони постійно порушуються тепловими силами. Як результат, розширена структура сильно невпорядкована (на відміну від твердого льоду) і постійно змінюється.
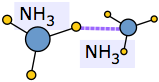
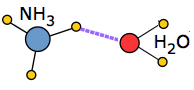
Коли розчинену молекулу вводять в асоційовану рідину, необхідно витратити певну кількість енергії, щоб порушити місцеву структуру водневих зв'язків і звільнити простір для нової молекули. Якщо розчинена речовина сама по собі є іоном або полярною молекулою, в гру вступають нові іонно-дипольні або дипольно-дипольні атракціони. У сприятливих випадках вони можуть вивільнити достатню потенційну енергію, щоб значною мірою компенсувати енергію, необхідну для включення розчиненої речовини в структуру.
Крайній приклад цього відбувається, коли аміак розчиняється у воді. Кожна молекула NH 3 може утворювати три водневі зв'язки, тому отриманий розчин ще більше пов'язаний з воднем, ніж чиста вода - враховуючи значну кількість тепла, що виділяється в процесі, та надзвичайно велику розчинність аміаку у воді.
Неполярні розчинні речовини помірно розчинні у воді: гідрофобний ефект
Коли неполярний розчинений розчин, такий як кисень або гексан, вводять у пов'язану рідину, ми можемо очікувати, що енергія, необхідна для розриву водневих зв'язків, щоб звільнити простір для нової молекули, не компенсується утворенням нових привабливих взаємодій, припускаючи, що процес буде енергетично несприятливий. Тому ми можемо передбачити, що розчинні речовини цих видів будуть лише помірно розчинні у воді, і це дійсно так.
Виявляється, однак, що це не зовсім правильне пояснення малої розчинності неполярних розчинених речовин у воді. Зараз відомо, що молекули H 2 O, які оточують неполярного порушника і виявляються нездатними сформувати з ним полярні або пов'язані з воднем взаємодії, що знижують енергію, перебудуться в конфігурацію, яка максимізує водневий зв'язок між самими молекулами води. При цьому це створює оболонку, подібну до клітини, навколо молекули розчиненої речовини. З точки зору енергетики процесу ці нові взаємодії H 2 O-H 2 O в значній мірі компенсують відсутність взаємодій Solute-H 2 O.
Однак ця оболонка високоорганізованих молекул води впливає на розчинність за рахунок зменшення ентропії системи. Розчинення розчиненої речовини зазвичай збільшує ентропію шляхом поширення розчинених молекул (і теплової енергії, яку вони містять) через більший об'єм розчинника. Але в цьому випадку молекули H 2 O всередині високоструктурованої оболонки, що оточує молекулу розчиненої речовини, самі обмежені в цьому місці, і їх кількість досить велика, щоб зменшити ентропію набагато більше, ніж розчинена розчинена речовина збільшує її.
Наслідки гідрофобного ефекту виходять далеко за межі теми розчинності. Він керує способом згортання білків, утворенням мильних бульбашок та утворенням клітинних мембран. Мала розчинність неполярного розчиненого речовини в пов'язаній рідині, такій як вода, є більшою мірою внаслідок негативної зміни ентропії, а не від енергетичних міркувань. Це явище відоме як гідрофобний ефект. У наступному розділі ми розглянемо способи, за допомогою яких ці енергетично-ентропійні міркування об'єднуються в різних видах рішень.
