7.2: Міжмолекулярні взаємодії
- Page ID
- 19210
- Назвіть п'ять видів молекулярних одиниць, з яких може складатися конденсована речовина.
- Намалюйте криву потенційної енергії, чітко показуючи поділ рівноваги та мінімум потенційної енергії.
- Вкажіть різницю між прив'язаними та незв'язаними атракціонами.
- Поясніть значення і значення дипольного моменту молекули.
- Визначте індукований диполь і поляризуваність.
- Створіть шість видів міжмолекулярних сил привабливості та їх відносні сильні сторони.
Рідини і тверді речовини відрізняються від газів тим, що вони утримуються разом силами, що діють між окремими молекулярними одиницями, з яких вони складаються. У цьому уроці ми детальніше розглянемо ці сили, щоб ви могли легше зрозуміти, а в багатьох випадках передбачити різноманітні фізичні властивості багатьох видів твердих речовин і рідин, з якими ми стикаємося у світі.
Саме існування конденсованих станів речовини говорить про те, що існують сили привабливості, що діють між основними молекулярними одиницями твердих тіл і рідин. Термін молекулярна одиниця відноситься до найменшої дискретної структурної одиниці, яка становить рідина або тверде тіло. У більшості з більш ніж 15 мільйонів хімічних речовин, які сьогодні відомі, ці структурні одиниці є фактичними молекулами — тобто агрегатами атомів, які мають свої відмінні властивості, формули та молекулярні ваги. Але молекулярні одиниці також можуть бути окремими атомами, іонами і більш розширеними одиницями. Як і у більшості штучних класифікацій, ці відмінності, як правило, руйнуються в крайніх випадках: більшість штучних полімерів («пластмас») складаються з молекул різних розмірів і форм, деякі металеві сплави містять ідентифіковані молекулярні одиниці, і це не надто велика розтяжка, щоб розглядати алмаз або кристал NaCl як «молекула» сама по собі.
Криві потенційної енергії
В атомному або молекулярному масштабі всі частинки надають один на одного як привабливі, так і відштовхуючі сили. Якщо сили притягання між двома або більше атомами досить сильні, щоб перетворити їх в міцну одиницю зі своїми спостережуваними властивостями, ми називаємо результат «молекулою» і називаємо силу «хімічним зв'язком».

Дві двоатомні молекули, зображені на малюнку,\(\PageIndex{1}\) вступили в тісний контакт один з одним, але сила притягання, яка діє між ними, недостатньо сильна, щоб зв'язати їх у нову молекулярну одиницю, тому ми називаємо цю силу незв'язним притяганням. За відсутності цих незв'язних атракціонів вся матерія існувала б лише в газоподібному стані; не було б конденсованих фаз.

Різницю між сполучними та незв'язними атракціонами можна побачити, порівнявши графік потенційної енергії для пари атомів водню з графіком для двох атомів аргону (рис.\(\PageIndex{2}\)). Коли два атоми водню об'єднуються, потенційна енергія падає до мінімуму, а потім швидко піднімається, коли дві електронні хмари починають відштовхувати один одного. Мінімум потенційної енергії визначає енергію та середню довжину зв'язку H—H — дві її унікальні вимірювані властивості.
Потенційна енергія пари атомів аргону також падає в міру їх зближення, але недостатньо, щоб утримувати їх разом. (Наприклад, закони квантової механіки не дозволяють цьому благородному газовому елементу утворювати стабільні\(Ar_2\) молекули.) Однак ці незв'язні атракціони дозволяють аргону існувати як рідина і тверда речовина при низьких температурах, але не в змозі витримати збої, спричинені тепловою енергією при звичайних температурах, тому ми зазвичай знаємо аргон як газ.
Теплові ефекти
З класичних знімків, при температурах вище абсолютного нуля, всі частинки молекулярного масштабу володіють тепловою енергією, яка утримує їх в постійному русі (а від квантової картини рух не припиняється навіть при абсолютному нулі за принципом Гейзенберга Невизначено). Середня теплова енергія задається добутком газової постійної R і абсолютної температури. При 25° C це працює до
\[RT = (8.314 \,J \,K^{–1} mol^{–1}) (298\, K) = 2,480\, J\, mol^{–1} \approx 2.5\, kJ\, mol^{–1}\]
Функціональний хімічний зв'язок набагато міцніше, ніж це (як правило, понад 100 кДж/моль), тому ефект теплового руху полягає в тому, щоб змусити зв'язок вібрувати; лише при більш високих температурах (де значення RT більше) більшість зв'язків почне розриватися. Незв'язні сили привабливості між парами атомів, як правило, занадто слабкі, щоб витримати навіть одну вібрацію. Крім унікальних відмінних властивостей, таких як енергія зв'язку, довжина зв'язку і частоти розтягування, ковалентні зв'язки зазвичай мають спрямовані властивості, які залежать від орбітальних структур атомів компонента. Набагато слабші несклеювальні атракціони не мають жодної з цих властивостей.
Форма кривої потенційної енергії (часто наближена як крива «Морзе») показує, як відштовхуючі і привабливі сили впливають на потенційну енергію протилежними способами: відштовхування завжди піднімають цю енергію, а атракціони зменшують її. Крива проходить через мінімум, коли сили привабливості і відштовхування точно знаходяться в рівновазі. Як ми вже заявляли вище, всі частинки чинять обидва види сил один на одного; всі ці сили в основному електричні за своєю природою, і вони проявляються різними способами і з різною силою.

Відстань, що відповідає мінімальній потенційній енергії, відома як відстань рівноваги. Це середня відстань, яка буде підтримуватися двома частинками, якщо на них не діють інші сили, наприклад, можуть виникнути внаслідок присутності інших частинок поблизу. Загальний емпіричний вираз для кривої потенційної енергії взаємодії між двома частинками можна записати як
\[ E = Ar^{-n} + Br^{-m} \label{7.2.1}\]
\(A\)і\(B\) є константами пропорційності і\(n\) і\(m\) є цілими числами. Цей вираз іноді називають рівнянням Міе. Перший термін відповідає відштовхуванню завжди позитивний, і\(n\) повинен бути більшим, ніж\(m\), відображаючи той факт, що відштовхування завжди домінує при невеликих відділеннях.\(A\) \(B\)Коефіцієнт негативний для сил притягання, але він стане позитивним для електростатичного відштовхування між подібними зарядами. Чим більше значення одного з цих показників, тим ближче частинки повинні підійти до того, як сила стане значною. У таблиці\(\PageIndex{1}\) наведено показники для типів взаємодій, які ми опишемо на цьому уроці.
|
|
|
п |
|
|---|---|---|---|
| іони | Куломбічний | - | 1 |
| іон - полярна молекула | іон-диполь | - | 2 |
| дві полярні молекули | диполь-диполь | - | 3 |
| іон - неполярна молекула | іон - індукований диполь | - | 4 |
| полярна і неполярна молекула | диполь - індукований диполь | - | 6 |
| неполярні молекули | дисперсія | - | 6 |
| відбиття | квантової | 9 | - |
| Примітка: взаємодія синіх відтінків відома разом як взаємодія ван дер Ваальса | |||
Універсальна сила відштовхування
Значення сили відштовхування\(n\) на малюнку\(\PageIndex{3}\) дорівнює 9; це може бути найвищий закон зворотної потужності, який можна знайти в природі. Величина такої сили мізерно мала до тих пір, поки частинки не будуть майже в прямому контакті, але як тільки вона стукає, вона стає дуже сильною; якщо ви хочете відчути це, спробуйте вдарити головою в бетонну стіну. Оскільки сила відштовхування - це те, що заважає двом атомам займати один і той же простір, це саме те, що ви очікуєте. Якби сила відштовхування не завжди вигравала у всіх привабливих сил, вся матерія зруйнувалася б в один величезний глоб! Універсальна сила відштовхування виникає безпосередньо з двох основних аспектів квантової теорії.
- По-перше, принцип невизначеності Гейзенберга говорить нам, що електрони, розташовані в межах атома, мають кінетичну енергію, яка чинила б зовнішній тиск, якби не компенсуюча сила привабливого позитивно зарядженого ядра. Але навіть дуже незначне зменшення обсягу, яке було б результатом стиснення атома в менший простір, підвищить цей тиск, щоб ефективно протистояти цій зміні обсягу. Це основна причина того, що конденсовані стани речовини мають надзвичайно малу стисливість.
- Працюючи разом з цим, принцип виключення Паулі, кожен електрон повинен мати різний набір квантових чисел. Таким чином, коли дві частинки починають вторгатися один на одного, обсяг, який займають їх електрони, ділиться між кожною спіновою парою, і ті, що вимушені у вищі квантові стани, як правило, займають ще більші обсяги. Ефект знову полягає в масовому підвищенні потенційної енергії, оскільки частинки починають стискати занадто близько один до одного.
У чудовій статті (Science 187 605-612 1975) фізик Віктор Вайскопф показав, як ці міркування в поєднанні з кількома фундаментальними константами призводять до реалістичних оцінок таких речей, як твердість і стисливість твердих тіл, висоти гір, довжини океанських хвиль і розмірів зірок.
Іон-іонні взаємодії
Електростатичне тяжіння між електрично зарядженими частинками є найсильнішим з усіх міжмолекулярних сил. Ці кулонівські сили (як їх часто називають) викликають протилежні заряди притягувати і подібні заряди для відбиття.


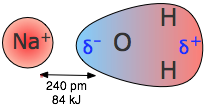
Куломбічні сили беруть участь у всіх формах хімічного зв'язку; коли вони діють між окремими зарядженими частинками (іонно-іонні взаємодії), вони особливо сильні. Таким чином, енергія, необхідна для витягування моля Na + і Cl — іонів на частини в кристалі хлориду натрію, більша, ніж необхідна для розриву ковалентного зв'язку в\(H_2\) (рис.\(\PageIndex{1}\)). Ефекти іонно-іонного тяжіння спостерігаються найбільш безпосередньо в твердих тілах, таких як NaCl, які складаються з протилежно заряджених іонів, розташованих у двох взаємопроникаючих кристалічних решітках.
Згідно із Законом Кулона сила між двома зарядженими частинками задається
\[ F= \dfrac{q_1q_2}{4\pi\epsilon_0 r^2} \label{7.2.2}\]
Замість використання одиниць СІ хіміки часто вважають за краще виражати відстані атомних масштабів у пікометрах та зарядах як електронний заряд (± 1, ± 2 тощо) Використовуючи ці одиниці, константа\(1/4\pi\epsilon\) пропорційності виробляється до\(2.31 \times 10^{16}\; J\; pm\). Знак\(F\) визначає, чи буде сила привабливою (—) або відштовхувальною (+); зверніть увагу, що остання є випадком, коли два q мають однаковий знак.
Рівняння\(\ref{7.2.2}\) є прикладом зворотного закону квадрата; сила падає як квадрат відстані. Подібний закон регулює спосіб, яким освітлення падає, коли ви віддаляєтеся від точкового джерела світла; нагадайте про це наступного разу, коли ви йдете від вуличного світла вночі, і у вас буде певне відчуття того, що означає зворотний квадратний закон.
Чим сильніше сила притягання, що діє між двома частинками, тим більший обсяг роботи, необхідний для їх розділення. Робота являє собою потік енергії, тому вищевикладене твердження є ще одним способом сказати, що коли дві частинки рухаються у відповідь на силу, їх потенційна енергія знижується. Ця робота, як ви пам'ятаєте, якщо ви вивчали елементарну механіку, виявляється шляхом інтеграції негативної сили щодо відстані за переміщену відстань. Таким чином, енергія, яка повинна подаватися для того, щоб повністю відокремити дві протилежно заряджені частинки спочатку на відстані r 0, задається
\[ w= - \int _{r_o} ^{\infty} \dfrac{q_1q_2}{4\pi\epsilon_0 r}dr =- \dfrac{q_1q_2}{4\pi\epsilon_0 r_o} \label{7.2.3}\]
Коли хлорид натрію розплавляється, частина іонних пар випаровується і утворює нейтральні молекули NaCl. Скільки енергії буде виділено, коли один моль Na + і Cl — іонів об'єднані таким чином?
Рішення
Вивільняється енергія буде такою ж, як і робота, необхідна для розділення
\[ \begin{align*} E &= \dfrac{(2.31 \times 10^{16} J pm) (+1) (–1)}{276\; pm} \\[4pt] &= –8.37 \times 10^{–19}\; J \end{align*} \]
Іонно-іонна взаємодія є найпростішим з електростатичних взаємодій та інших взаємодій вищого порядку існує, як обговорюється нижче.
Диполі
Згідно із законом Кулона (Рівняння\(\ref{7.2.1}\)), електростатична сила між іоном і незарядженою частинкою, що має Q = 0, повинна дорівнювати нулю. Майте на увазі, однак, що ця формула передбачає, що дві частинки є точковими зарядами, що мають нульові радіуси. Справжня частинка, така як атом або молекула, займає певний обсяг простору. Навіть якщо електричні заряди протонів і електронів скасовуються (як це буде в будь-якому нейтральному атомі або молекулі), можливо, що просторовий розподіл електронної хмари, що представляє найбільш вільно пов'язані [валентні] електрони, може бути асиметричним, породжуючи електричний дипольний момент . Існує два види дипольних моментів:
- Постійні електричні дипольні моменти можуть виникати, коли відбувається зв'язок між елементами різної електронегативності.
- Індуковані (тимчасові) дипольні моменти створюються, коли зовнішнє електричне поле спотворює електронну хмару нейтральної молекули.
Електричний диполь відноситься до поділу електричного заряду. Ідеалізований електричний диполь складається з двох точкових зарядів величиною + q та — q, розділених відстанню r. Незважаючи на те, що загальна система електрично нейтральна, поділ заряду породжує електростатичний ефект, сила якого виражається електричним дипольним моментом, заданим
\[μ = q \times r \label{\(\PageIndex{5}\)}\]
Дипольні моменти мають як величину, так і напрямок, і, таким чином, є векторними величинами; вони умовно представлені стрілками, голови яких знаходяться на негативному кінці.
Постійні дипольні моменти
Їх зазвичай називають просто «дипольними моментами». Найвідоміша молекула, що має дипольний момент, - звичайна вода. Дисбаланс заряду виникає тому, що кисень, з його ядерним зарядом 8, тягне електронну хмару, яка містить кожен зв'язок O—H до себе. Ці два «моменти зв'язку» додають векторно, щоб створити постійний дипольний момент, позначений червоною стрілкою. Зверніть увагу на використання символу δ (грецька дельта) для позначення позитивних і негативних кінців диполів.
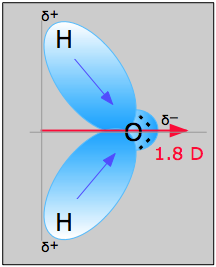
Коли електричний диполь піддається зовнішньому електричному полю, він буде схильний орієнтуватися таким чином, щоб мінімізувати потенційну енергію; тобто його негативний кінець буде, як правило, вказувати на вищий (більш позитивний) електричний потенціал. У рідинях теплові рухи будуть діяти, щоб порушити це впорядкування, тому загальний ефект залежить від температури. У конденсованих фазах локальні поля, обумовлені сусідніми іонами або диполями в речовині, відіграють важливу роль у визначенні фізичних властивостей речовини, і саме в цьому контексті для нас тут цікавлять диполярні взаємодії. Ми обговоримо кожен вид взаємодії в порядку зменшення сили.
Індуковані диполі
Навіть якщо молекула електрично нейтральна і не має постійного дипольного моменту, на неї все одно може впливати зовнішнє електричне поле. Оскільки всі атоми і молекули складаються з заряджених частинок (ядер і електронів), електричне поле сусіднього іона призведе до зміщення центрів позитивних і негативних зарядів в протилежних напрямках. Цей ефект, який називається поляризацією, призводить до створення тимчасового, або індукованого дипольного моменту. Потім індукований диполь взаємодіє з видами, які його виробляли, що призводить до чистого тяжіння між двома частинками.
Чим більше атом або іон, тим вільніше утримуються його зовнішні електрони, і тим легше буде електронна хмара спотворюється зовнішнім полем. Величина, відома як поляризуваність, виражає величину тимчасового диполя, який може бути індукований в ньому сусіднім зарядом.
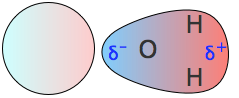
Іонно-дипольні взаємодії
Диполь, близький до позитивного або негативного іона, буде орієнтуватися так, що кінець, частковий заряд якого протилежний іонному заряду, буде вказувати на іон. Цей вид взаємодії дуже важливий у водних розчині іонних речовин; Н 2 О - високополярна молекула, так що в розчині хлориду натрію, наприклад, іони Na + будуть обволікати оболонкою молекул води з їх кисневими кінцями, спрямованими на ці іони, тоді як молекули H 2 O, що оточують іони Cl, матимуть свої водневі кінці, спрямовані всередину. Як наслідок іонно-дипольних взаємодій, всі іонні види у водному розчині гідратовані; саме це позначається суфіксом у формулах, таких як K + (aq) тощо.
Сила іонно-дипольного тяжіння залежить від величини дипольного моменту і від щільності заряду іона. Ця остання величина якраз і є зарядом іона, поділеним на його обсяг. Завдяки меншим розмірам позитивні іони, як правило, мають більшу щільність заряду, ніж негативні іони, і вони повинні бути сильніше гідратовані у водному розчині. Іон водню, будучи не що інше, як оголений протон надзвичайно малого обсягу, має найвищу щільність заряду будь-якого іона; саме з цієї причини він повністю існує у своїй гідратованій формі H 3 O + у воді.
Дипольно-дипольні взаємодії
Коли два диполя наближаються один до одного, вони, як правило, орієнтуються так, щоб їх протилежно заряджені кінці були сусідами. Можливі два таких домовленості: диполі можуть бути поруч, але спрямовані в протилежні сторони, або вони можуть бути кінцем до кінця. Можна показати, що наскрізне розташування дає меншу потенційну енергію.

Дипольно-дипольне тяжіння слабше, ніж іонно-дипольне тяжіння, але воно все ще може мати значні наслідки, якщо дипольні моменти великі. Найважливішим прикладом дипольно-дипольного залучення є водневий зв'язок.
Іонно-індуковані дипольні взаємодії
Найбільш значні індуковані дипольні ефекти виникають внаслідок сусідніх іонів, зокрема катіонів (позитивних іонів). Поруч іони можуть спотворювати електронні хмари навіть у полярних молекулах, тим самим тимчасово змінюючи свої дипольні моменти. Більші іони (особливо негативні, такі як SO 2 — і ClO 4 2—) мають високу поляризацію, і дипольні моменти, індуковані в них катіоном, можуть відігравати домінуючу роль у формуванні сполук.

Дипольно-індуковані дипольні взаємодії
Постійний диполь може викликати тимчасовий у виду, який зазвичай неполярний, і, таким чином, виробляти чисту привабливу силу між двома частинками (рис.\(\PageIndex{9}\)). Цей потяг зазвичай досить слабкий, але в декількох випадках може привести до утворення нещільно зв'язаних з'єднань. Цей ефект пояснює інакше дивовижне спостереження, що найрізноманітніші нейтральні молекули, такі як вуглеводні, і навіть деякі елементи благородного газу, утворюють стабільні гідратні сполуки з водою.
Дисперсія (Лондон) Сили
Той факт, що елементи благородного газу і повністю неполярні молекули, такі як H 2 і N 2, можуть бути конденсовані до рідин або твердих тіл, говорить нам про те, що між частинками має бути ще одне джерело тяжіння, яке не залежить від існування постійних дипольних моментів ні в одному. частка (рис.\(\PageIndex{10}\)). Щоб зрозуміти походження цього ефекту, необхідно усвідомити, що коли ми говоримо, що молекула «неполярна», ми дійсно маємо на увазі, що усереднений за часом дипольний момент дорівнює нулю. Це той самий вид усереднення, який ми робимо, коли малюємо картину орбіти, яка представляє всі місця в просторі, в яких електрон можна знайти з певною мінімальною ймовірністю. Однак у дуже короткому часовому масштабі електрон повинен бути все більш локалізованим; навіть квантова механіка не дозволяє йому перебувати в більш ніж одному місці в будь-який момент. Як наслідок, немає гарантії, що розподіл негативного заряду навколо центру атома буде ідеально симетричним у кожну мить; тому кожен атом має слабкий коливальний дипольний момент, який постійно зникає і знову з'являється в іншому напрямку.

Дисперсійні або лондонські сили можна вважати «спонтанними дипольними - індукованими дипольними» взаємодіями.
Хоча ці надзвичайно короткочасні коливання швидко середні до нуля, вони все ще можуть викликати нові диполі в сусідньому атомі або молекулі, що допомагає підтримувати початковий диполь і породжує слабку привабливу силу, відому як дисперсія або лондонська сила. Хоча сили розсіювання є найслабшими з усіх міжмолекулярних атракціонів, вони присутні повсюдно. Їх сила багато в чому залежить від кількості електронів в молекулі. Це добре видно, подивившись на елементи благородного газу в таблиці\(\PageIndex{2}\), здатність яких конденсуватися до рідин і замерзати до твердих тіл повністю залежить від сил дисперсії.
| елемент | Він | Ne | Ар | Кр | Xe |
|---|---|---|---|---|---|
| атомний номер | 2 | 10 | 18 | 36 | 54 |
| Температура кипіння, К | 27 | 87 | 120 | 165 | 211 |
| критична температура, К | 5 | 44 | 151 | 209.5 | 290 |
| теплота пароутворення, кДж моль —1 | 0,08 | 1.76 | 6.51 | 59 | 12.6 |
Важливо зазначити, що сили дисперсії є адитивними; якщо дві подовжені молекули опиняються поруч, атракціони сили дисперсії будуть існувати вздовж областей, де дві молекули знаходяться близько. Це може виробляти досить сильні атракціони між великими полімерними молекулами навіть при відсутності будь-яких сильніших привабливих сил.
«Ван дер Ваальс» сили - це улов всіх термінів
Хоча неполярні молекули аж ніяк не рідкість, багато видів молекул мають постійні дипольні моменти, тому рідини та тверді речовини, що складаються з цих видів, будуть утримуватися разом комбінацією диполь-дипольних, диполь-індукованих дипольних і дисперсійних сил. Ці слабші сили (тобто ті, що відрізняються від куломбічних атракціонів) відомі колективно як сили ван дер Ваальса. До них відносяться тяжіння і відштовхування між атомами, молекулами і поверхнями, а також інші міжмолекулярні сили. Термін включає в себе:
- сила між двома постійними диполями та моментами вищого порядку, як квадруполь
- сила між постійним диполем і відповідним індукованим диполем
- сила між двома миттєво індукованими диполями (сили дисперсії)
Таблиця\(\PageIndex{3}\) показує деякі оцінки внесків різних типів сил ван дер Ваальса, які діють між кількома різними типами молекул. Особливо зверніть увагу на те, наскільки важливі сили розсіювання у всіх цих прикладах, і як це, в свою чергу, залежить від поляризуемости.
|
|
|
|
|
|
|
|
|---|---|---|---|---|---|---|
| Ар | —186 | 0 | 1.6 | 0 | 0 | 100 |
| КО | —190 | 0.1 | 2.0 | 0 | 0 | 100 |
| HCl | —84 | 1.0 | 2.6 | 4.2 | 14.4 | 81.4 |
| HBr | —67 | 0.8 | 3.6 | 2.2 | 3.3 | 94.5 |
| ПРИВІТ | —35 | 0.4 | 5.4 | 0.4 | 0.1 | 99.5 |
| NH 3 | -33 | 1.5 | 2.6 | 5.4 | 44.6 | 50.0 |
| Н 2 О | 100 | 1.8 | 1.5 | 4.0 | 77.0 | 19,0 |
