1.2: Ізотопи
- Page ID
- 25772
Хоча всі атоми елемента мають однакову кількість протонів, атоми можуть відрізнятися кількістю нейтронів, які вони мають (табл. 1-2). Ці різні атоми одного і того ж елемента називаються ізотопами. Чотири ізотопи гелію (He) показані на малюнку 1-1. Всі атоми хлору (Cl) мають 17 протонів, але є ізотопи хлору, що мають від 15 до 23 нейтронів. У природі існує лише два ізотопи хлору, що мають 18 нейтронів (75,53% усіх атомів хлору, що містяться в природі), і ті, що мають 20 нейтронів (24,47%). Щоб написати символ ізотопу, помістіть атомний номер як індекс, а масове число (протони плюс нейтрони) як верхній індекс ліворуч від атомного символу. Символи для двох природних ізотопів хлору тоді буде Cl і
Cl і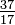 Cl. Власне кажучи, індекси непотрібні, так як всі атоми хлору мають 17 протонів. Звідси ізотопні символи зазвичай пишуться без індексу: 35 Cl і 37 Cl. При обговоренні цих ізотопів використовують. терміни хлор-35 і хлор-37. Щоб ядро було стабільним, кількість нейтронів має (для перших кількох елементів) дорівнювати або трохи перевищувати кількість протонів. Чим більше протонів, тим більше співвідношення нейтронів до протонів для забезпечення стабільності. Ядра, які мають занадто багато будь-якого виду фундаментальних частинок, нестабільні і руйнуються радіоактивно способами, які обговорюються в главі 23.
Cl. Власне кажучи, індекси непотрібні, так як всі атоми хлору мають 17 протонів. Звідси ізотопні символи зазвичай пишуться без індексу: 35 Cl і 37 Cl. При обговоренні цих ізотопів використовують. терміни хлор-35 і хлор-37. Щоб ядро було стабільним, кількість нейтронів має (для перших кількох елементів) дорівнювати або трохи перевищувати кількість протонів. Чим більше протонів, тим більше співвідношення нейтронів до протонів для забезпечення стабільності. Ядра, які мають занадто багато будь-якого виду фундаментальних частинок, нестабільні і руйнуються радіоактивно способами, які обговорюються в главі 23.

Приклад 1.2.1
Скільки протонів, нейтронів і електронів в атомі найстійкішого ізотопу урану - урану-238? Напишіть символ цього ізотопу. Зверніться до рис. 1-1.
Рішення
Атомний номер урану (див. Внутрішню задню кришку) дорівнює 92, а масове число ізотопу дано як 238. Звідси він має 92 протони, 92 електрона, а 238 - 92 = 146 нейтронів. Його символ - U (або 238 U).
U (або 238 U).
Загальна маса атома називається його атомною масою, і це майже, але не точно сума мас складових його протонів, нейтронів і електронів. * Коли протони, нейтрони і електрони об'єднуються, утворюючи атом, частина їх маси перетворюється в енергію і віддається. (Це джерело енергії в реакціях ядерного синтезу.) Оскільки атом не може бути розщеплений на його основні частинки, якщо енергія для відсутньої маси не подається ззовні, ця енергія називається енергією зв'язку ядра.
Примітка: Атомна вага проти атомної маси
Терміни атомна маса і молекулярна маса повсюдно використовуються працюючими вченими і будуть використовуватися в цій книзі, хоча це технічно маси, а не ваги.
| Електрони | протони | Нейтрони |
Атомний Число |
Атомна вага (аму) |
Загальний заряд (електронні одиниці) |
|
|---|---|---|---|---|---|---|
| Атом водню, 1 Н або Н | 1 | 1 | 0 | 1 | 1.008 | 0 |
| Атом дейтерію, 2 Н або D | 1 | 1 | 1 | 1 | 2.014 | 0 |
| Атом тритію, 3 Н або Т | 1 | 1 | 2 | 1 | 3.016 | 0 |
| Іон водню, Н + | 0 | 1 | 0 | 1 | 1.007 | +1 |
| Атом гелію, 4 He | 2 | 2 | 2 | 2 | 4.003 | 0 |
| Гелієве ядро або альфа-частинка, He 2+ або α | 0 | 2 | 2 | 2 | 4.002 | +2 |
| Атом літію, 7 Li | 3 | 3 | 4 | 3 | 7.016 | 0 |
| Атом вуглецю, 12 Ca | 6 | 6 | 6 | 6 | 12.000 | 0 |
| Атом кисню, 16 О | 8 | 8 | 8 | 8 | 15.995 | 0 |
| Атом хлору, 35 Cl | 17 | 17 | 18 | 17 | 34.969 | 0 |
| Атом хлору, 37 Cl | 17 | 17 | 20 | 17 | 36.966 | 0 |
| Природна суміш хлору | 17 | 17 | 18 або 20 | 17 | 35.453 | 0 |
| Атом урану, 234 U | 92 | 92 | 142 | 92 | 234.04 | 0 |
| Атом урану, 235 U | 92 | 92 | 143 | 92 | 235.04 | 0 |
| Атом урану, 238 U | 92 | 92 | 146 | 92 | 238.05 | 0 |
| Природна суміш урану | 92 | 92 | різноманітні | 92 | 238.03 | 0 |
Приклад 1.2.2
Обчисліть масу, яка втрачається при утворенні атома вуглецю-12 з протонів, електронів і нейтронів.
Рішення
Оскільки атомний номер кожного атома вуглецю дорівнює 6, вуглець-12 має 6 протонів і, отже, 6 електронів. Щоб знайти кількість нейтронів, віднімаємо кількість протонів з числа маси: 12 - 6 = 6 нейтронів. Ми можемо використовувати дані таблиці 1-1 для обчислення загальної маси цих частинок:
-
-
-
Протони: 6 Х 1,00728 аму = 6,04368 аму Нейтрони: 6 Х 1,00867 аму = 6,05202 аму Електрони: 6 Х 0,00055 аму = 0,00330 аму Загальна маса частинок: 12,09900 ам
-
-
Але за визначенням шкали одиниць атомної маси маса одного атома вуглецю-12 дорівнює рівно 12 аму. Звідси 0.0990 аму маси зникло в процесі побудови атома з його частинок.
Приклад 1.2.3
Обчисліть очікувану атомну масу ізотопу хлору, який має 20 нейтронів. Порівняйте це з фактичною атомною масою цього ізотопу, як наведено в таблиці 1-2.
Рішення
Ізотоп хлору має 17 протонів і 20 нейтронів:
-
-
-
Протони: 17 Х 1,00728 ам = 17 1238 грн. Нейтрони: 20 Х 1,00867 ам = 20 1734 грн Електрони: 17 Х 0,00055 ам = 0,0094 сум Загальна маса частинок: 37 3066 грн Фактична спостережувана атомна маса: 36 966 грн Втрата маси: 0 341 аму
-
-
Кожен ізотоп елемента характеризується атомним номером (загальним числом протонів), масовим числом (загальною кількістю протонів і нейтронів) і атомною масою (масою атома в атомних одиницях маси). Оскільки масові втрати при утворенні атома невеликі, масове число зазвичай збігається з атомною масою, округленою до найближчого цілого числа. (Наприклад, атомна маса хлору-37 становить 36,966, яка округлена до 37.) Якщо в природі існує кілька ізотопів елемента, то, звичайно, експериментально спостерігається атомна маса (природна атомна вага) буде середньозваженим вагами ізотопів. Середнє значення зважується відповідно до процентної чисельності ізотопів. Хлор зустрічається в природі як 75,53% хлор-35 (34,97 аму) і 24,47% хлор-37 (36,97 аму), тому середньозважений вага ізотопу становить
\[(0.7553 \times 34.97 \;amu) + (0.2447 \times 36.97\; amu) = 35.46\; amu\]
Атомні ваги, наведені всередині задньої обкладинки цієї книги, - це всі середні зважених ізотопів, що відбуваються в природі, і це цифри, які ми будемо використовувати відтепер, якщо ми спеціально не обговорюємо один ізотоп. Всі ізотопи елемента поводяться однаково хімічно здебільшого. Їх поведінка буде відрізнятися щодо чутливих до маси властивостей, таких як швидкість дифузії, які ми розглянемо далі в цій книзі.
Приклад 1.2.4
Магній (Mg) має три значущих природних ізотопи: 78,70% всіх атомів магнію мають атомну масу 23,985 аму, 10,13% мають атомну масу 24,986 аму, а 11,17% мають атомну масу 25,983 аму. Скільки протонів і нейтронів присутній в кожному з цих трьох ізотопів? Як ми пишемо символи для кожного ізотопу? Нарешті, яке середнє зваження атомних ваг?
Рішення
У всіх ізотопах магнію 12 протонів. Ізотоп, атомна маса якого становить 23,985 аму, має масове число 24 (протони і нейтрони), тому 24 - 12 протонів дає 12 нейтронів. Символ цього ізотопу - 24Mg. Аналогічно ізотоп, атомна маса якого становить 24,986 аму, має масове число 25, 13 нейтронів і 25Mg як символ. Третій ізотоп (25.983 amu) має масове число 26, 14 нейтронів і 26Mg як символ. Розрахуємо середню атомну масу наступним чином:
-
- (0,7870 Х 23,985) + (0,113 Х 24,986) + (0,117 Х 25,983) = 24,31 ранку
Приклад 1.2.5
Бор має два природних ізотопи, LO B і 11 B. Ми знаємо, що 80.22% його атомів 11 B, атомна вага 11.009 amu. З природної атомної ваги, наведеної на внутрішній задній кришці, обчисліть атомну вагу ізотопу LO B.
Рішення
Якщо 80,22% всіх атомів бору складають 11 В, то 100,00 - 80,22, або 19,78%, є невідомим ізотопом. Ми можемо використовувати W для представлення невідомої атомної ваги в нашому обчисленні:
-
- (0,8022 Х 11,009) + (0,1978 Х Ш) = 10,81 аму (природна атомна вага)
- W
 = 10,01 аму
= 10,01 аму