1.6: Іони
- Page ID
- 25777

Ідея ковалентного зв'язку передбачає рівний розподіл електронної пари зв'язаними атомами, але коротке обговорення полярності в розділі 1-4 вказувало на те, що поділ не завжди рівний. Відносна електронегативність або сила, що притягує електрони атомів, має велике значення для пояснення хімічної поведінки, і детально розглядається в главах 9 і 10. Атоми натрію (і всі метали взагалі) мають слабке утримання електронів, тоді як атоми хлору дуже електронегативні. Звідси в звичайній кухонній солі (хлорид натрію, NaCl) кожен атом натрію, Na, втрачає один електрон (е -) з утворенням іона натрію, Na +. Кожен атом хлору підхоплює один електрон, щоб стати іоном хлориду, Cl -:
-
- Na → Na + e - слово і слово
 Cl 2 + e - → Cl -
Cl 2 + e - → Cl -
- Na → Na + e - слово і слово
Ми пишемо Cl 2, оскільки вільний хлорний газ існує як двоатомні (двоатомні) молекули, а не як вільні атоми хлору. Твердий хлорид натрію (рис. 1-5) має іони натрію і хлориду, упаковані в тривимірну решітку таким чином, що кожен позитивний іон Na + оточений з чотирьох сторін і зверху і знизу негативними Cl - іонами, а кожен Cl - аналогічно оточений шістьма найближчими сусід Na + іони. Це особливо стійке розташування позитивних і негативних зарядів.
Cl 2, оскільки вільний хлорний газ існує як двоатомні (двоатомні) молекули, а не як вільні атоми хлору. Твердий хлорид натрію (рис. 1-5) має іони натрію і хлориду, упаковані в тривимірну решітку таким чином, що кожен позитивний іон Na + оточений з чотирьох сторін і зверху і знизу негативними Cl - іонами, а кожен Cl - аналогічно оточений шістьма найближчими сусід Na + іони. Це особливо стійке розташування позитивних і негативних зарядів.
Метали взагалі втрачають один-три електрони легко перетворюються на позитивно заряджені іони, або катіони:
-
-
Лі → Лі + + е - ттт літій-іонний Na → Na + + е - ттт іон натрію К → К + + е - ттт іон калію Мг → Мг 2+ + 2 е - ттт іон магнію Ca → Ка 2+ + 2 е - ттт іон кальцію Аль → Аль 3+ + 3 е - ттт іон алюмінію
-
Деякі неметали, навпаки, підбирають електрони, щоб стати негативно зарядженими іонами, або аніонами:
-
-
 Ф 2
Ф 2+ е - → F - ттт іон фтору  Сл 2
Сл 2+ е - → Кл - ттт хлорид-іон  О 2
О 2+ 2 е - → О 2- ттт оксид-іон  S 2
S 2+ 2 е - → S 2- ттт сульфід-іон
-
-
-
-
-
-
-
- Таблиця 1-4 Деякі прості іони елементів
-
-
-
-
-

Інші прості іони, виготовлені з одиночних атомів, наведені в таблиці 1-4. Заряд на простому одноатомному іоні, такому як AP + або S 2- це його ступінь окислення або число окислення. Саме кількість електронів необхідно додати для зменшення (або видалення для окислення) іона до нейтрального виду:
-
- Зменшення: АІ 3+ 3 е - → Al
- Окислення: S 2- → S + 2 е -
Витягування електронів від атома або видалення їх взагалі - це окислення. Додавання електронів до атома або просто зміщення їх до нього - це зменшення.
| Чи окислюється або відновлюється хлор при утворенні іона хлориду? Яка ступінь окислення іона? |
|
Рішення Хлор знижується, оскільки для утворення іона додається один електрон на атом хлору. Хлорид-іон, Cl -, знаходиться в ступені окислення - 1. |
| Коли метали перетворюються в їх іони, вони окислюються або відновлюються? Яка ступінь окислення іона алюмінію? |
|
Рішення Метали окислюються до своїх іонів, так як електрони видаляються. Іон алюмінію, AP +, знаходиться в стані окислення +3. |
Якщо можливі два або більше станів окислення для іона металу, їх диференціюють шляхом написання ступеня окислення римськими цифрами після назви атома. Більш стара номенклатура, все ще використовується, ідентифікує вищу ступінь окислення по закінченню - ic і нижню по - ous. Отже,
-
-
Фе 2+ тт залізо (II) або залізо перерва Фе 3+ тт залізо (III) або залізо Cu + тт мідь (I) або мідь перерва Куб 2+ тт мідь (II) або мідь Нд 2+ тт олово (II) або олово перерва Сн 4+ тт олово (IV) або станнік
-
| Коли іон заліза перетворюється в іон заліза, це окислення або відновлення? Напишіть рівняння для процесу. |
|
Рішення Рівняння Fe 3+ e - → Fe 2+. Процес є редукцією, оскільки додається електрон. |
Сіль - це з'єднання, що складається з позитивних і негативних іонів. Оскільки сіль повинна бути електрично нейтральною, загальний заряд на її позитивних і негативних іоні повинен дорівнювати нулю. Оскільки кожен іон Sn 2+ має заряд +2, для отримання нульового чистого заряду потрібно вдвічі більше іонів хлориду з -1 зарядом. Звідси сіль Sn 2+ і Cl - іонів має загальний склад SnCl 2, а не SnCl або SnCl 3. Його називають хлоридом олова або хлоридом олова (II). Формула хлориду олова або хлориду олова (IV) - SnCl 4.
Крім цих простих іонів, між металом або неметалом і киснем, хлором, аміаком (NH 3), гідроксидним іоном (ОН -) або іншими хімічними групами можуть утворюватися сполучені або складні іони. Сульфат-іон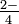 , SO, має чотири кисню в кутах тетраедра навколо центрального атома сірки, і загальний заряд -2. Нітратний іон, NO
, SO, має чотири кисню в кутах тетраедра навколо центрального атома сірки, і загальний заряд -2. Нітратний іон, NO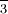 , має три атоми кисню в рівносторонньому трикутнику навколо азоту, і -1 заряд. Іон амонію
, має три атоми кисню в рівносторонньому трикутнику навколо азоту, і -1 заряд. Іон амонію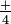 , NH, має чотири водню на кутах тетраедра та +1 заряд. Ці іони розглядаються як одиниці, оскільки вони утворюють солі так, як це роблять одноатомні іони, і проходять багато хімічних реакцій без змін. Нітрат срібла, AgN0 3, являє собою сіль, що містить рівну кількість
, NH, має чотири водню на кутах тетраедра та +1 заряд. Ці іони розглядаються як одиниці, оскільки вони утворюють солі так, як це роблять одноатомні іони, і проходять багато хімічних реакцій без змін. Нітрат срібла, AgN0 3, являє собою сіль, що містить рівну кількість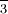 іонів Ag + і NO. Сульфат амонію - це сіль з удвічі більшою кількістю іонів амонію
іонів Ag + і NO. Сульфат амонію - це сіль з удвічі більшою кількістю іонів амонію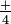 , NH, як сульфат-іони
, NH, як сульфат-іони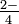 , SO, і хімічна формула (NH 4) 2 S0 4. Інші типові комплексні іони наведені в таблиці 1-5.
, SO, і хімічна формула (NH 4) 2 S0 4. Інші типові комплексні іони наведені в таблиці 1-5.
-
-
-
-
-
-
- Таблиця 1-5 Деякі загальні комплексні іони
-
-
-
-
-

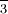 , NO, має місце для трьох атомів кисню навколо нього, і, отже, координаційне число 3 для кисню. Атом сірки більший, ніж атом азоту, і може вмістити ще один атом кисню в сульфат-іоні, SO
, NO, має місце для трьох атомів кисню навколо нього, і, отже, координаційне число 3 для кисню. Атом сірки більший, ніж атом азоту, і може вмістити ще один атом кисню в сульфат-іоні, SO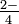 . Звідси координаційне число сірки для кисню дорівнює 4.
. Звідси координаційне число сірки для кисню дорівнює 4.
Найпоширенішими координаційними числами є 2, 3, 4 та 6 (див. Таблицю 1-6.) Іон або молекула з центральним атомом, що має координаційне число 2, може бути як лінійним, як вуглекислий газ з O-C-O по прямій, так і зігнутим, як у воді, H 2 0. Можливі структури іонів або молекул з координаційними номерами 3, 4 і 6 наведені в таблиці 1-6.
-
-
-
-
- Таблиця 1-6 Загальні координаційні номери
-
-
-


-
-
1 натрій: тт 22 990 грн. 1 хлор: тт 35 453 грн. Всього: тт 58 443 грн.
-
| Яка молекулярна маса сульфату амонію? | |||||||||||||||||||||||||
|
Рішення Хімічна формула сульфату амонію є (NH 4) 2 SO 4, тому молекулярна маса (насправді формула ваги)
|
-
-
Сульфат-іон: тт ТАК 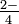
слово Сульфіт-іон: тт ТАК 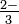
Нітрат іон: тт НІ 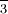
слово Нітрит-іон: тт НІ 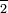
Арсенат іон: тт So 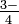
слово Арсеніт-іон: тт So 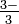
-
Якщо таких аніонів більше двох, то використовуються префікси hypo- («під») і per- («за межами»):
-
-
Перхлорат-іон: тт КЛО 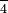
Хлорат-іон: тт КЛО 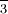
Хлорит-іон: тт КЛО 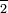
Гіпохлорит іон: тт КЛО 
-
Точки плавлення та температури кипіння солей
Кристал солі являє собою особливо стабільний баланс позитивних і негативних зарядів, при цьому кожен тип іонів утримується подалі від інших подібних зарядів. Плавлення кристала солі означає порушення цього делікатного балансу зарядів і дозволяє взаємно відштовхуючим іонам час від часу зближуватися, коли іони протікають один за одного. Це порушення структури вимагає великої кількості енергії для досягнення, тому температури плавлення солей вище, ніж у молекулярних твердих тіл. Точки плавлення двох солей, хлориду натрію (NaCi) і сульфату калію (K 2 SO 4), порівнюються в таблиці 1-7 з тими з елементів, з яких виготовлені солі.
| Речовина |
Хімічна Формула |
Т м (°C) | Т б (°C) |
|---|---|---|---|
| Метал натрію | Na | 97.8 | 882.9 |
| Газ хлору | Сл 2 | -101.0 | -34.6 |
| Хлорид натрію (сіль) | NaCl | 801 | 1413 |
| Металевий калій | К | 64 | 774 |
| Сірка | S | 119 | 445 |
| Кисневий газ | О 2 | -218 | -183 |
| Сульфат калію (сіль) | К 2 СО 4 | 1069 | 1689 |