15.9: Каталіз
- Page ID
- 105842
- Зрозуміти, як каталізатори підвищують швидкість реакції і вибірковість хімічних реакцій.
Каталізатори - це речовини, які підвищують швидкість реакції хімічної реакції, не витрачаючись в процесі. Таким чином, каталізатор не з'являється в загальній стехіометрії реакції, яку він каталізує, але він повинен з'явитися принаймні в одній з елементарних реакцій в механізмі каталізованої реакції. Каталізований шлях має нижчий Е а, але чиста зміна енергії, що виникає в результаті реакції (різниця між енергією реагентів і енергією продуктів), не впливає наявність каталізатора (рис. е\(\PageIndex{1}\)). Проте через його нижчого Е а швидкість реакції каталізованої реакції швидше, ніж швидкість реакції некаталізованої реакції при тій же температурі. Оскільки каталізатор зменшує висоту енергетичного бар'єру, його наявність збільшує швидкості реакції як прямої, так і зворотної реакцій на однакову величину. У цьому розділі ми розглянемо три основні класи каталізаторів: гетерогенні каталізатори, однорідні каталізатори та ферменти.
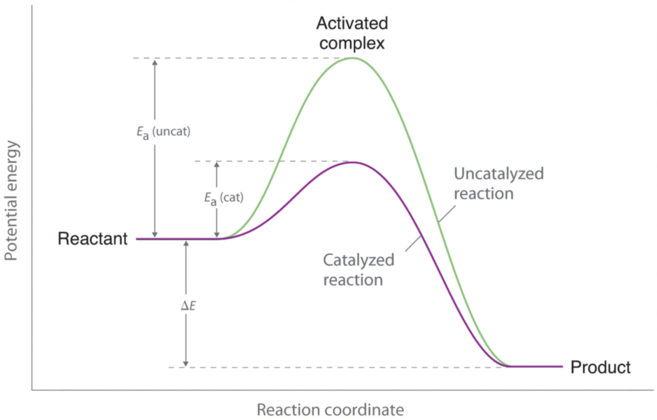
Каталізатор впливає на Е а, а не Δ E.
гетерогенний каталіз
При гетерогенному каталізі каталізатор знаходиться в іншій фазі від реагентів. Принаймні один з реагентів взаємодіє з твердою поверхнею у фізичному процесі, який називається адсорбцією таким чином, що хімічний зв'язок у реагенті стає слабким, а потім розривається. Отрути - це речовини, які необоротно зв'язуються з каталізаторами, запобігаючи адсорбуванню реагентів і тим самим знижуючи або руйнуючи ефективність каталізатора.
Прикладом гетерогенного каталізу є взаємодія газоподібного водню з поверхнею металу, такого як Ni, Pd або Pt. Як показано на частині (а) на малюнку\(\PageIndex{2}\), зв'язки водень - водень розриваються і утворюють окремі адсорбовані атоми водню на поверхні металу. Оскільки адсорбовані атоми можуть переміщатися по поверхні, два атоми водню можуть зіткнутися і утворювати молекулу газу водню, яка потім може залишити поверхню в зворотному процесі, який називається десорбцією. Адсорбовані атоми Н на поверхні металу істотно більш реактивні, ніж молекула водню. Оскільки відносно сильний зв'язок H—H (енергія дисоціації = 432 кДж/моль) вже порушена, енергетичний бар'єр для більшості реакцій H 2 значно нижчий на поверхні каталізатора.
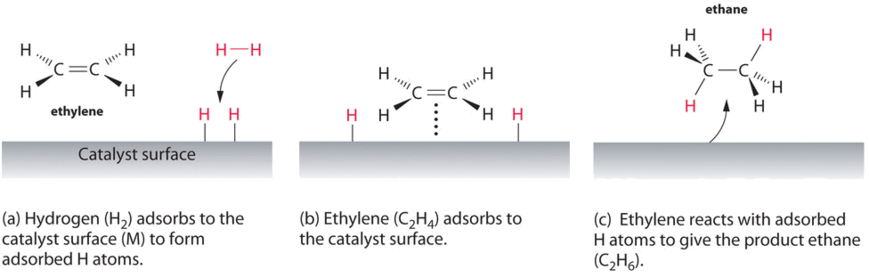
\(\PageIndex{2}\)На малюнку показаний процес, який називається гідруванням, при якому атоми водню додаються до подвійного зв'язку алкену, такого як етилен, щоб отримати продукт, який містить одинарні зв'язки C-C, в даному випадку етан. Гідрування використовується в харчовій промисловості для перетворення рослинних масел, які складаються з довгих ланцюгів алкенів, в більш комерційно цінні тверді похідні, які містять алкільні ланцюги. Гідрування деяких подвійних зв'язків в поліненасичених рослинних оліях, наприклад, виробляє маргарин, продукт з температурою плавлення, текстурою та іншими фізичними властивостями, подібними до властивостей вершкового масла.
Кілька важливих прикладів промислових гетерогенних каталітичних реакцій наведено в табл\(\PageIndex{1}\). Хоча механізми цих реакцій значно складніші, ніж описана тут проста реакція гідрування, всі вони включають адсорбцію реагентів на тверду каталітичну поверхню, хімічну реакцію адсорбованих видів (іноді через ряд проміжних видів) і, нарешті, десорбція виробів з поверхні.
| Комерційний процес | Каталізатор | Початкова реакція | Кінцевий комерційний продукт |
|---|---|---|---|
| контакт процес | В 2 О 5 або Пт | 2СО 2 + О 2 → 2СО 3 | Н 2 ТАК 4 |
| процес Хабера | Фе, К 2 О, Ал 2 О 3 | Н 2 + 3Н 2 → 2Н 3 | NH 3 |
| процес Оствальда | Пт і Rh | 4Н 3 + 5О 2 → 4НО + 6Н 2 О | HNO 3 |
| реакція зсуву вода—газ | Фе, Кр 2 О 3, або Cu | СО + Н 2 О → СО 2 + Н 2 | Н 2 для NH 3, CH 3 OH та інших видів палива |
| парове риформінг | Ni | СН 4+ Н 2 О → СО + 3Н 2 | Н 2 |
| синтез метанолу | ZnO і Ср 2 О 3 | СО + 2Н 2 → СН 3 ОН | СН 3 ОН |
| Процес Сохіо | фосфомолібдат вісмуту | \(\mathrm{CH}_2\textrm{=CHCH}_3+\mathrm{NH_3}+\mathrm{\frac{3}{2}O_2}\rightarrow\mathrm{CH_2}\textrm{=CHCN}+\mathrm{3H_2O}\) | \(\underset{\textrm{acrylonitrile}}{\mathrm{CH_2}\textrm{=CHCN}}\) |
| каталітичне гідрування | Ні, Pd або Pt | РЧ=ЧР′ + Н2 → РЧ 2 —СН 2 R′ | частково гідрогенізовані масла для маргарину та ін. |
Гомогенний каталіз
При гомогенному каталізі каталізатор знаходиться в тій же фазі, що і реагент (и). Кількість зіткнень між реагентами і каталізатором максимальна, оскільки каталізатор рівномірно розсіюється по всій реакційній суміші. Багато однорідних каталізаторів у промисловості є сполуками перехідних металів (Таблиця\(\PageIndex{2}\)), але відновлення цих дорогих каталізаторів з розчину було серйозною проблемою. Як додатковий бар'єр для їх широкого комерційного використання, багато гомогенні каталізатори можуть використовуватися тільки при відносно низьких температурах, і навіть тоді вони мають тенденцію повільно розкладатися в розчині. Незважаючи на ці проблеми, в останні роки був розроблений ряд комерційно життєздатних процесів. Поліетилен високої щільності і поліпропілен отримують шляхом гомогенного каталізу.
| Комерційний процес | Каталізатор | Реагенти | Кінцевий продукт |
|---|---|---|---|
| Союз карбід | [Rh (СО) 2 I 2] − | СО + СН 3 ОН | СН 3 СО 2 Н |
| гідропероксидний процес | Мо (VI) комплекси | СН 3 СН = СН 2 + R—O—O—H | 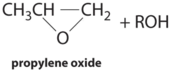 |
| гідроформулювання | РХ/пр 3 комплекси | РЧ=СН 2 + СО + Н 2 | RCH 2 СН 2 ЧО |
| процес адипонітрилу | Нi/пр 3 комплекси | 2ГЦН+ СН 2 = ЧЧ=СН 2 | NCCH 2 CH 2 CH 2 CH 2 CN використовується для синтезу нейлону |
| полімеризація олефінів | (РЦ 5 Н 5) 2 ЗрКЛ 2 | СН 2 = СН 2 | — (CH 2 CH 2 —) n: поліетилен високої щільності |
Ферменти
Ферменти, каталізатори, які зустрічаються природним шляхом в живих організмах, є майже всі білкові молекули з типовими молекулярними масами 20,000—100,000 ам. Деякі з них є однорідними каталізаторами, які реагують у водному розчині в клітинному відділенні організму. Інші - гетерогенні каталізатори, вбудовані в мембрани, які відокремлюють клітини та клітинні відсіки від їх оточення. Реагент в реакції, що каталізується ферментом, називається субстратом.
Оскільки ферменти можуть збільшувати швидкість реакції величезними факторами (до 10 17 разів перевищує некаталізовану швидкість) і, як правило, дуже специфічні, зазвичай виробляючи лише один продукт з кількісним виходом, вони є центром активних досліджень. При цьому ферменти зазвичай дорогі в отриманні, вони часто перестають функціонувати при температурах понад 37° C, мають обмежену стабільність в розчині і мають настільки високу специфічність, що обмежуються перетворенням одного конкретного набору реагентів в один конкретний продукт. Це означає, що окремі процеси з використанням різних ферментів повинні бути розроблені для хімічно схожих реакцій, що займає багато часу і дорого. До цих пір ферменти знайшли лише обмежене промислове застосування, хоча вони використовуються як інгредієнти в пральних порошках, очисниках контактних лінз та м'ясних тендерайзерах. Ферменти в цих додатках, як правило, є протеазами, які здатні розщеплювати амідні зв'язки, які утримують амінокислоти разом у білках. Наприклад, м'ясні тендерайзери містять протеазу під назвою папаїн, яка виділяється з соку папайї. Він розщеплює деякі довгі волокнисті молекули білка, які роблять недорогі нарізки яловичини жорсткими, виробляючи шматок м'яса, який є більш ніжним. Деякі комахи, як жук-бомбадир, несуть фермент, здатний каталізувати розкладання перекису водню на воду (рис.\(\PageIndex{3}\)).

Інгібітори ферменту викликають зниження швидкості реакції каталізованої ферментом реакції шляхом зв'язування з певною порцією ферменту і, таким чином, уповільнення або запобігання виникненню реакції. Тому незворотні інгібітори є еквівалентом отрут при гетерогенному каталізі. Одним з найстаріших і найбільш широко використовуваних комерційних інгібіторів ферментів є аспірин, який вибірково пригнічує один з ферментів, що беруть участь в синтезі молекул, що викликають запалення. Проектування та синтез споріднених молекул, які є більш ефективними, селективними та менш токсичними, ніж аспірин, є важливими завданнями біомедичних досліджень.
Резюме
Каталізатори беруть участь в хімічній реакції і збільшують її швидкість. Вони не з'являються в чистому рівнянні реакції і не витрачаються під час реакції. Каталізатори дозволяють реакції протікати шляхом, який має меншу енергію активації, ніж некаталізована реакція. При гетерогенному каталізі каталізатори забезпечують поверхню, з якою зв'язуються реагенти в процесі адсорбції. При гомогенному каталізі каталізатори знаходяться в тій же фазі, що і реагенти. Ферменти є біологічними каталізаторами, які виробляють значне збільшення швидкості реакції і, як правило, специфічні для певних реагентів і продуктів. Реагент в реакції, що каталізується ферментом, називається субстратом. Інгібітори ферменту викликають зниження швидкості реакції ферментативно-каталізованої реакції.