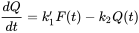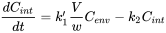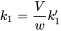4.1: Токсикокінетика
- Page ID
- 18330
4.1. токсикокінетика
Автор: Ніко ван Страален
Рецензент: Кіс ван Гестель
Цілі навчання:
Ви повинні вміти
- Опишіть різницю між токсикокінетикою і токсикодинамікою
- Поясніть використання різних дескрипторів для поглинання хімічних речовин організмами в сталому стані та динамічних умовах
Ключові слова: токсикодинаміка, токсикокінетика, біоакумуляція, токсикокінетичні константи швидкості, критичний залишок тіла, детоксикація
Токсикологія зазвичай розрізняє токсикокінетику і токсикодинаміку. Токсикокінетика включає всі процеси, пов'язані з поглинанням, внутрішнім транспортом і накопиченням всередині організму, тоді як токсикодинаміка займається взаємодією сполуки з рецептором, індукцією захисних механізмів, відновленням пошкоджень та токсичними ефектами. Звичайно, два набори процесів можуть взаємодіяти, наприклад захист може зворотний зв'язок до поглинання, а пошкодження може змінити внутрішній транспорт. Однак часто аналіз токсикокінетики просто фокусується на відстеженні самого хімічного речовини і ігнорує можливі токсичні ефекти. Це тримає до критичного порогу, критичної концентрації тіла, вище якої ефекти стають очевидними і нормальний аналіз токсикокінетики вже не діє. Припущення про те, що показники токсикокінетичної швидкості не залежать від внутрішньої концентрації, обумовлено обмеженою кількістю інформації, яку можна отримати від тварин у навколишньому середовищі. Однак у так званих фізіологічних основаних фармакокінетичних і фармакодинамічних моделями (PBPK моделями) кінетика і динаміка аналізуються як єдине ціле. Однак використання таких моделей здебільшого обмежується ссавцями та людьми.
Необхідно підкреслити, що токсикокінетика враховує потоки і швидкості, тобто мг речовини, що рухається за одиницю часу з одного відсіку в інший. Потоки можуть призвести до динамічної рівноваги, тобто рівноваги, яка обумовлена тим, що приплив дорівнює відтоку; коли розглядаються лише умови рівноваги, це називається розділенням.
У цій главі 4.1 ми розглянемо різні підходи в токсикокінетиці, включаючи потоки токсикантів через окремі організми та через трофічні рівні, а також біологічні процеси, що визначають такі потоки. Почнемо з порівняння концентрацій токсикантів між організмами та їх середовищем (розділ 4.1.1) та між організмами різного трофічного рівня (розділ 4.1.6). Це призводить до відомого поняття біоакумуляції, одне з властивостей речовини, яке часто призводить до екологічних проблем. Хоча в минулому розведення іноді розглядалося як рішення забруднення, це не правильно для біоакумулюючих речовин, оскільки вони можуть з'явитися в іншому місці харчового ланцюга наступного рівня і досягти ще більшої концентрації. Фактор біоакумуляції є однією з найбільш досліджених властивостей, що характеризують екологічну поведінку речовини. Це можна передбачити з властивостей речовини, таких як коефіцієнт поділу октанол-вода.
У розділі 4.1.2 розглянуто класичну теорію кінетики поглинання-елімінації з використанням однокамерної лінійної моделі. Ця теорія є вирішальною частиною токсикологічного аналізу. Одне з перших речей, які ви хочете знати про речовину - це те, як швидко вона потрапляє в організм і як швидко виводиться. Оскільки токсичність є в основному залежним від часу процесом, швидкість обороту внутрішньої концентрації та накопичення залишку залежать від часу експозиції. Тому розуміння токсикокінетики має вирішальне значення для будь-якої інтерпретації експерименту з токсичністю. Параметри швидкості можна частково передбачити з властивостей речовини, але властивості організму тут відіграють набагато більшу роль. Однією з них є просто маса тіла; прогнозування констант швидкості виведення з маси тіла здійснюється за допомогою алометричних залежностей масштабування, досліджених у розділі 4.1.5.
У двох розділах, 4.1.3 та 4.1.4, ми представляємо біологічні процеси, що лежать в основі обороту токсикантів в організмі. Вони дуже різні для металів, ніж для органічних речовин, тому цій темі присвячено два окремих розділи: один про тканинне накопичення металів і один про захисні механізми органічних ксенобіотиків.
Нарешті, якщо ми зрозуміємо всі токсикокінетичні процеси, ми також зможемо зрозуміти, чи залишиться концентрація всередині органу-мішені нижче або просто переходить поріг, який можна переносити. Критична концентрація тіла, досліджена в розділі 4.1.7, є важливою концепцією, що пов'язує токсикокінетику з токсичністю.
Визначте і вкажіть відмінності між
- токсикокінетика
- Токсикодинаміка
- Розбиття на перегородки
- Накопичення
- Біоакумуляція
4.1.1. Біоакумуляція
Автор: Джуп Герменс
Рецензенти: Кіс ван Гестель та Філіп Майер
Цілі навчання:
Ви повинні вміти
- визначити і пояснити різні параметри біоакумуляції.
- Згадайте різні біологічні фактори, які можуть впливати на біоакумуляцію.
Ключові слова: біоакумуляція, вміст ліпідів
Вступ: термінологія для біоакумуляції
Термін біоакумуляція описує перенесення та накопичення хімічної речовини з навколишнього середовища в організм». Для такого хімічного речовини, як гексахлорбензол, концентрація в рибі більш ніж в 10 000 разів вище, ніж у воді, що є наочною ілюстрацією «біоакумуляції». Хімічна речовина, як гексахлорбензол, є гідрофобним, тому має дуже низьку розчинність у воді. Тому він вважає за краще уникнути водної фази, щоб увійти (або розділити на) більш ліпофільну фазу, таку як ліпідна фаза в біоті.
Поглинання може відбуватися з різних джерел. Риби в основному забирають хімічні речовини з водної фази, організми, що живуть у міжфазі осаду та води, піддаються впливу через вищевказані частинки води та осаду, організми, що живуть у ґрунті або осадах через порову воду та ковтаючи ґрунт або осад, тоді як хижаки будуть піддаватися впливу через їжу. У багатьох випадках поглинання пов'язане з більш ніж одним джерелом. Різні шляхи поглинання також відображаються в параметрах та термінології, що використовуються в дослідженнях біоакумуляції. Різні параметри включають фактор біоконцентрації (BCF), фактор біоакумуляції (BAF), фактор біомагніфікації (BMF) та фактор накопичення біоти до осаду або фактор накопичення біоти до ґрунту (BSAF). На малюнку 1 узагальнено визначення цих параметрів. Біоконцентрація відноситься до поглинання з водної фази, біоакумуляції для поглинання як через водну фазу, так і потрапляння осаду або частинок грунту, тоді як біомагніфікація виражає накопичення забруднень з їжі.
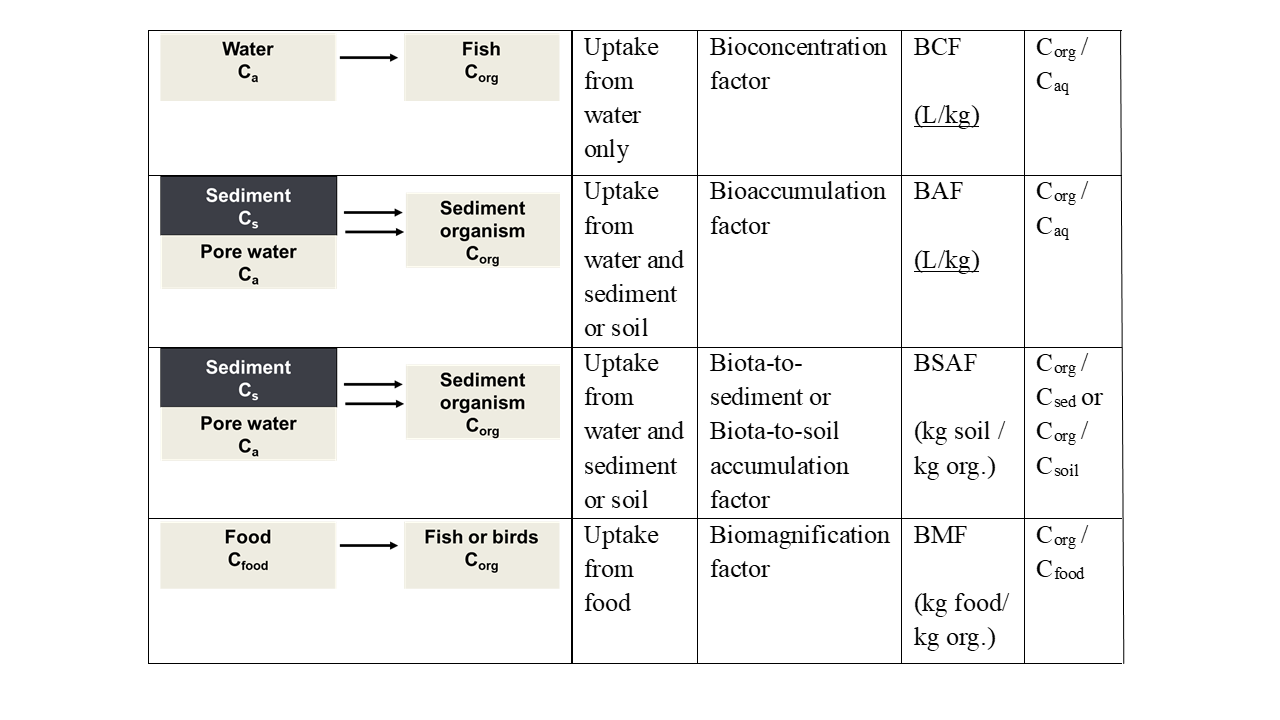
Концентрація C aq у воді (водна фаза)
Концентрація C org в організмі
C f концентрації в їжі
Концентрація C в осаду або грунті
Зверніть увагу, що фактор біоакумуляції (BAF) визначається аналогічно фактору біоконцентрації (BCF), але поглинання може бути як з водної фази, так і з осаду або грунту, і що концентрація експозиції зазвичай виражається на кг сухого осаду або грунту. Можливі й інші визначення BAF, але ми пішли за одним з Mackay et al. (2013). «Фактор біоакумуляції (BAF) тут визначається аналогічно BCF; іншими словами, BAF є CF/CW в стійкому стані, за винятком того, що в цьому випадку риба піддається впливу як води, так і їжі; таким чином, відбувається додатковий вхід хімічної речовини з дієтичного засвоєння».
Всі фактори біоакумуляції є постійними сталими станами: концентрація в організмі постійна і організми знаходяться в рівновазі з навколишньою його фазою. Пройде час, перш ніж буде досягнуто такого стійкого стану. Сталий стан досягається, коли швидкість поглинання (наприклад, з водної фази) дорівнює швидкості елімінації. Моделі, що включають фактор часу при описі поглинання, називаються кінетичними моделями; див. Розділ про кінетику біоакумуляції.
Вплив біологічних властивостей на накопичення
Засвоєння хімічних речовин визначається властивостями як організму, так і хімічного. Для ксенобіотичних ліпофільних хімічних речовин у воді фактори, специфічні для організму, як правило, відіграють незначну роль, і концентрації в організмах можна досить добре передбачити з хімічних властивостей (див. Розділ про взаємозв'язки між структурою та властивістю). Для металів, навпаки, поглинання значною мірою визначається властивостями організму, і прямим наслідком його мінеральних потреб. Хімічна речовина з низькою біодоступністю (низьке поглинання порівняно з концентрацією в експозиційному середовищі) може все ж накопичуватися до високих рівнів, коли організм не здатний виводити або метаболізувати хімічну речовину.
Факторами, пов'язаними з організмом, є:
- Жирність. Оскільки ліпофільні хімічні речовини в основному накопичуються в жирі організмів, розумно припустити, що організми, багаті ліпідними, матимуть більш високі концентрації ліпофільних хімічних речовин. Див. Рис. 2 для прикладу факторів біоконцентрації 1,2,4-трихлорбензолу в ряді організмів з різним вмістом ліпідів. Це було одне з пояснень високого рівня PCB у вугрів (високий вміст ліпідів) у голландських річках та тюленях з Ваттового моря. Тим не менш, великі відмінності все ще зустрічаються між видами, коли концентрації виражаються на ліпідній основі. Це може пояснюватися, наприклад, тим, що ліпіди не всі однакові: ПХБ, здається, краще розчиняються в ліпідах анчоусів, ніж в ліпідах з водоростей (див. Дані в таблиці 1). Також більш пізні дослідження показали, що не всі ліпіди однакові і що відмінності в біоакумуляції між видами можуть бути обумовлені відмінностями в ліпідному складі (Van der Heijden and Jonker, 2011). З цим пов'язана розробка моделей BCF, які засновані на декількох відсіках і які роблять поділ між накопичувальними та мембранними ліпідами, а також включають білкову фракцію як додаткову раковину (Armitage et al., 2013). У цій моделі загальний коефіцієнт розподілу D BW (або BCF) оцінюється за рівнянням 1. Рівняння використовує коефіцієнти розподілу, оскільки модель також «враховує наявність нейтральних та заряджених хімічних видів» (Armitage et al., 2013).
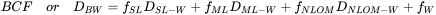
D БВ |
загальний коефіцієнт розподілу організм-вода (або сурогатний BCF) при заданому рН |
Д СЛ-Ш |
накопичувальний коефіцієнт розподілу ліпід-води |
Д МЛ-Ш |
Мембранний коефіцієнт розподілу ліпідно-води |
|
D НЛОМ-Ш |
коефіцієнт сорбції до NLOM (неліпідна органічна речовина, наприклад білки) |
f СЛ |
фракція ліпідів зберігання |
f ML |
фракція мембранних ліпідів |
ф НЛОМ |
фракція неліпідних органічних речовин (наприклад, білків, вуглеводів) |
f Вт |
частка води |
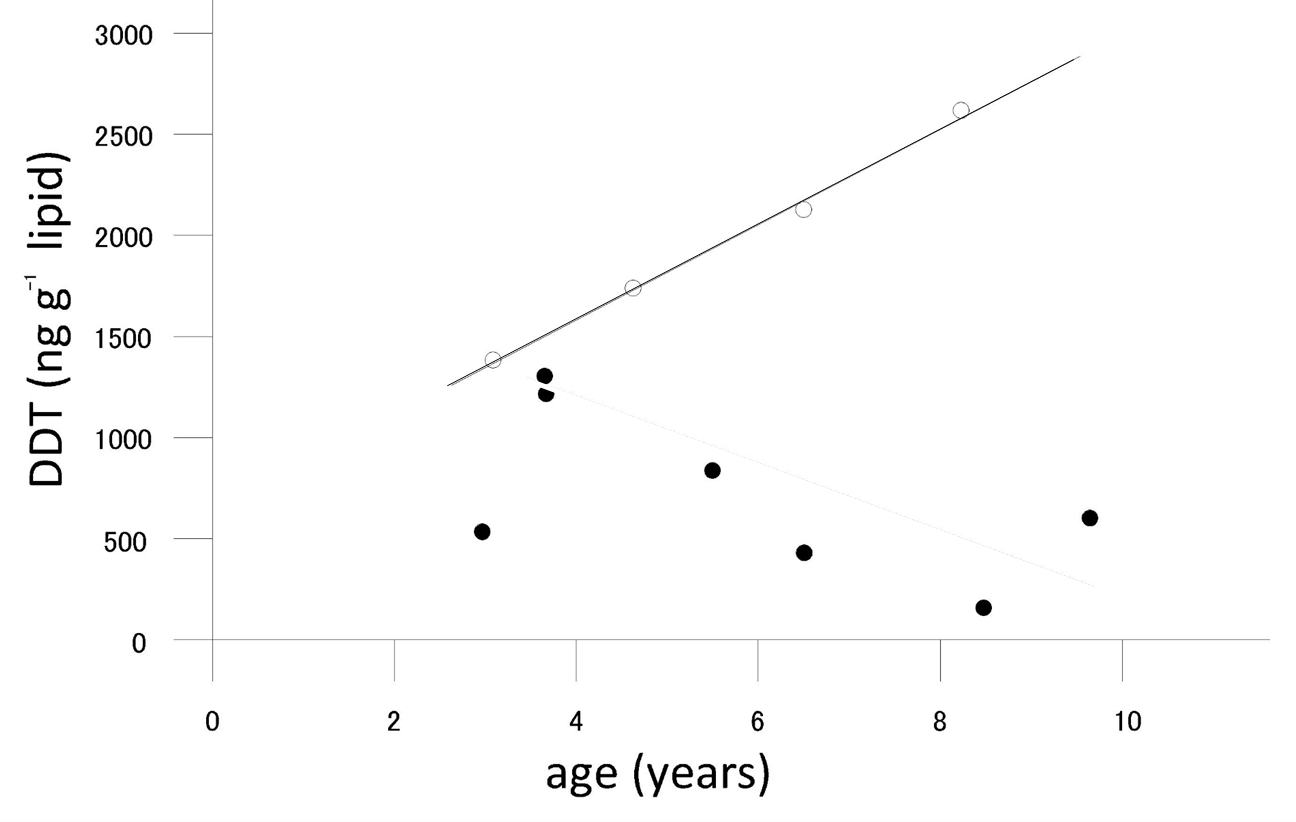
- Стать: Хімічні речовини (такі як ДДТ, ПХБ), накопичені в молочному жирі, можуть передаватися неповнолітнім під час лактації. Це було виявлено у морських ссавців. Таким чином, у самок з'являється додатковий механізм виведення. Типовий приклад показаний на малюнку 3, взятому з дослідження Abarnou et al. (1986) про рівні хлороорганічних сполук в антарктичному дельфіні Cephalorhyncus commersonii. У чоловіків концентрації збільшуються зі збільшенням віку, але концентрації у зрілих самок зменшуються зі збільшенням віку.
- Вага: (маса тіла) організму щодо площі поверхні, по якій відбувається обмін з водною фазою. Менші організми мають більше співвідношення поверхні до обсягу, і обмін з навколишньою водною фазою відбувається швидше. Тому, хоча нормалізовані концентрації ліпідів будуть однаковими при рівновазі, ця рівновага досягається раніше у менших, ніж у більших організмів.
- Різниця в маршруті поглинання. Відносне значення поглинання через шкіру (у риб, наприклад, зябра) та (перорально) поглинання через травну систему. Прийнято вважати, що для більшості вільноживучих організмів пряме поглинання з води домінує над поглинанням після травлення в травному тракті.
- Метаболічна активність. Навіть при однаковій вазі або в тому ж віці баланс між поглинанням і екскрецією може змінюватися через підвищену метаболічну активність, наприклад, в періоди швидкого зростання або високої репродуктивної активності.

Таблиця 1. Середні концентрації ПХБ у водоростях (Dunaliella spec.), гнилі (Brachionus plicatilis) та личинках анчоусів (Angraulis mordax), виражені на сухій вазі та на ліпідній основі. Від Моріарті (1983).
|
Організм |
Вміст ліпідів (%) |
Концентрація друкованої плати на основі сухої ваги (мкг -1) |
Концентрація PCB на основі ваги ліпідів (мкг -1) |
BCF на основі концентрації в ліпідній фазі |
|
водоростей |
6.4 |
0,25 |
3.91 |
0,48 х 10 6 |
|
ротифер |
15,0 |
0,42 |
2.80 |
0,34 х 10 6 |
|
личинки риб (анчоусів) |
7.5 |
2.06 |
27.46 |
13,70 х 10 6 |
Цитуються посилання
Абарну, А., Робіно, Д., Мішель, П. (1986). Хлорорганічне забруднення дельфінів комерсона з островів Кергелен. Океанологічний акт 9, 19-29.
Армітаж, Д.М., Арнот, Ю.А., Ваня, Ф., Маккей, Д. Розробка та оцінка механістичної моделі біоконцентрації іоногенних органічних хімічних речовин у рибі. Екологічна токсикологія та хімія 32, 115-128.
Гейер, Х., Шейнерт, І., Корте Ф. (1985). Взаємозв'язок між вмістом ліпідів риб та їх біоконцентраційним потенціалом 1,2,4-трихлорбензолу. Хемосфера 14, 545-555.
Маккей, Д., Арнот, Д.А., Гобас, Ф., Пауелл, Д.Е. Математичні зв'язки між метриками хімічної біоакумуляції у риб. Екологічна токсикологія та хімія 32, 1459-1466.
Моріарті, Ф. (1983). Екотоксикологія: вивчення забруднюючих речовин в екосистемах. Видавництво: Академічна преса, Лондон.
Ван дер Хейден, С.А., Йонкер, М.Т.О. (2011). Внутрішньо-та міжвидові варіації біоконцентраційного потенціалу поліхлорбіфенілів: чи всі ліпіди рівні? Екологічна наука і технологія 45, 10408-10414.
Пропоноване читання
Маккей, Д., Фрейзер А. Біоакумуляція стійких органічних хімічних речовин: механізми та моделі. Забруднення навколишнього середовища 110, 375-391.
Ван Леувен, C.J., Вермейр, Т.Г. (ред.) (2007). Оцінка ризику хімічних речовин: Вступ. Спрінгер, Дордрехт, Нідерланди. Глава 3.
У чому різниця між BCF і BSAF?
Які основні шляхи поглинання для осадового організму
Які біологічні фактори можуть впливати на біоакумуляцію?
4.1.2. токсикокінетика
Автор: Юп Герменс, Ніко ван Штрален
Рецензенти: Кіс ван Гестель, Філіп Майер
Цілі навчання:
Ви повинні вміти
- згадати основні припущення кінетичних моделей біоакумуляції
- зрозуміти основні рівняння моделі кінетичної біоакумуляції з одним відсіком
- пояснити відмінності між одно- і двокамерними моделями
- згадати, які фактори впливають на константи швидкості в купе моделі
Ключові слова: біоакумуляція, токсикокінетика, моделі купе
У розділі «Біоакумуляція» процес біоакумуляції представлений як процес сталого стану. Відмінності в біоакумуляції між хімічними речовинами виражаються, наприклад, за допомогою фактора біоконцентрації BCF. BCF являє собою співвідношення хімічної концентрації, наприклад, риби проти водної концентрації в ситуації, коли концентрації у воді та рибі не змінюються в часі.
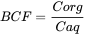 (1)
(1)
де:
Концентрація C aq у воді (водна фаза) (мг/л)
Концентрація С орг в організмі (мг/кг)
Одиниця BCF - л/кг.
Кінетичні моделі
Сталий стан може бути встановлений в простій лабораторній установці, де риби піддаються впливу хімічної речовини при постійній концентрації у водній фазі. З початку експозиції (час 0, або t = 0) знадобиться час, щоб хімічна концентрація в рибі досягла стійкого стану, і в деяких випадках це не буде встановлено протягом періоду експозиції. У навколишньому середовищі концентрації впливу можуть коливатися, і в таких сценаріях постійні концентрації в організмі часто не встановлюються. Сталий стан досягається, коли швидкість поглинання (наприклад, з водної фази) дорівнює швидкості елімінації. Моделі, що включають фактор часу при описі поглинання хімічних речовин організмами, називаються кінетичними моделями.
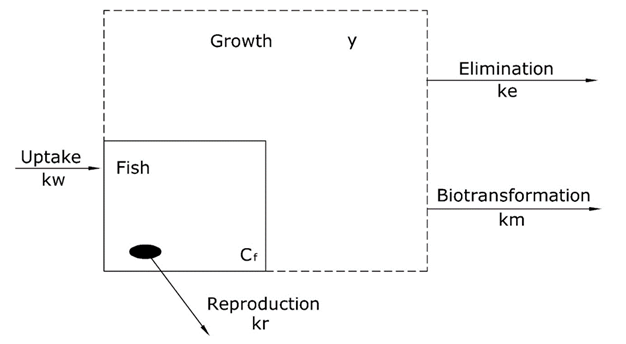
Токсикокінетичні моделі поглинання хімічних речовин в рибу засновані на ряді процесів поглинання і ліквідації. Огляд цих процесів представлений на малюнку 1. У випадку з рибою, основним процесом поглинання є дифузія з навколишнього водного відсіку через зябра до крові. Усунення може здійснюватися за допомогою різних процесів: дифузії через зябра з крові до навколишнього водного відсіку, через передачу потомству або яйцям шляхом розмноження, шляхом росту (розведення) та внутрішньої деградації хімічної речовини (біотрансформація).
Кінетичні моделі для опису поглинання хімічних речовин в організми відносно прості з наступними припущеннями:
Кінетика першого порядку:
Курси обміну пропорційні концентрації. Зміна концентрації з часом (dC/dt) пов'язано з концентрацією і постійною швидкості (k):
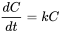 (2)
(2)
Одне відділення:
Часто припускають, що організм складається лише з одного єдиного відсіку і що хімічна речовина однорідно розподіляється всередині організму. Для «простих» дрібних організмів це припущення інтуїтивно справедливо, але для великих риб це припущення виглядає нереальним. Але все ж ця проста модель, здається, добре працює і для риб. Для опису внутрішнього розподілу хімічної речовини всередині риби потрібні більш складні кінетичні моделі, подібні до тих, що застосовуються в дослідженнях ссавців. Ці більш складні моделі є «фізіологічно заснованими токсикокінетичними» (PBTK) моделі (Clewell, 1995; Nichols et al., 2004)
Рівняння кінетики процесу накопичення
Процес накопичення можна охарактеризувати як суму ставок на поглинання та ліквідацію.
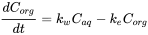 (3)
(3)
Інтеграція цього диференціального рівняння призводить до рівняння 4.
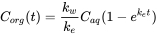 (4)
(4)
Концентрація C org в організмах (мг/кг)
Концентрація C aq у водній фазі (мг/л)
k w постійна швидкість поглинання (л/кг · добу)
k e елімінація постійна швидкість (1/день)
t час (добу)
(Використовувані розміри: кількість хімічної речовини: мг; обсяг води: л; вага організму: кг; час: добу); див.
|
Box: Одиниці токсикокінетичних констант швидкості Диференціальне рівняння, що лежить в основі токсикокінетичного аналізу, в основному є рівнянням балансу маси, що визначає збереження маси Масовий баланс має на увазі, що кількість хімічної речовини виражається в абсолютних одиницях, таких як мг. Якщо Q - кількість у тварині, а F - кількість в екологічному відсіку, то баланс маси читає:
де
Остерігайтеся, що C env вимірюється в інших одиницях (мг на кг грунту або мг на літр води), ніж C int (мг на кг тканини тварин). Щоб позбутися від незручного коефіцієнта В/Вт зручно визначити нову константу швидкості, k 1:
Це постійна швидкість поглинання, про яку зазвичай повідомляють у наукових роботах. Зауважимо, що він має інші одиниці, ніж ПосиланняМоріарті, Ф. (1984) Стійкі забруднення, моделі відсіків та концентрація вздовж харчових ланцюгів. Екологічні бюлетені 36: 35-45. Skip, B., AJ Bednarska, & R.Laskowski (2014) Токсикокінетика металів у наземних безхребетних: виготовлення речей прямо за принципом «один відсік». Лос один (9): e108740. |
Рівняння 4 описує весь процес з відповідним графічним зображенням графа поглинання (рис. 2).

Концентрація в організмі є результатом чистого процесу поглинання і ліквідації. На початковій фазі процесу накопичення елімінація мізерно мала і співвідношення концентрації в організмі задається:
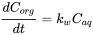 (5)
(5)
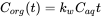 (6)
(6)
Сталий стан
Після більш тривалого часу експозиції усунення стає більш істотним, і крива поглинання починає вирівнюватися. У якийсь момент швидкість поглинання дорівнює швидкості ліквідації, а співвідношення C org/C aq стає постійним. Це ситуація в сталому стані. Константа C org/C aq в сталому стані називається фактором біоконцентрації BCF. Математично БКФ також можна обчислити з
C org/C aq стає постійним. Це ситуація в сталому стані. Константа C org/C aq в сталому стані називається фактором біоконцентрації BCF. Математично БКФ також можна обчислити з k w /k e. Це випливає безпосередньо з рівняння 4: після тривалого часу експозиції (t)
k w /k e. Це випливає безпосередньо з рівняння 4: після тривалого часу експозиції (t) 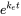 стає 0, що веде до
стає 0, що веде до
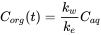
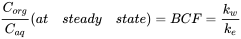 (7)
(7)
ліквідація
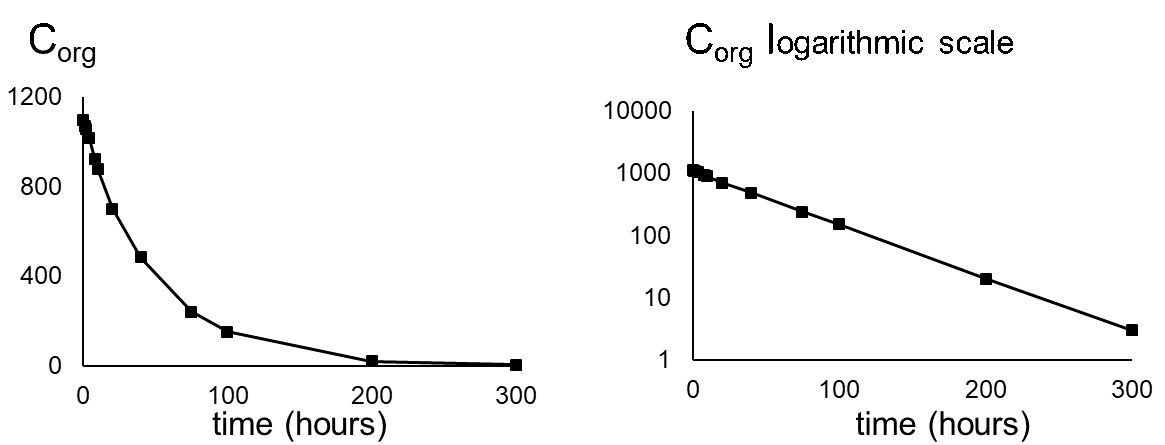
Усунення часто вимірюється після експерименту з поглинання. Після того як організм досягне певної концентрації, риби переносяться в чисте середовище і концентрація в організмі знизиться з часом. Оскільки це також кінетичний процес першого порядку, швидкість елімінації буде залежати від концентрації в організмі (C org) та постійної швидкості елімінації (k e) (див. Рівняння 8). Концентрація зменшиться експоненціально в часі (рівняння 9), як показано на малюнку 3А. Концентрації часто перетворюються на природні логарифмічні значення (ln C org), оскільки це призводить до лінійної залежності з нахилом -k e. (Рівняння 10 і малюнок 3B).
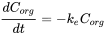 (8)
(8)
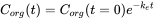 (9)
(9)
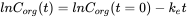 (10)
(10)
де C org (t=0) - концентрація в організмі, коли починається фаза елімінації.
Період напіврозпаду (T 1/2 або DT 50) - це час, необхідний для усунення половини кількості хімічної речовини з відсіку. Співвідношення між k e і T 1/2 становить: T 1/2 = (In 2) /k e. Період напіврозпаду збільшується, коли k e зменшується.
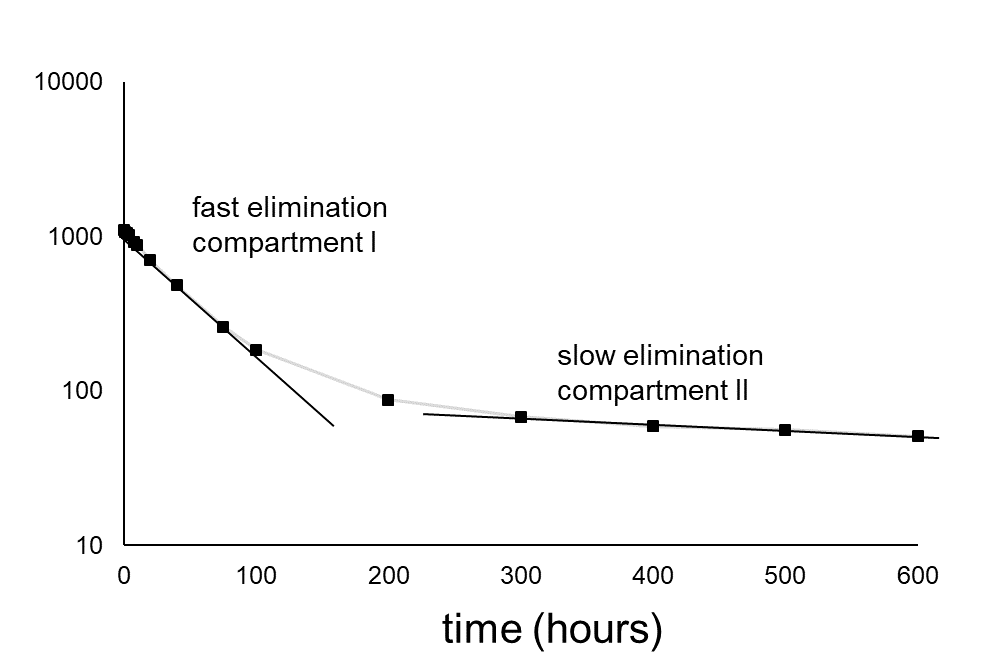
багатокамерні моделі
Дуже часто організми не можуть розглядатися як одне відділення, а як два або навіть більше відсіків (рис. 4А). Відхилення від однокамерної системи зазвичай спостерігаються, коли усунення не слідує експоненціальній закономірності, як очікувалося: після логарифмічного перетворення не виходить лінійна залежність. На малюнку 4В показана типова тенденція ліквідації в двокамерній системі. Зниження концентрації (за логарифмічною шкалою) показує дві фази: фазу I з відносно швидким зниженням і фазу II з відносно повільним зниженням. Відповідно до теорії лінійних відсіків, елімінація може бути описана як сума двох (або більше) експоненціальних членів, таких як:
 (11)
(11)
де
k e (I) і k e (II) представляють константи швидкості усунення для відсіків I і II,
F (I) і F (II) - розмір відсіків (у вигляді дробів)
Типовими прикладами двох систем купе є:
- Кров (I) і печінка (II)
- Печінкова тканина (I) і жирова тканина (II)
Виведення з жирової тканини часто відбувається повільніше, ніж з, наприклад, печінки. Печінка є добре перфузірованним органом, при цьому обмін між ліпідною тканиною і кров'ю набагато менше. Це пояснює більш швидке виведення з печінки.
Приклади кривих поглинання для різних хімічних речовин і організмів
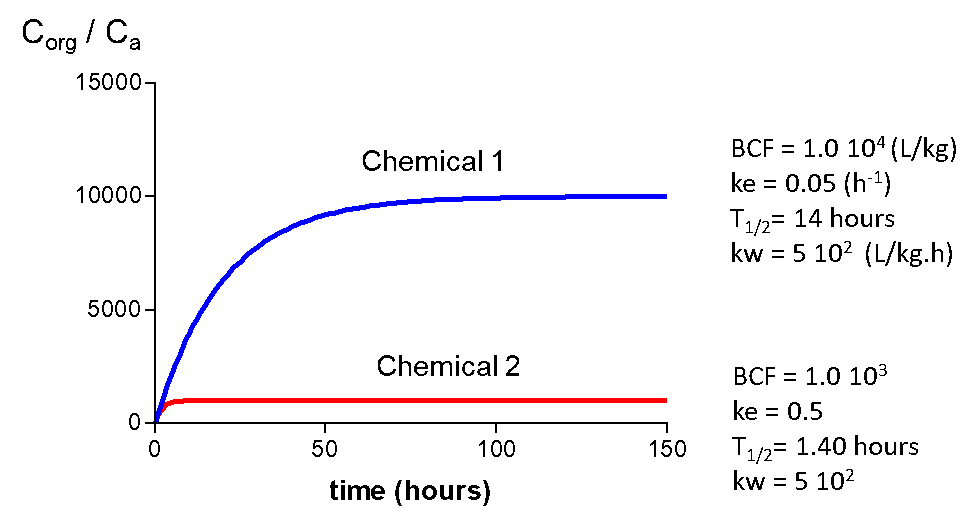
На малюнку 5 наведені криві поглинання двох різних хімічних речовин і відповідних кінетичних параметрів. Хімічна 2 має BCF 1000, хімічна 1 і BCF 10000. Показники поглинання (k w) однакові, що часто буває у випадку з органічними хімічними речовинами. Період напіврозпаду (час досягнення 50% від рівня сталого стану) становить 14 і 140 годин. Це має сенс, оскільки це займе більше часу, щоб досягти стійкого стану для хімічної речовини з більш високим BCF. Константи швидкості елімінації також відрізняються коефіцієнтом 10.
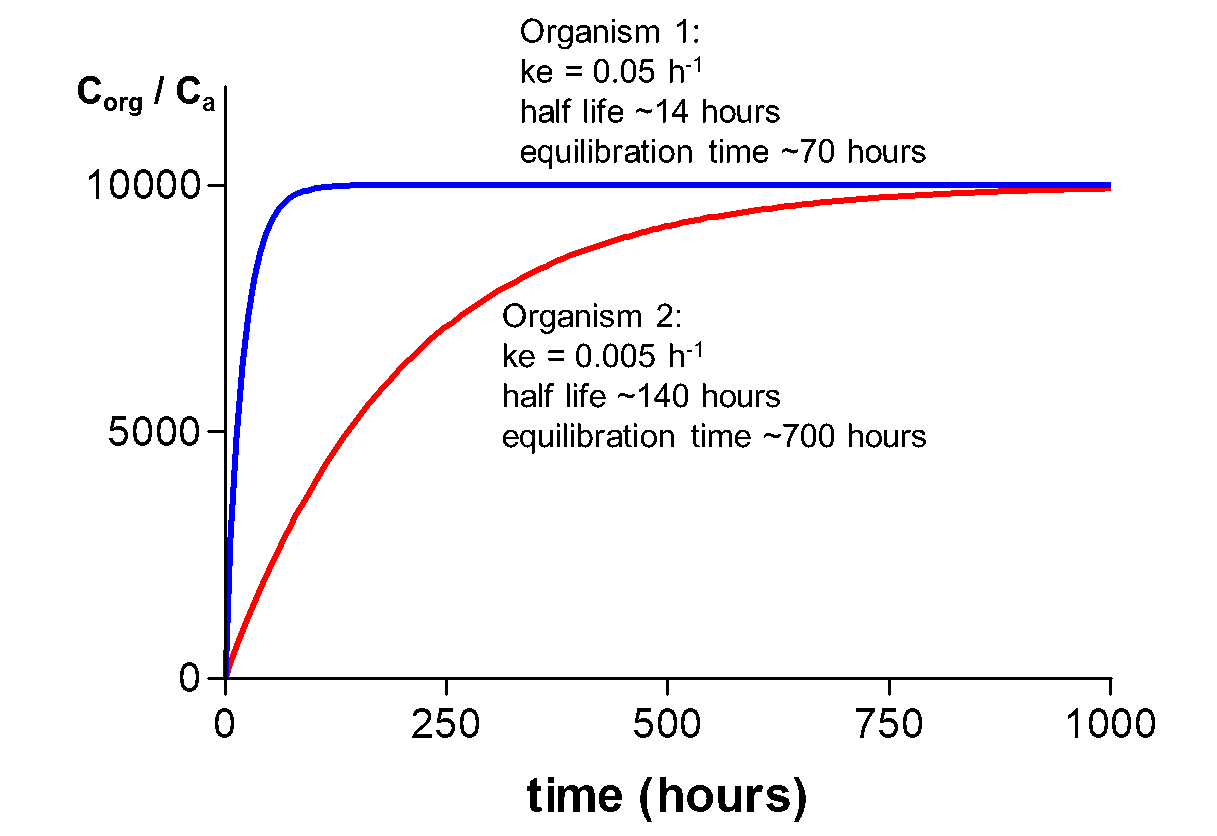
На малюнку 6 криві поглинання представлені для одного хімічного речовини, але у двох організмів різного розміру/ваги. Організм 1 набагато менше організму 2 і досягає стійкого стану набагато раніше. Значення T 1/2 для хімічної речовини в організмах 1 і 2 складають 14 і 140 годин відповідно. Невеликий розмір пояснює це швидке врівноваження. Швидкість поглинання залежать від співвідношення поверхні до об'єму (S/V) організму, яке набагато вище для маленького організму. Тому кінетика у малих організмів швидша, що призводить до коротшого часу рівноваги. Вплив розміру на кінетику більш детально розглядається в Hendriks et al. (2001) і в Розділі про алометричні відносини.
Біоакумуляція, що включає біотрансформацію та різні шляхи поглинання
У рівнянні 2 елімінація включає лише елімінацію зябер. Якщо розглядаються інші процеси, такі як біотрансформація та зростання, рівняння можна розширити, включивши ці додаткові процеси (див. Рівняння 12).
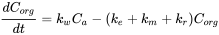 (12)
(12)
Для організмів, що живуть у ґрунті або осадах, можуть мати значення різні шляхи поглинання: шкірні (через шкіру) або пероральні (при попаданні їжі та/або частинок ґрунту або осаду). Математично поглинання організмом в осад можна описати як в рівнянні 13.
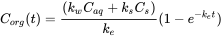 (13)
(13)
Концентрація C org в організмах (мг/кг)
Концентрація C aq у водній фазі (мг/л)
C з концентрацією грунту або осаду (мг/кг)
k w постійна швидкість поглинання з води (л/кг/добу)
k с постійна швидкість поглинання з ґрунту або осаду (кг ґрунту/кг організму/добу)
k e елімінація постійна швидкість (1/день)
t час (добу)
(Використовувані розміри: кількість хімічної речовини: мг; об'єм води: л; вага організму: кг; час: день)
У цьому рівнянні k w і k s - константи швидкості поглинання з води та осаду, k e - константа швидкості елімінації, а C aq і C s - концентрації у воді та осадах або грунті. Для ґрунтових організмів, таких як дощові черв'яки, пероральне поглинання, здається, стає більш важливим із збільшенням гідрофобності хімічної речовини (Jager et al., 2003). Це пов'язано з тим, що концентрація в ґрунті (С) стане вищою, ніж концентрація пористої води C a для більш гідрофобних хімічних речовин (див. Розділ Сорбція).
Посилання
Клевелл, Г.Дж., 3-й (1995). Застосування фізіологічно обґрунтованого фармакокінетичного моделювання в оцінці ризику для здоров'я людини небезпечних речовин. Листи токсикології 79, 207-217.
Хендрікс, А.Й., ван дер Лінде, А., Корнеліссен, Г., Сійм, Д. Потужність розміру 1. Константи швидкості та рівноважні співвідношення накопичення органічних речовин, пов'язаних із співвідношенням розділів октанол-вода та масою виду. Екологічна токсикологія та хімія 20, 1399-1420.
Ягер, Т., Флёрен, Р., Хогендорн, Е.А., Де Корте, Г. Роз'яснюючи шляхи впливу органічних хімічних речовин на дощового черв'яка, Ейзенія андрій (Oligochaeta). Екологічна наука і технологія 37, 3399-3404.
Ніколс, Дж., Фіцсіммонс, П.М., Уайтмен, Ф.В. (2004). Фізіологічно обґрунтована токсикокінетична модель харчового поглинання рибами гідрофобних органічних сполук - ІІ. Моделювання сценаріїв хронічного впливу. Токсикологічні науки 77, 219-229.
Ван Леувен, C.J., Вермейр, Т.Г. (ред.) (2007). Оцінка ризику хімічних речовин: Вступ. Спрінгер, Дордрехт, Нідерланди.
Які припущення в однокамерній кінетичній моделі?
Як ви можете визначити, коли більше відсіків задіяно в кінетичній моделі?
Наведіть приклади відсіків в багатокамерній системі.
Чому рівновага досягається швидше в маленькому організмі порівняно з більшим організмом?
Які два методи можуть бути застосовані для оцінки фактора біоконцентрації хімічної речовини в організмі?
4.1.3. Тканинне скупчення металів
Автор: Ніко М. ван Страален
Рецензенти: Філіп С. Рейнбоу, Хенк Шат
Цілі навчання:
Ви повинні вміти
- вказують чотири типи неорганічних металів, що зв'язують клітинні складові, присутні в біологічних тканині, і вказують, які метали вони зв'язують.
- опишіть, як фітохелат і металотіонеїн індукуються металами.
- згадати ряд комбінацій орган-метал, які мають вирішальне значення для токсичності металів.
Ключові слова: Металозв'язуючі білки; фітохелат; металотіонеїн;
Синопсис
Питання видоутворення металів, що має вирішальне значення для розуміння долі металу в навколишньому середовищі, однаково важливий для внутрішнього розподілу в організмах і токсичності всередині клітини. Багато металів, як правило, накопичуються в конкретних органах, наприклад, гепатопанкреях ракоподібних, хлорагогенної тканини аннелід та нирках ссавців. Крім того, часто існує певний орган або тканина, де спочатку спостерігається дисфункція або токсичність, наприклад, в організмі людини первинні ефекти хронічного впливу ртуті спостерігаються в мозку, для свинцю в кістковому мозку та кадмію в нирках. Цей модуль спрямований на підвищення розуміння різних механізмів, за допомогою яких метали накопичуються в біологічних тканині.
Вступ
Метали будуть присутні в біологічних тканині у великій різноманітності хімічних форм: вільний іон металу, різні неорганічні види з широко різною розчинністю, такі як хлориди або карбонати, плюс всі види металів, пов'язані з низькомолекулярними та високомолекулярними біотичними лігандами. Вільний іон металу вважається найбільш актуальним видом, що відноситься до токсичності.
Щоб пояснити спорідненість металів із конкретними мішенями, була запропонована система, заснована на фізичних властивостях іона; відповідно до цієї системи метали поділяються на «метали, що шукають кисень» (клас А, наприклад, літій, берилій, кальцій та лантан) та «метали, що шукають сірку» (клас B, наприклад, срібло, ртуть і свинець) (Див. Розділ про метали і металоїди). Однак більшість металів, що мають екологічну актуальність, потрапляють в проміжний клас, званий «прикордонними» (хром, кадмій, мідь, цинк та ін.). Ця класифікація певною мірою прогнозує зв'язування металів з конкретними клітинними мішенями, такими як SH-групи в білках, азот в гістидині або карбонати в кістковій тканині.
Мало того, що метали надзвичайно відрізняються за своїми фізико-хімічними властивостями, але й самі організми сильно відрізняються тим, як вони мають справу з металами. Тип ліганду, до якого пов'язаний метал, і те, як цей ліганд транспортується або зберігається в організмі, значною мірою визначає, де метал буде накопичуватися і викликати токсичність. Чутливі цілі або критичні біохімічні процеси відрізняються між видами, і це також може призвести до диференціальної токсичності.
Неорганічне зв'язування металу
Багато тканин містять «мінеральні конкреції», тобто гранули зі специфічним мінеральним складом, які в силу природи мінералу залучають різні метали. Особливо епітелій кишечника безхребетних, і їх травні залози (гепатопанкреас, залоза середньої кишки, хлорагогенна тканина) можуть бути сповнені таких конкрементів. Розрізняють чотири класи гранул (рис. 1):
- Кальцієво-пірофосфатні гранули з магнієм, марганцем, часто також цинком, кадмієм, свинцем і залізом
- Гранули сірки з міддю, іноді також кадмієм
- Залізні гранули, що містять виключно залізо
- Гранули карбонату кальцію, що містять в основному кальцій
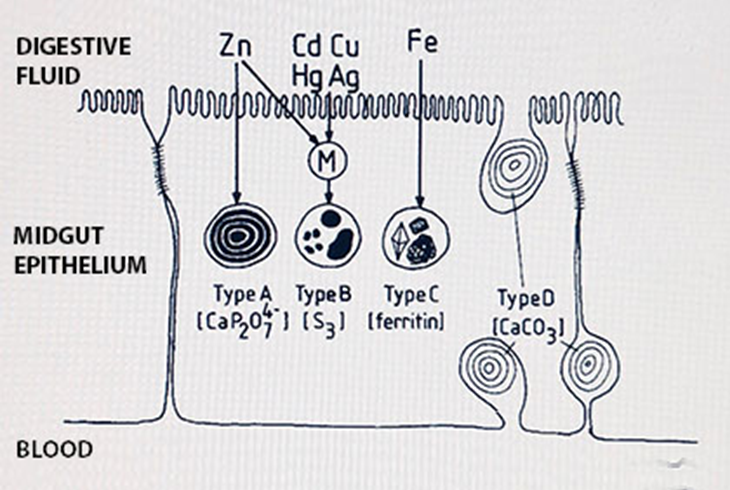
Гранули типу В вважаються лізосомними бульбашками, які поглинули металонавантажені пептиди, такі як металотіонеїн або фітохелат, і перетворилися на неорганічні гранули, руйнуючи майже весь органічний матеріал; високий вміст сірки походить від залишків цистеїну в пептидах.
Тканини або клітини, які спеціалізуються на синтезі внутрішньоклітинних гранул, також є місцями, де метали мають тенденцію накопичуватися. Добре відомі «S-клітини» в гепатопанкреасі ізоподів. Ці клітини (дрібні клітини, клітини В-типу сенсу Хопкіна 1989) містять дуже велику кількість міді. Швидше за все великі запаси міді у мокриць та інших ракоподібних стосуються використання ними гемоціаніна, залежного від міді білка, як молекули, транспортує кисню. Подібні тканини з високими навантаженнями мінеральних конкрементів були описані для дощових черв'яків, равликів, колемболанів і комах.
Обв'язка органічних металів
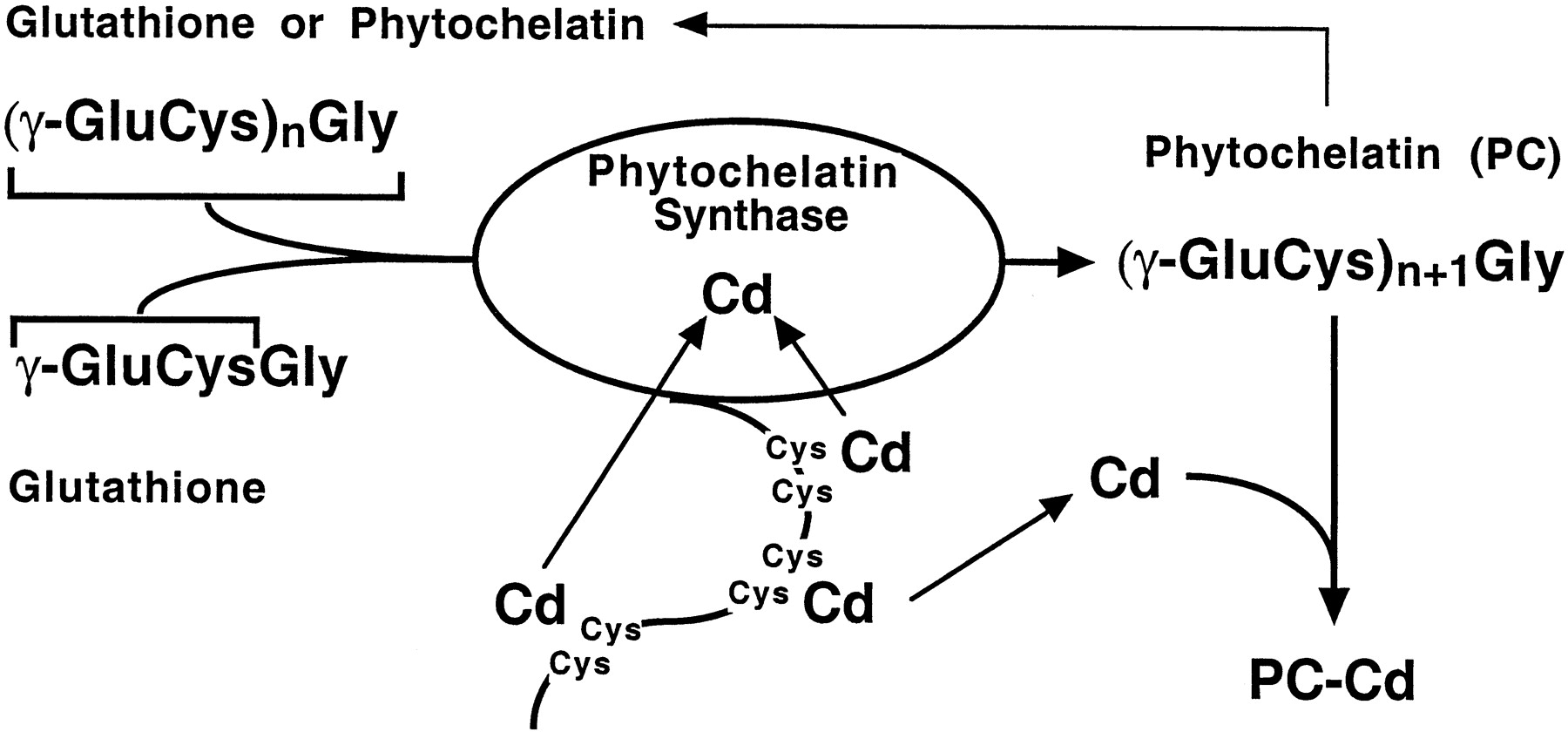
Другий клас металозв'язуючих лігандів має органічну природу. Багато рослин, а також кілька тварин синтезують пептид під назвою фітохелат (ПК). Це олігомер, отриманий з глутатіону з трьома амінокислотами, γ-глюматиновой кислотою, цистеїном і гліцином, розташованими наступним чином: (γ-glu-cys) n -gly, де n може варіюватися від 2 до 11. У зв'язуванні металів беруть участь тіольні групи з декількох залишків цистеїну.
Іншим основним органічним лігандом для металів є металотіонеїн (МТ). Це низькомолекулярний білок з гідрофільними властивостями і надзвичайно великою кількістю залишків цистеїну. Кілька цистеїнів (зазвичай дев'ять або десять) можуть зв'язувати ряд іонів металів (наприклад, чотири або п'ять) в одному кластері. У хребетного є два таких скупчення металотіонеїну. Металотіонеїни зустрічаються по всьому дереву життя, від бактерій до ссавців, але послідовність амінокислот, доменна структура та спорідненість металів надзвичайно різняться, і сумнівно, чи представляють вони єдину еволюційно-гомологічну групу.
На додаток до цих двох конкретних класів органічних лігандів, МТ і ПК, метали також будуть зв'язуватися спеціально з усіма видами клітинних складових, таких як компоненти клітинної стінки, білок у крові тощо Часто це є найбільшим сховищем металів; такі специфічні сайти зв'язування будуть постійно доставляти безкоштовно іони металів до стільникового басейну і тому є найважливішою причиною токсичності. Звичайно, метали також присутні в молекулах зі специфічними метало-залежними функціями, такими як залізо в гемоглобіні, мідь в гемоціаніні, цинк у карбоангідрази тощо.
Відмінність неорганічних лігандів від органічних не настільки суворе, як може здатися. Після зв'язування з металотіонеїном або фітохелатіном метали можуть бути перенесені в більш постійне відділення для зберігання, наприклад внутрішньоклітинні гранули, згадані вище, або вони можуть виводитися з організму.
Регулювання металевої обв'язки
Вільні іони металів є сильними індукторами шляхів реакції на стрес. Це може бути пов'язано з самим іоном металу, але частіше реакція на стрес викликається металом порушенням окислювально-відновного стану, тобто індукцією окислювального стресу. Реакція на стрес часто включає синтез металозв'язуючих лігандів, таких як фітохелат і металотіонеїн. Оскільки це видаляє іони металів з активного басейну, його також називають поглинаванням металів.
Зв'язуюча здатність фітохелатину посилюється за рахунок активації ферменту фітохелатинсинтази (ПК-синтази). Згідно з однією моделлю своєї дії, С-кінцевий фермент має «металевий датчик», що складається з ряду цистеїнів з вільними SH-групами. Будь-які іони металів, що вступають в реакцію з цим нуклеофільним центром (а кадмій є сильним реагентом), активують фермент, який потім каталізує реакцію від (γ-glu-cys) n -gly до (γ-glu-cys) n+1 -gly, тим самим збільшуючи зв'язуючу здатність клітинного фітохелатину (рис. 2). Ця реакція, звичайно, спирається на наявність достатньої кількості глутатіону в клітині. На заводах комплекс ПК-металів транспортується в центральну вакуоль, де він може стабілізуватися шляхом включення кислотно-лабільної сірки (S 2). Шматок ПК руйнується, в результаті чого утворюються неорганічні сульфідні кристаліти металів. Крім того, можуть утворюватися комплекси металів з органічними кислотами (наприклад, цитрати або оксалати). Доля металонавантаженого ПК у клітині тварин не відома, але він може бути поглинутий у лізосомальній системі з утворенням гранул B-типу (див. Вище).
Регулювання металотіонеїну (МТ) відбувається зовсім по-іншому, оскільки залежить від de novo синтезу апопротеїну. Це класичний приклад генної регуляції, що сприяє захисту клітини. У найрізноманітніших тварин, включаючи хребетних і безхребетних, гени металлотіонеїну (Mt) активуються транскрипційним фактором, який називається метало-чутливим фактором транскрипції 1 (MTF-1). MTF -1 зв'язується з так званими метал-чутливими елементами (MRE) в промоутері Mt. MRE - це короткі мотиви з характерною базово-парною послідовністю, які утворюють ядро місця зв'язування фактора транскрипції в ДНК. У нормальних фізіологічних умовах МТФ-1 неактивний і не здатний індукувати Mt. Однак він може бути активований іонами Zn 2+, які виділяються з невизначених лігандів металами, такими як кадмій, які можуть замінити цинк (рис. 3).
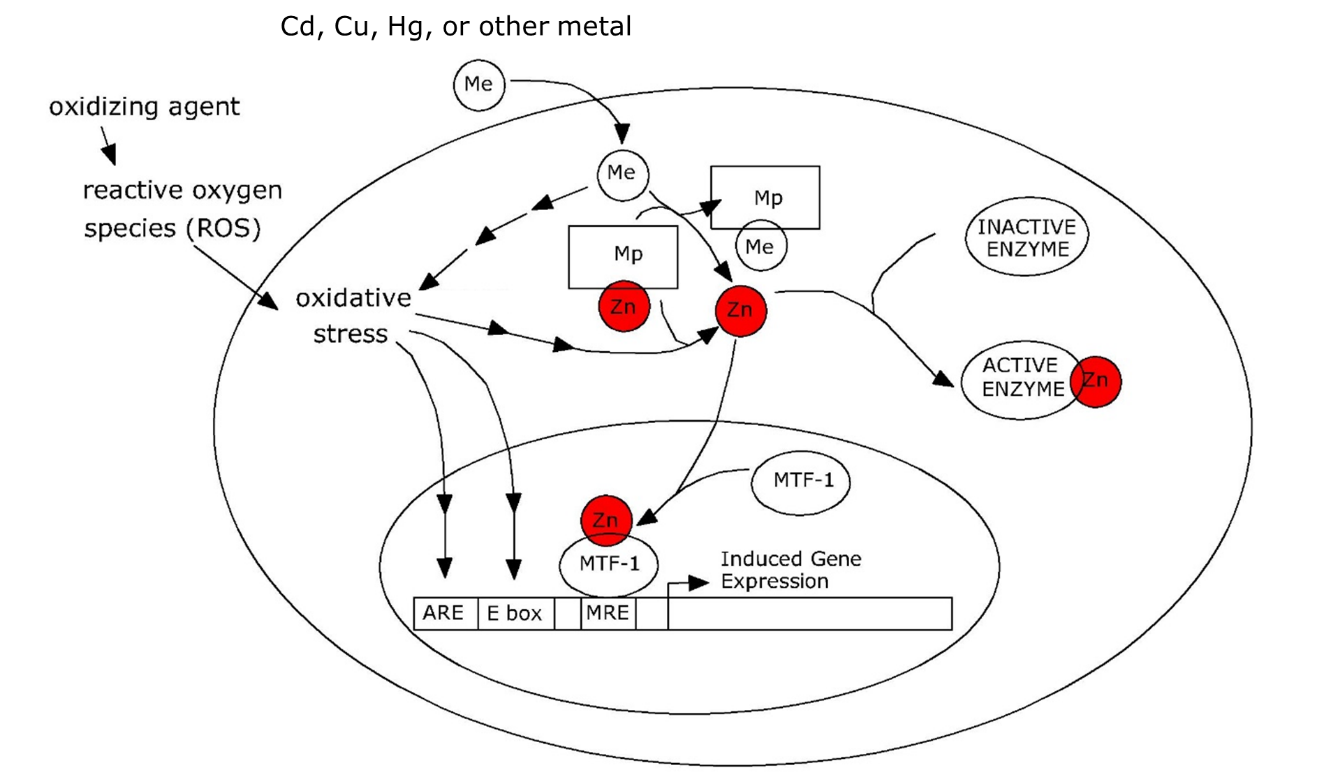
Потрібно підкреслити, що розглянута вище модель надихається роботою над хребетними. Членистоногі (Drosophila, Orchesella, Daphnia) можуть мати подібний механізм, оскільки вони також мають гомолог MTF-1, який активує Mt, однак ситуація для інших безхребетних, таких як аннеліди та черевоногі, неясна; їхні гени Mt здаються не вистачає MRE, незважаючи на те, що вони індуковані кадмієм. Крім того, мінливість металотіонеїнів у безхребетних надзвичайно велика і не всі металозв'язуючі білки можуть бути ортологами металотіонеїну хребетних. У равликів кадмій-зв'язуючий, індукований кадмієм МТ функціонує поряд з мідно-зв'язуючим МТ, тоді як два МТ мають різний розподіл тканин, а також регулюються зовсім по-різному.
Хоча як фітохелат, так і металотіонеїн секвестують необхідні, а також несуттєві метали (наприклад, Cd) і таким чином сприяють детоксикації, широка присутність цих систем у всьому дереві життя говорить про те, що вони не розвивалися в першу чергу для боротьби з антропогенним забрудненням металів. Дуже сильна індукованість цих систем несуттєвими елементами, такими як кадмій, може вважатися побічним ефектом іншої первинної функції, наприклад, регулювання клітинного окислювально-відновного стану або зв'язування ефірних металів.
Органи мішені
Будь-яке тканинно-специфічне накопичення металів можна пояснити оборотністю металозв'язуючих лігандів. Наприклад, накопичення кадмію в нирках ссавців пов'язано з тим, що металотіонеїн, завантажений кадмієм, не може виводитися. Високі концентрації металів в задніх сегментах дощових черв'яків обумовлені наявністю «залишкових тіл», які повністю упаковані внутрішньоклітинними гранулами. Накопичення кадмію в розпростерті людини відбувається завдяки високій концентрації цитрату цинку в цьому органі, який служить для захисту скорочувальних білків в хвостах сперми від окислення; кадмій неодмінно потрапляє в розпростерту через транспортери цинку.
Часто стверджується, що основні метали підлягають регулюючим механізмам, що означало б, що навантаження на їх організм у великому діапазоні зовнішніх впливів є постійним. Однак не всі «незамінні» метали регулюються в тій мірі, в якій концентрація всього тіла зберігається постійною. Багато безхребетних мають відсіки тіла, пов'язані з кишечником (залоза середньої кишки, гепатопанкреас, мальпігієві канальці), в яких метали, часто у вигляді мінеральних конкрементів, інактивуються і зберігаються постійно або обмінюються дуже повільно з активним басейном. Оскільки ці відсіки знаходяться поза досяжністю регулюючих механізмів, але зазвичай не розділені при аналізі металу всього тіла, навантаження на тіло в цілому не є постійним. Деякі безхребетні навіть носять «рюкзак» металів, що накопичуються протягом життя. Це стосується, наприклад, цинку в барнаклах, міді в ізоподах та цинку у дощових черв'яків.
Накопичення металів в органів-мішенях може призвести до токсичності, коли критична зв'язуюча або екскреційна здатність вичерпується і іони металів починають зв'язуватися конкретно з клітинними складовими. Орган, в якому це відбувається, часто називають органом-мішенню. Загальна концентрація металу, при якій токсичність починає ставати очевидною, називається критичною концентрацією тіла (CBC) або критичною концентрацією тканин. Наприклад, критична концентрація кадмію в нирках, вище якої спостерігається ураження нирок, оцінюється в 50 мкг/г.Перелік критичних органів для металів в організмі людини наведено в таблиці 1.
Поняття CBC передбачає, що повне навантаження металу в органі знаходиться в рівновазі з активною фракцією, що викликає токсичність, і що немає постійного накопичувального басейну. У разі зберігання детоксикації навантаження на організм, при якому з'являється токсичність, буде залежати від історії накопичення.
Таблиця 1. Критичні органи для хронічної токсичності металів в організмі людини
|
Металеві або металоїдні |
критичний орган |
симптоми |
|
Аль |
Мозок |
хвороба Альцгеймера |
|
Як |
Легені, печінка, серцева кишка |
Мультисистемне енергетичне порушення |
|
Cd |
Нирки, печінка |
Пошкодження нирок |
|
Cr |
Шкіра, легені, кишечник |
Пошкодження дихальної системи |
|
Cu |
Печінка |
ураження печінки |
|
Hg |
Мозок, печінка |
Психічні захворювання |
|
Ni |
Шкіра, нирки |
Алергічна реакція, ураження нирок |
|
Пб |
Кістковий мозок, кров, мозок |
Анемія, розумова відсталість |
Посилання
Коббетт, К., Голдсбро, П. (2002). Фітохелатини та металотіонеїни: ролі в детоксикації важких металів та гомеостазі. Щорічний огляд біології рослин 53, 159-182.
Даллінгер, Р., Бергер, Б., Хунцікер, П., Kägi, J.H.R. (1997). Металотіонеїн у метаболізмі Cd та Cu равлика. Природа 388, 237-238.
Даллінгер Р., Гекнер М. Еволюційні концепції в екотоксикології: відстеження генетичного фону диференціальної чутливості кадмію в безхребетних родовищах. Екотоксикологія 22, 767-778.
Хак, Ф., Махоні, М., Коропатник, Дж. (2003) Сигнальні події для індукції металотіонеїну. Дослідження мутації 533, 211-226.
Гопкін С.П. (1989) Екофізіологія металів у наземних безхребетних. Лондон, прикладна наука Elsevier.
Nieboer, E., Richardson, D.H.S. (1980) Заміна непоказного терміна «важкі метали» біологічно і хімічно значущою класифікацією іонів металів. Забруднення навколишнього середовища серії B 1, 3-26.
Rainbow, P.S. (2002) Концентрації трасування металів у водних безхребетних: чому і що? Забруднення навколишнього середовища 120, 497-507.
Згадайте чотири основні неорганічні клітинні складові, які зв'язують метали, їх основний елементний склад і вказують, які метали зазвичай пов'язані в кожній структурі.
Як можна регулювати внутрішньоклітинні рівні молекул, що поглинають метали, таких як металотіонеїн (МТ) та фітохелатін (ПК), щоб протидіяти можливому несприятливому впливу іонів вільних металів? Опишіть молекулярний механізм металотіонеїну та фітохелатину окремо.
- Згадайте три органи людського організму, схильні до інтоксикації металів і до яких металів вони особливо чутливі.
4.1.4. Захист від ксенобіотиків і метаболізм
Автор: Ніко М. ван Страален
Рецензенти: Тімо Хаммерс, Крістіна Фоссі
Цілі навчання:
Ви повинні вміти:
- рекапітулювати фази I, II і III механізмів ксенобіотичного метаболізму та найважливіших молекулярних систем, що беруть участь.
- опишіть долю і хімічні зміни органічної сполуки, яка метаболізується організмом людини, від всмоктування до виведення.
- пояснити принцип активації метаболізму і чому деякі сполуки можуть стати дуже реактивними при метаболізмі ксенобіотиків.
- розробити гіпотезу про екологічний вплив ксенобіотичних сполук, які потребують метаболічної активації.
Ключові слова: біотрансформація; фаза 1; фаза II; фаза III; екскреція; метаболічна активація; цитохром Р450
Синопсис
Всі організми оснащені механізмами метаболічного захисту для боротьби з чужорідними сполуками. Задіяні реакції, спільно звані біотрансформацією, можна розділити на три фази і, як правило, спрямовані на підвищення розчинності та виведення у воді. Перший етап (I фаза) каталізується цитохромом Р450, за яким слідують різноманітні реакції кон'югації (фаза II) і екскреції (фаза III). Ферменти та транспортери, що беруть участь, часто сильно індукуються, тобто кількість білка значно посилюється самими ксенобіотичними сполуками. Індукція включає зв'язування сполуки з білками цитоплазматичних рецепторів, такими як арілвуглеводневий рецептор (AhR), або конститутивний андростанний рецептор (CAR). У деяких випадках проміжні метаболіти, що виробляються у фазі I, надзвичайно реактивні та є основною причиною токсичності, добре відомим прикладом є метаболічна активація поліциклічних ароматичних вуглеводнів, таких як бензо (а) пірен, який легко утворює аддукти ДНК і викликає рак. Крім того, деякі сполуки значно індукують метаболізуючі ферменти, але навряд чи деградуються ними і викликають хронічний клітинний стрес. Різні реакції біотрансформації є вирішальним аспектом як токсикокінетики, так і токсикодинаміки ксенобіотиків.
Вступ
Термін «ксенобіотик» («чужий біології») зазвичай використовується для позначення хімічної сполуки, яка зазвичай не має метаболічної функції. Ми будемо широко використовувати цей термін в цьому модулі, незважаючи на те, що це дещо проблематично (наприклад, чи може сполука вважатися «чужорідним», якщо вона циркулює в організмі, метаболізується або деградує в організмі? , І: те, що є «чужим» для одного виду, не обов'язково «чуже» для іншого виду).
Організм має розгалужену захисну систему для боротьби з ксенобіотичними сполуками, вільно позначені як біотрансформація. Кінцевим результатом цієї системи є виведення з'єднання в тій чи іншій формі. Однак багато ксенобіотиків досить ліпофільні, мають тенденцію до накопичення і не легко виводяться через низьку розчинність у воді. Молекулярні модифікації зазвичай потрібні перед тим, як такі сполуки можуть бути виведені з організму, так як основні кровоносна і видільна системи (кров, сеча) на водній основі. Вводячи гідрофільні групи в молекулу (-ОН, = О, -СООН) і кон'югуючи її з ендогенною сполукою з хорошою розчинністю у воді, зазвичай здійснюється виведення. Однак, як ми побачимо нижче, проміжні метаболіти можуть мати підвищену реактивність, і часто трапляється, що сполука стає більш токсичною під час метаболізму. У випадку пестицидів навмисне використання таких реакцій, щоб збільшити токсичність інсектициду, коли він знаходиться в організмі-мішені.
Вивчення ксенобіотичного метаболізму є класичним предметом не тільки в токсикології, але і фармакології. Спосіб дії того чи іншого препарату часто критично залежить від швидкості і режиму обміну речовин. Також багато препаратів виявляють токсичні побічні ефекти як наслідок обміну речовин. Нарешті, метаболізм ксенобіотиків також широко вивчається в ентомології, оскільки як токсичність, так і стійкість пестицидів часто опосередковані метаболізмом.
Найбільш проблемними ксенобіотиками вважаються ті з високим коефіцієнтом розподілу октанол-вода (K ow), які сильно ліпофільні і дуже гідрофобні. Вони, як правило, накопичуються, пропорційно їх Log K ow, в тканині з високим вмістом ліпідів, таких як підшкірні хребетних, і може спричинити пошкодження тканин через порушення мембранних функцій. Такий спосіб дії називається «мінімальною токсичністю». Добре відомі низькомолекулярні аліфатичні нафтові сполуки та хлоровані алкани, такі як хлороформ. Ці сполуки спричиняють первинне пошкодження клітинних мембран; особливо нейрони чутливі до цього ефекту, отже, мінімальна токсичність також називається наркотичною токсичністю. Ліпофільні хімічні речовини з високим Log K ow не досягають концентрацій, достатньо високих, щоб викликати мінімальну токсичність, оскільки вони викликають біотрансформацію при менших концентраціях. Тоді токсичність зазвичай обумовлена реактивним метаболітом.
Ксенобіотичний метаболізм включає три наступні фази (рис. 1):
- Активація (зазвичай окислення) сполуки ферментом, відомим як цитохром Р450, який діє у співпраці з NADPH цитохрому Р450 редуктазою та іншими факторами.
- Кон'югація активованого продукту фази I до ендогенного з'єднання. Для цього завдання доступно безліч різних ферментів, залежно від з'єднання, тканини та виду. Існують також (злегка полярні) сполуки, які вступають у фазу II безпосередньо, не активуючись у фазі I.
- Екскреція сполуки в циркуляцію, сечу або інші середовища, як правило, за допомогою переносників, що охоплюють мембрану, що належать до класу АТФ-зв'язуючих касетних (ABC) транспортерів, включаючи сумнозвісні білки резистентності до кількох лікарських засобів. Гідрофільні сполуки можуть переходити безпосередньо в фазу III, не активуючись або кон'югуючи.
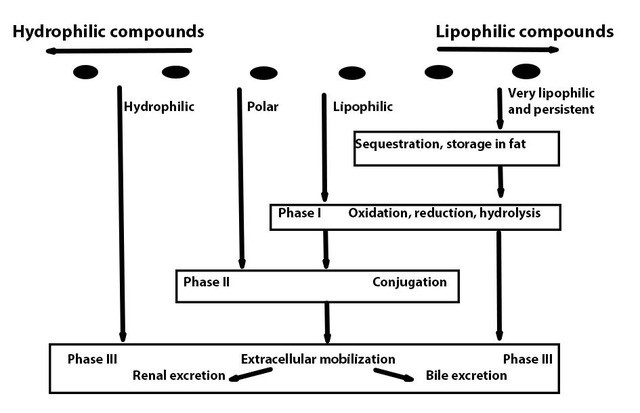
Реакції фази I
Цитохром Р450 - мембранно-зв'язаний фермент, пов'язаний з гладким ендоплазматичним ретикулумом. Він несе порфіринове кільце, що містить атом Fe, який є активним центром молекули. Позначення P450 походить від того, що він показує максимум поглинання при 450 нм при гальмуванні чадним газом, що є застарілим в даний час методом демонстрації його присутності. Іншими (застарілими) іменами є MFO (змішана функція оксигенази) і препарат метаболізуючий ферментний комплекс. Цитохром Р450 кодується геном під назвою CYP, якого в геномі багато паралогів, все трохи відрізняються один від одного з точки зору індукованості і специфічності субстрату. Три класи генів CYP беруть участь у біотрансформації, позначені CYP1, CYP2 і CYP3 у хребетних. Кожен клас має кілька ізоформ; геном людини має загалом 57 різних генів CYP. Доповнення CYP безхребетних та рослин часто включає ще більше генів; багато еволюційних родовищ мають свій власний набір, що виникає внаслідок обширних дуплікацій генів у межах цієї лінії. У людини генетичне доповнення генів CYP людини має велике значення щодо його профілю метаболізму наркотиків (див. Розділ Генетичні варіації метаболізму токсикантів).
Цитохром Р450 діє спільно з ферментом, який називається NADPH цитохрому Р450 редуктаза, який складається з двох флавопротеїнів, один з яких містить флавін аденін-динуклеотид (FAD), інший флавіновий мононуклеотид (FMN). Відновлений атом Fe 2+ в цитохромі P450 зв'язує молекулярний кисень і окислюється до Fe 3+ при розщепленні O 2; один атом O вводиться в субстрат, інший реагує з воднем з утворенням води. Потім фермент відновлюють, приймаючи електрон з цитохрому Р450 редуктази. Загальна реакція може бути записана як:
RH + О 2 + НАДФ + Н + → РОН + Н 2 О + НАДП +
де R - довільна підкладка.
Цитохром Р450 в значній мірі виражається в гепатоцитах (клітині печінки), печінка є основним органом для обміну ксенобіотиків у хребетних (рис. 2), але він присутній і при епітелії легенів і кишечника. У комах активність особливо висока в мальпігійських канальцях на додаток до кишечника та жирового тіла. У молюсків і ракоподібних головним органом обміну речовин є гепатопанкреас.
Реакції фази II
Після активації цитохромом Р450 окислений субстрат готовий до кон'югування з ендогенною сполукою, наприклад, сульфатом, глюкозою, глюкуроновою кислотою або групою глутатіону. Ці реакції проводяться безліччю різних ферментів, з яких одні проживають в SER подібно Р450, а інші розташовуються в цитоплазмі клітини (рис. 2). Більшість з них переносять гідрофільну групу, наявну з проміжного метаболізму, в субстрат, звідси ферменти називаються трансферазами. Зазвичай сполука стає більш полярною у фазі II, однак не всі реакції фази II підвищують розчинність у воді; наприклад, метилювання (метилтрансферазою) знижує реакційну здатність, але збільшує полярність. Інші реакції II фази - це кон'югація з глутатіоном, що проводиться глутатіон-S-трансферазою (ГСТ) і з глюкуроновою кислотою, що проводиться УДП-глюкуронілтрансферазою. У безхребетних можуть домінувати інші спряження, наприклад, у членистоногих і рослин, кон'югація з малонілглюкозою є звичайною реакцією, яка не спостерігається у хребетних.
Кон'югація з глутатіоном в організмі людини часто супроводжується розщепленням глутамінової кислоти і гліцину, залишаючи на субстраті тільки залишок цистеїну. Цистеїн згодом ацетилюється, утворюючи таким чином так звану меркаптурову кислоту. Це найпоширеніший тип метаболіту для багатьох ксенобіотиків, що виділяються з сечею людиною.
Як і цитохром Р450, ферменти II фази складаються в різних ізоформах, закодованих різними паралогами в геномі. Особливо сім'я GST досить обширна, і поліморфізми в цих генах значно сприяють особистому метаболічному профілю (див. Розділ Генетичні варіації в метаболізмі токсикантів).
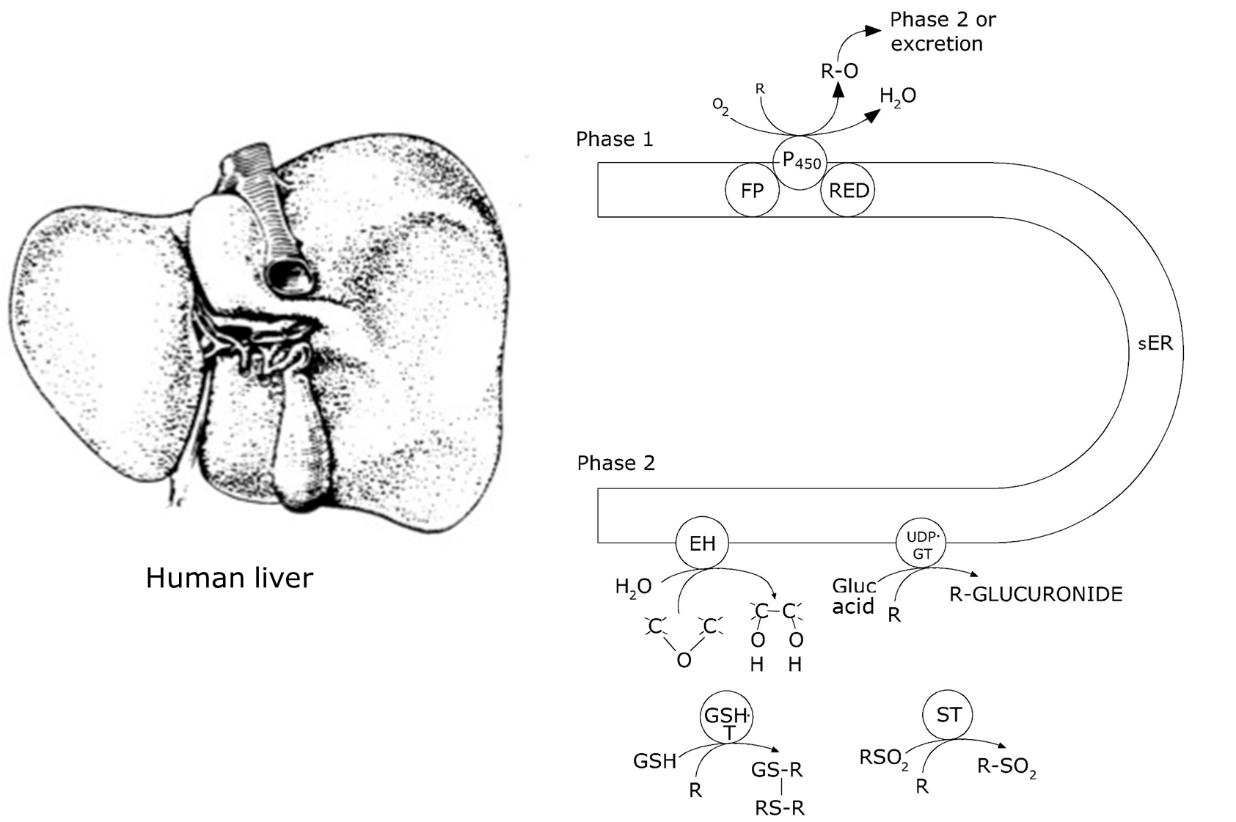
Реакції фази III
В організмі людини є два основних шляхи виведення: один з печінки в жовч (і далі в кишечник і фекалії), інший через нирки і сечу. Ці два шляхи використовуються різними класами ксенобіотиків: дуже гідрофобні сполуки, такі як високомолекулярні поліциклічні ароматичні вуглеводні, все ще не добре розчиняються у воді навіть після метаболізму, але можуть емульгуватися жовчною сіллю і виводитися таким чином. Іноді трапляється так, що такі сполуки, одного разу надходячи в кишечник, знову засвоюються, транспортуються в печінку ворітної веною і знову метаболізуються. Це називається «ентеро-печінковий кровообіг». Більш низькомолекулярні сполуки і гідрофільні сполуки виводяться через сечу. Летючі сполуки можуть виходити з організму через шкіру і повітря, що видихається.
Виведення активованих і кон'югованих сполук з тканин з клітини зазвичай вимагає активного транспорту, який опосередковується транспортерами ABC (АТФ зв'язування касети), дуже великим і різноманітним сімейством мембранних білків, які мають спільну зв'язуючу касету для АТФ. Різні підгрупи транспортерів АТФ транспортують різні типи хімічних речовин, наприклад, позитивно заряджені гідрофобні молекули, нейтральні молекули та водорозчинні аніонні сполуки. Одна відома група складається з білків мультимедикаментозної резистентності або Р-глікопротеїнів. Ці транспортери експортують наркотики, спрямовані на атаку пухлинних клітин. Оскільки їх активність є високоіндукованою, ці білки можуть надзвичайно посилити екскрецію, роблячи клітину ефективно стійкою і, таким чином, викликати основні проблеми для лікування раку.
Індукційні
Всі ферменти ксенобіотичного метаболізму високоіндуковані: їх активність в нормі знаходиться на низькому рівні, але значно посилюється в присутності ксенобіотиків. Це досягається за допомогою класичного випадку транскрипційної регуляції на CYP та інших генах, що призводить до de novo синтезу білка. Крім того, може спостерігатися велика розростання ендоплазматичного ретикулума, а в крайніх випадках навіть набряк печінки (гепатомегалія).
Найкращим дослідженим шляхом транскрипційної активації генів CYP є арілвуглеводневий рецептор (AhR). У нормальних умовах цей пептид стабілізується в цитоплазмі білками теплового шоку, однак, коли ксенобіотична сполука зв'язується з AhR, вона активується і може з'єднуватися з іншим білком, який називається ядерним транслокатором рецептора Ah (ARNT) для транслокації в ядро і зв'язуватися з елементами ДНК, присутніми в промотор CYP та інших генів. Таким чином, він діє як транскрипційний активатор або фактор транскрипції на цих генах (рис. 3). Мотиви ДНК, до яких зв'язується AhR, називаються ксенобіотичними чутливими елементами (XRE) або диоксин-чутливими елементами (DRE). Сполуки, що діють таким чином, називаються індукторами 3-MC-типу, після (високо канцерогенного) модельного з'єднання 3-метилхолантрен. Індукційна здатність сполуки пов'язана з його спорідненістю зв'язування з AhR, яка сама по собі визначається просторовою структурою молекули. Блокування та ключове пристосування між AHR та ксенобіотиками пояснює, чому індукція біотрансформації ксенобіотиками показує дуже сильну стереоспецифічність. Наприклад, серед хлорованих дифенілів і хлорованих дибензодіоксинів деякі сполуки є надзвичайно сильними індукторами генів CYP1, а інші, навіть при однаковій кількості атомів хлору, взагалі не є індукторами. Точне положення атомів хлору визначає молекулярну «посадку» в рецепторі Ah (див. Розділ про взаємодію рецепторів).
Крім 3МК-типу індукції існують і інші режими, при яких індукуються ферменти біотрансформації, але вони менш відомі. Поширеним класом є індукція типу PB (названа на честь іншої модельної сполуки, фенобарбіталу). Індукція типу PB не є AHR-залежною, але діє за рахунок активації іншого ядерного рецептора, званого конституційним андростановим рецептором (CAR). Цей рецептор активує гени CYP2 і деякі гени CYP3.
Висока індукованість біотрансформації може бути використана зворотним чином: якщо вважається, що біотрансформація сильно регулюється у вигляді, що живе в навколишньому середовищі, це свідчить про те, що цей вид піддається впливу ксенобіотичних сполук. Таким чином, аналізи, спрямовані на активність цитохрому Р450, можуть бути використані в системах біоіндикації та біомоніторингу. Для цієї мети часто використовується аналіз EROD (етоксирезоруфін-О-деетилаза), хоча він не є 100% специфічним для ізоформи P450. Інший підхід полягає у безпосередньому вирішенні експресії CYP, наприклад, за допомогою кількісної ПЛР із зворотною транскрипцією, методу кількісної оцінки кількості мРНК CYP.
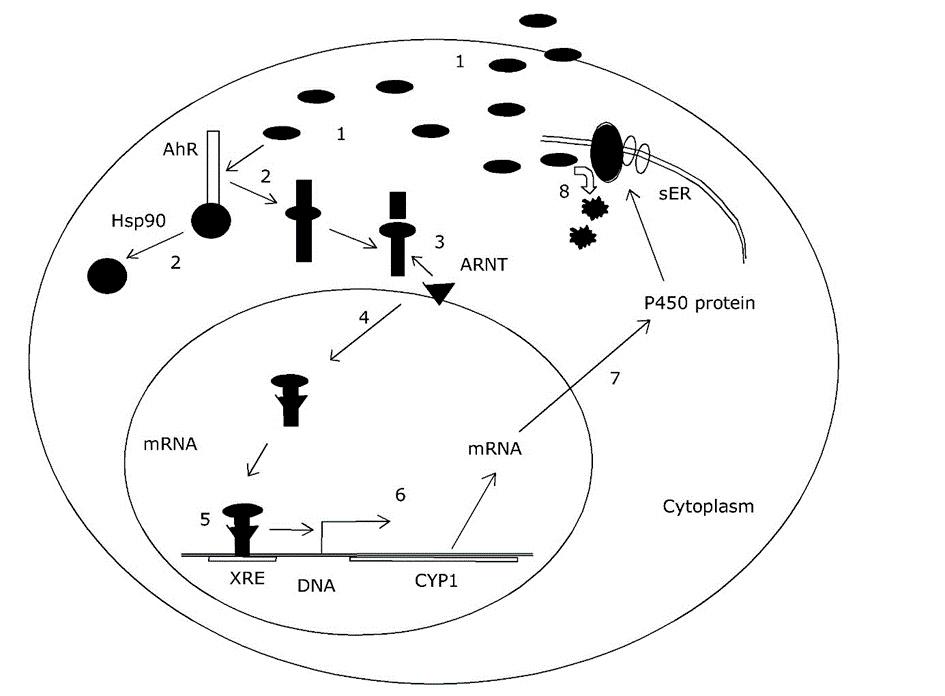
Вторинні ефекти біотрансформації
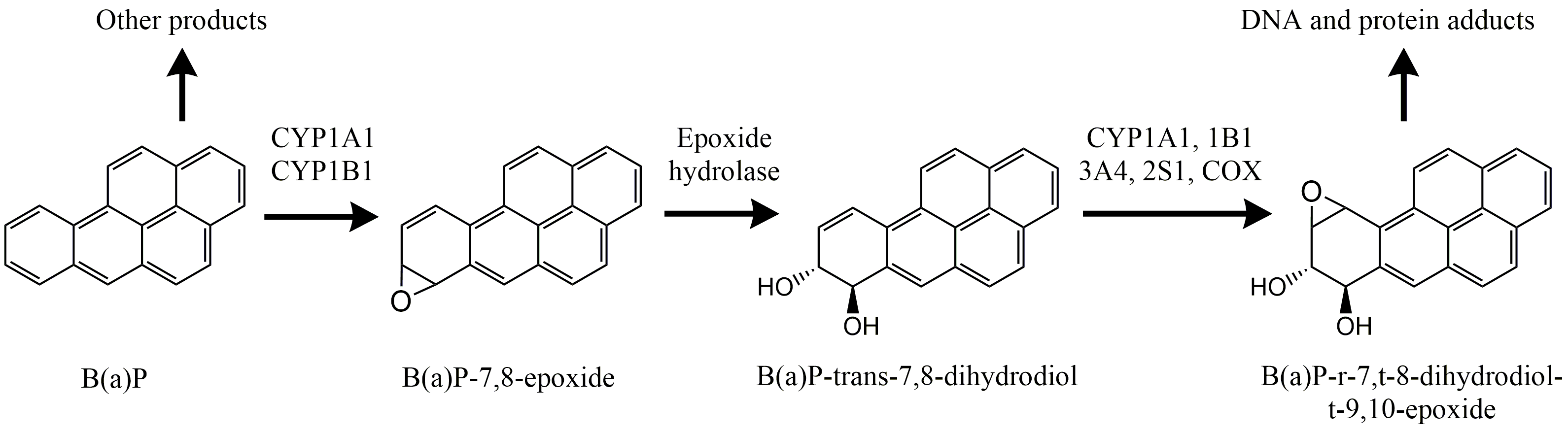
Хоча основною метою метаболізму ксенобіотиків є детоксикація та виведення сторонніх сполук, деякі шляхи біотрансформації фактично посилюють токсичність. В основному це пов'язано з першим кроком, активацією цитохромом Р450. Активація може призвести до проміжних метаболітів, які мають високу реакцію та фактичну причину токсичності. Найкращі досліджені приклади обумовлені біоактивацією поліциклічних ароматичних вуглеводнів (ПАУ), групи хімічних речовин, присутніх у дизельному паливі, сажі, сигаретному димі та обвуглених харчових продуктах. Багато з цих сполук, наприклад бензо (а) пірен, бенз (а) антрацен і 3-метилхолантрен, не є реактивними або токсичними як такі, але активуються цитохромом Р450 до надзвичайно реактивних молекул. Наприклад, бензо (а) пірен активується до діоло-епоксиду, який легко зв'язується з ДНК, особливо з вільною аміногрупою гуаніну (рис. 4). Комплекс називається аддуктом ДНК, подвійна спіраль локально порушується, і це призводить до мутації. Якщо це відбувається в онкогені, може розвинутися пухлина (див. Розділ про канцерогенез і генотоксичність).
Не всі ПАУ є канцерогенними. Їх активність критично залежить від просторової структури молекули, що знову-таки визначає її «прилягання» в рецептор Ач. ПАУ з «виїмкою» (часто називають bay-областю) в молекулі, як правило, є сильнішими канцерогенами, ніж сполуки з симетричною (круглою або лінійною) молекулярною структурою.
Інший механізм токсичності, спричиненої біотрансформацією, зумовлений деякими дуже непокірними хлорорганічними сполуками, такими як поліхлоровані дибензодіоксини (ПХДД, або коротко діоксини) та поліхлоровані біфеніли (ПХБ). Деякі з цих сполук є дуже потужними індукторами біотрансформації, але вони навряд чи деградують самі. Наслідком є те, що високорегульована активність цитохрому Р450 продовжує генерувати велику кількість реактивного кисню (ROS), викликаючи окислювальний стрес та пошкодження клітинних компонентів. Передбачається, що хронічна токсичність 2,3,7,8-тетрахлордибензо (пара) діоксину (TCDD), одного з найбільш токсичних сполук, що виділяються в результаті діяльності людини, обумовлена його високою здатністю індукувати тривалий окислювальний стрес. На молекулярному рівні існує тісний зв'язок між окислювальним стресом і біотрансформаційною активністю. Багато токсикантів, які в першу чергу викликають окислювальний стрес (наприклад, кадмій), також регулюють ферменти CYP. Два захисних механізми: захист від окислювального стресу та біотрансформація є частиною однієї інтегрованої системи захисту від стресу клітини.
Посилання
Буй, П.Х., Хсу, Е.Л., Ханкінсон, О. (2009), Гідропероксиди жирних кислот підтримують біоактивацію біоактивації бензоопосередкованої цитохрому P450 2S1 [а] пірен-7-8-дигідродіолу. Молекулярна фармакологія 76, 1044-1052.
Стромберг, Г.Дж., Заппей, Х., Стін, R.J.C.A., Ван Гестель, C.A.M., Ariese, Ф., Велторст, Н.Х., Ван Страален, Н.М. (2004). Біотрансформація ПАГ у наземних безхребетних - новий метаболіт II фази в ізоногих і весняних хвостах. Порівняльна біохімія та фізіологія, частина C 138, 129-137.
Тімбрелл, Дж. Принципи біохімічної токсикології. Тейлор і Френсіс Лтд, Лондон.
Ван Страален, Н.М., Рулофс Д. Вступ до екологічної геноміки, 2-е изд. Преса Оксфордського університету, Оксфорд.
Вермёлен, Н.П.Е., Ван ден Брук, Дж. М. Ім'я і розвиток хімічної речовини в de mens. Журнал «Хіміш». Март: 167-171.
Опишіть основні процеси, пов'язані з кожною з трьох загальних фаз метаболізму ксенобіотиків, а також задіяні молекулярні системи.
Урегулювання активності цитохрому Р450 є класичним прикладом регуляції шляхом посиленого de novo синтезу ферменту. Механізм відомий досить докладно і передбачає найрізноманітніші комплектуючі. Опишіть участь наступних компонентів
- Аріловий вуглеводневий рецептор
- Білок теплового шоку 70
- Арілвуглеводневий рецептор ядерний транслокатор
- Елементи ксенобіотичної відповіді
- Ген CYP1A1
- CYP1A1 мРНК
- Білок CYP 1A1
- CYP 1A1 ферментативна активність
У минулому активність цитохрому Р450 часто оцінювалася за допомогою синтетичного флуоресцентного субстрату - резоруфіну; активність вимірювалася як етоксирезоруфін-О-деетилаза (ЕРОД). Обговорити переваги та недоліки використання такого аналізу в оцінці екологічних ризиків.
4.1.5. Алометричні відносини
Автор: А. Ян Хендрікс
Рецензенти: Ніко ван ден Брінк, Ніко ван Страален
Цілі навчання:
Ви повинні вміти
- пояснити, чому алометрія важлива для оцінки ризиків щодо хімічних речовин та видів
- узагальнити, як біологічні характеристики, такі як споживання, тривалість життя та розмір шкали достатку
- опишіть, як токсикологічні величини, такі як рівень поглинання та смертельні концентрації, масштабуються до розміру
Ключові слова: розмір тіла, біологічні властивості, масштабування, крос-видова екстраполяція, розмірна кінетика поглинання
Вступ
У всьому світі зареєстровано понад 100 000 000 хімічних речовин. У Європейському Союзі понад 100 000 сполук очікують оцінки ризиків для захисту екосистеми та здоров'я людини, тоді як 1500 000 забруднених ділянок потенційно потребують очищення. Так само 8 000 000 видів, з яких 10 000 знаходяться під загрозою зникнення, потребують захисту у всьому світі, при цьому один втрачається на годину (Hendriks, 2013). Через фінансові, практичні та етичні обмеження (добробут тварин) емпіричні дослідження самі по собі не можуть охопити стільки речовин і видів, не кажучи вже про їх комбінації. Отже, традиційний підхід екотоксикологічного тестування поступово доповнюється або замінюється модельними підходами. Екологічні хіміки та токсикологи давно склали відносини, що дозволяють екстраполяцію між хімічними речовинами. На сьогоднішній день так звані відносини кількісної структури активності (QSAR) забезпечують накопичення та оцінки токсичності сполук на основі їх фізико-хімічних властивостей. Наприклад, фактори біоакумуляції та середні летальні концентрації були пов'язані з молекулярним розміром та розподілом октанол-води, характерними властивостями хімічної речовини, які зазвичай доступні в процесі його промислового виробництва.
За аналогією з підходом QSAR в хімії навколишнього середовища може бути поставлено питання, чи можна передбачити токсикологічні, фізіологічні та екологічні характеристики видів за біологічними ознаками, особливо ознаками, які легко вимірюються, наприклад, розміром тіла. Цей підхід пішов під назвою «Кількісні відносини чутливості видів» (QSSR) (Notenboom, 1995).
Серед різних доступних рис особливий інтерес представляє розмір тіла. Це легко виміряти, і значну частину мінливості між організмами можна пояснити з розміру тіла, з r 2 > 0,5. Не дивно, що розмір тіла також відіграє важливу роль в токсикології та фармакології. Наприклад, токсичні кінцеві точки, такі як LC 50 с, часто виражаються на кг маси тіла. Рекомендовані значення добового споживання припускають «стандартну» масу тіла, часто 60 кг. Тим не менш, дорослі люди можуть відрізнятися за масою тіла в 3 рази, а різниця між мишею і людиною ще більша. Тут буде досліджено, як відносини розміру тіла, які давно вивчалися в порівняльній біології, впливають на екстраполяцію в токсикології і можуть бути використані для екстраполяції між видами.
Основи масштабування в біології
Чи очікуєте ви, що слон вагою 10 4 кг з'їсть в 10 4 разів більше, ніж 1 кг кролика на день? Або менше, або більше? На запитання більшість людей інтуїтивно придумують правильну відповідь. Дійсно, щоденне споживання хобоцидом менше в 10 4 разів більше, ніж у гризуна. Отже, кількість їжі або води, що вживається на кілограм маси тіла слона, менше, ніж у кролика. Тим не менш, наскільки точно менше? І чому для підтримки 1 кг тканини кролика потрібно більше енергії, ніж 1 кг плоті слона в першу чергу?
Століття досліджень (Peters, 1983) продемонструвало, що багато біологічних характеристик Y масштабуються до розміру X відповідно до силової функції:
Y = а х б
де незалежна змінна X представляє масу тіла, а залежна змінна Y може бути практично будь-якою цікавою характеристикою, починаючи, наприклад, від зябрової площі риби до щільності комах у спільноті.
Покладене на графіку рівняння створює вигнуту лінію, збільшуючи надлінійно, якщо b > 1, і підлінійно, якщо b < 1. Якщо b=1, Y і X прямо пропорційні, а співвідношення називається ізометричним. Оскільки криві лінії важко інтерпретувати, рівняння часто спрощується, беручи логарифм лівої та правої частин. Формула тоді стає:
журнал Y = журнал а + б журнал X
Коли журнал Y наноситься на колоду X, пряма лінія призводить до нахилу b і перехоплення журналу a. Якщо дані побудовані таким чином, параметр нахилу b може бути оцінений простою лінійною регресією.
У широких розмірних діапазонах нахил b часто виявляється безліччю ¼ або, зрідка, ⅓. Норми [кг∙d -1] споживання, зростання, відтворення, виживання і що ні, збільшуються з масою до потужності ¾, тоді як константи швидкості, іноді звані питомими нормами [кг∙кг -1 ∙d -1], зменшуються з масою до потужності -¼. Так, поки слон на 10 4 кг важче 1 кг кролика, він щодня їсть лише (10 4) ¾ = 10 3 рази більше. Навпаки, 1 кг хобоцида, мабуть, вимагає споживання (10 4) -¼ кг∙кг -1 ∙d -1, тобто в 10 разів менше. Змінні з часовою розмірністю [d], як тривалість життя або періоди коливань хижака-здобич, змінюються обернено до констант швидкості і, таким чином, змінюються з масою тіла до потужності ¼. Так, слон стає (10 4) ¼ = в 10 разів старше кролика. Велика кількість особин на площу поверхні [м -2] зменшується з масою тіла до потужності -¾. Області, такі як зяброва поверхня або домашній діапазон, масштабуються обернено до достатку, як правило, як маса тіла до потужності ¾.
Тепер, чому для утримання 1 кг слона потрібно в 10 разів менше їжі, ніж 1 кг кролика? Біологи, фармакологи і токсикологи спочатку приписували цю різницю співвідношенням площі та обсягу. Якщо порівнювати предмети однакової форми, але різного розміру, об'єм збільшується з довжиною до потужності 3, а поверхня збільшується з довжиною до потужності 2. Для сфери з радіусом r, наприклад, площа A та об'єм V збільшуються як A ~ r 2 та V ~ r 3, тому площа масштабується до об'єму як A ~ r 2 ~ (V ⅓) 2 ~ V ⅔. Так, більші тварини мають відносно менші поверхні, до тих пір, поки форма організму залишається колишньою. Оскільки багато біологічних процесів, таких як поглинання кисню та їжі або втрати тепла, мають справу з поверхнями, метаболізм довгий час вважалося сповільнюватися, як геометричні структури, тобто з безліччю ⅓. Тим не менш, емпіричні регресії, наприклад, «крива миша-слона», розроблена Максом Клейбером на початку 1930-х років, показують універсальний нахил ¼ (Peters, 1983. Це стало називатися «законом Клейбера». Хоча дані не залишають сумнівів у тому, що це так, зовсім не зрозуміло, чому це повинно бути ¼, а не ⅓. Було запропоновано кілька пояснень щодо нахилу ¼, але дискусія щодо точного значення, а також основного механізму триває.
Застосування скейлінгу в токсикології
Оскільки хімічні речовини переносяться потоками повітря і води, а всередині організму соком і кров'ю, очікується, що токсикокінетика і токсикодинаміка також масштабуються до розмірів. Дійсно, дані підтверджують, що константи швидкості поглинання та елімінації зменшуються з розміром, з показником приблизно -¼ (рис. 1). Схили варіюються навколо цього значення, тим більше для регресій, які охоплюють невеликі діапазони розмірів і фізіологічно різні організми. Перехоплення визначається опорами в неперемішаних водних шарах і мембранах, через які проходять речовини, а також затримками потоків, якими вони переносяться. Опір в основному залежать від спорідненості та молекулярного розміру хімічних речовин, відображених, наприклад, коефіцієнтом розподілу октанол-вода K ow для органічних хімічних речовин або атомною масою для металів. Верхня межа перехоплення встановлюється затримками, що накладаються споживанням і, згодом, викиданням і виділенням. Нижній кінець визначається розведенням росту. Як поглинання, так і елімінаційна шкала до маси з однаковим показником, так що їх співвідношення, що відображає коефіцієнт біоконцентрації або біомагніфікації в рівновазі, не залежить від розміру тіла.
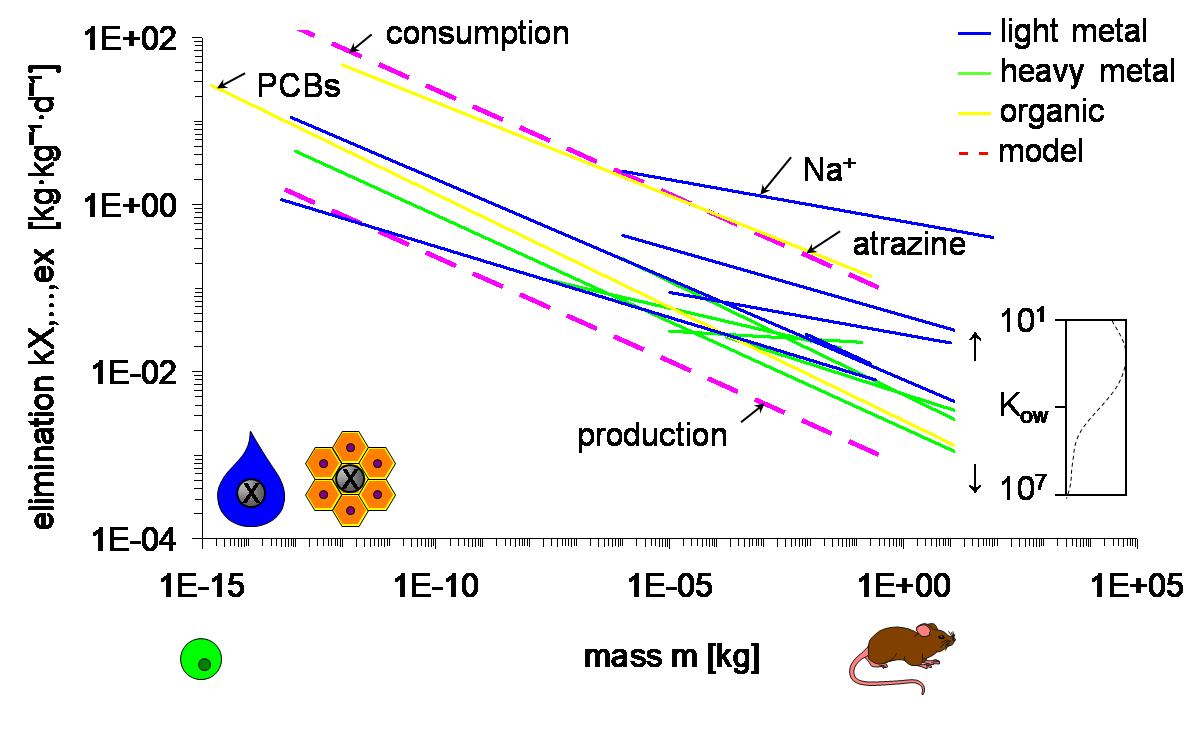
Масштабування констант швидкості для поглинання та елімінації, як на малюнку 1, передбачає, що дрібні організми досягають заданої внутрішньої концентрації швидше, ніж великі. Навпаки, смертельні концентрації у воді або їжі, необхідні для досягнення того ж внутрішнього рівня після однакової (короткочасної) тривалості впливу, нижчі у менших порівняно з більшими організмами. Таким чином, уявну «чутливість» дафнідів можна, хоча б частково, віднести до їх невеликого розміру тіла. Це підкреслює необхідність розуміння простих масштабування відносин, перш ніж розвиватися до більш складних пояснень.
Використовуючи рис. 1, можна в строгих умовах, не розроблених тут, теоретично пов'язати серединні летальні концентрації LC 50 [мкг L -1] з K ow хімічної речовини і розміром організму, з r 2 > 0,8 (Hendriks, 1995; табл. 1). Складні відповіді, такі як сприйнятливість до токсикантів, можна передбачити лише з K ow та розміру тіла, що ілюструє загальність та потужність алометричного масштабування. Звичайно, регресії описують загальні тенденції і в окремих випадках відхилення можуть бути великими. Проте, враховуючи виклики оцінки ризиків, як зазначено вище, і за відсутності конкретних даних прогнози в таблиці 1 можна розглядати як розумне перше наближення.
Таблиця 1. Смертельні концентрації та дози як функція маси тіла досліджуваної тварини
|
Види |
кінцевої точки |
Одиниця |
b (95% ДІ) |
р 2 |
п с |
н с |
Джерело |
|
Гуппі |
ЖК 50 |
мг∙л -1 |
0.66 (0.51-0.80) |
0,98 |
6 |
1 |
1 |
|
Ссавці |
ЛД 10 ≈МТД |
мг∙тварина -1 |
0,73 |
0,69‑0,77 |
27 |
5 |
2 |
|
Птахи |
Оральний LD 50 |
мг∙тварина -1 |
1.19 (0,67-0,82) |
0,76 |
194 |
3... 37 |
3 |
|
Ссавці |
Оральний LD 50 |
мг∙тварина -1 |
0,94 (1,18-1.20) |
0,89 |
167 |
3... 16 |
4 |
|
Ссавці |
Оральний LD 50 |
мг∙тварина -1 |
1.01 (1.00-1.01) |
> 5000 |
2... 8 |
5 |
MTD = максимальна порогова доза, повторне дозування. LD 50 разова доза, b = нахил лінії регресії, n c = кількість хімічних речовин, n s = кількість видів. Джерела: 1 Андерсон і Вебер (1975), 2 Тревіс і Уайт (1987), 4 Зразок і Ареналь (1999), 5 Бурзала-Ковальчик і Джонблуд (2011).
Алометрія також важлива при роботі з іншими рівнями біологічної організації. Листова або зяброва область, кількість яйцеклітин в яєчниках, кількість типів клітин та багато інших клітинних і органних характеристик також масштабуються до розміру тіла. Так само внутрішні темпи збільшення (r) популяцій та коефіцієнти виробництва та біомаси (P/B) громад також можуть бути отримані з (середньої) маси виду. Навіть площа, необхідна тваринам в лабораторних аналізах, масштабується до розмірів, тобто на м ¾, приблизно такий же ухил відзначається для домашніх ареалів особин в полі.
Перспективи майбутнього
Оскільки практично будь-який фізіологічний і екологічний процес в токсикокінетиці і токсикодинаміці залежить від розміру виду, інтерес набирають алометричні моделі. Такий підхід дозволяє кількісно віднести викиди (як, мабуть, «чутливі» дафніди) до простих біологічних ознак, а не детальним хіміко-токсикологічним механізмам.
Масштабування використовується в оцінці ризику на молекулярному рівні протягом тривалого часу. Молекулярний розмір сполуки часто є дескриптором у QSAR для накопичення та токсичності. Якщо не відразу видно, як молекулярна маса, обсяг або площа часто вискакують як показник стеричних властивостей. Масштабування стосується не тільки біоакумуляції та токсичності від молекулярного до рівня спільноти, залежність від розміру також спостерігається в інших розділах ланцюга причинно-наслідкових наслідків навколишнього середовища. Викиди речовин, наприклад, масштабуються нелінійно до розмірів двигунів і міст. Концентрації хімічних речовин в річках залежать від скиду води, що само по собі є алометричною функцією розміру водозбору. Отже, розуміння принципів міждисциплінарного масштабування, ймовірно, окупиться в захисті багатьох видів від багатьох хімічних речовин.
Посилання
Андерсон, П.Д., Вебер, Л.Дж. (1975). Токсична реакція як кількісна функція розміру тіла. Токсикологія та прикладна фармакологія 33, 471-483.
Бурзала-Ковальчик, Л., Джонблуд, Г. Алометричне масштабування: Аналіз даних LD50. Аналіз ризиків 31, 523-532.
Хендрікс, А.Дж. Моделювання реакції видів на мікрозабруднення: Порівняльна екотоксикологія за (суб) летальними навантаженнями тіла як функція видового розміру та октанол-водного поділу хімічних речовин. Екотоксикологія та екологічна безпека 32, 103-130.
Хендрікс А.Й. Як боротися з 100 000+ речовин, ділянок та видів: Загальні принципи оцінки екологічних ризиків. Екологічна наука і технологія 47, 3546−3547.
Хендрікс, А.Й., Ван дер Лінде, А., Корнеліссен, Г., Сійм, Д.Т.Х.М. (2001). Потужність розміру: 1. Швидкість константи і рівноважні співвідношення для накопичення органічних речовин. Екологічна токсикологія та хімія 20, 1399-1420.
Нотенбум, Дж., Ваал, М.А., Хокстра, Д.А. (1995). Використання порівняльної екотоксикології для розробки кількісних взаємозв'язків чутливості видів (QSSR). Наука про навколишнє середовище та дослідження забруднення 2, 242-243.
Пітерс, Р.Х. (1983). Екологічні наслідки розміру тіла. Кембриджський університетський прес, Кембридж.
Зразок, B.E., Arenal, C.A. (1999) Алометричні моделі для міжвидової екстраполяції даних токсичності дикої природи. Бюлетень забруднення навколишнього середовища та токсикології 62, 653-66.
Travis, C.C., White, R.K. (1988) Міжвидове масштабування даних токсичності. Аналіз ризиків 8, 119-125.
Подумайте про біологічну рису, яка вас цікавить. Як ви думаєте, як він буде масштабуватися до розміру організму?
Яка константа швидкості елімінації хімікату з K ow 10 4 від комахи масою 10 -5 кг?
Чому масштабування розмірів є більш помітним у токсикокінетиці, ніж у токсикодинаміці?
4.1.6. Передача харчового ланцюга
Автор: Ніко ван ден Брінк
Рецензенти: Кіс ван Гестель. Ян Хендрікс
Цілі навчання:
Ви повинні вміти:
- Згадайте про хімічні властивості, що визначають потенціал хімічних речовин накопичуватися в харчових ланцюгах
- Поясніть роль біологічних та екологічних чинників у харчовому ланцюзі накопичення хімічних речовин
Ключові слова: біомагніфікація, перенесення харчового ланцюга,
Накопичення хімічних речовин на різних трофічних рівнях.
Хімічні речовини можуть передаватися від одного організму до іншого. Грейзери будуть приймати хімічні речовини, які знаходяться в рослинності, яку вони їдять. Аналогічним чином хижаки піддаються впливу хімічних речовин у своїх предметах видобутку. Це так зване накопичення харчової павутини регулюється властивостями хімічної речовини, а також деякими ознаками організму, що приймає (наприклад, грейзер або хижак).
Хімічні властивості сприяють накопиченню харчового полотна
Відомо, що деякі хімічні речовини накопичуються в харчових павутині, досягаючи найвищих концентрацій у верхніх хижаків. Прикладами таких хімічних речовин є хлорорганічні пестициди, такі як ДДТ та бромовані антипірени (наприклад, ПБДЕ; див. розділ про СОЗ). Такі хімічні речовини, що накопичуються, мають кілька спільних властивостей: вони повинні бути стійкими, і вони повинні мати спорідненість до організму організму. Органічні хімічні речовини з відносно високим log Kow, що вказує на високу спорідненість до ліпідів, будуть надходити в організми досить ефективно (див. Розділ про моделювання біоконцентрації та кінетики). Потрапивши в організм, ці хімічні речовини будуть розподілятися на багаті ліпідними тканинами, і виведення досить обмежене. У разі стійких хімічних речовин, які не метаболізуються, концентрації з часом збільшуватимуться, коли поглинання вище, ніж екскреція. Крім того, такі хімічні речовини, ймовірно, будуть передані організмам на наступному трофічному рівні у випадку взаємодії з хижаком. Деякі з цих хімічних речовин можуть метаболізуватися організмом, найчастіше у більш розчинні у воді метаболіти (див. Розділ про метаболізм та захист ксенобіотиків). Ці метаболіти легше виводяться, і таким чином концентрації метаболізуваних хімічних речовин не так сильно збільшуються з часом, і, отже, також переносяться менше до більш високих трофічних рівнів. Вплив метаболізму на внутрішні концентрації організмів наочно ілюструється дослідженням поглинання органічних хімічних речовин різними водними видами (Kwok et al., 2013). У цьому дослідженні поглинання стійких хімічних речовин (хлорорганічних пестицидів; OCP) порівнювали з поглинанням хімічних речовин, які можуть метаболізуватися (поліциклічні ароматичні вуглеводні; ПАУ). Автори порівняли креветки з рибою, перші мають обмежену здатність метаболізувати ПАУ, тоді як риба може. На малюнку 1 показані фактори накопичення біота-осаду (BSAF; див. Розділ про Біоакумуляцію), що є співвідношенням між концентрацією в організмі та в осаду. Показано, що ОСП накопичуються значною мірою в обох видах, відображаючи стійкі, що не метаболізуються хімічні речовини. Для ПАУ результати різні для кожного виду, риби здатні метаболізуватися, і в результаті концентрації ПАУ в рибі низькі, тоді як у креветок, з обмеженою метаболічною здатністю, накопичення ПАУ можна порівняти з ОСП. Ці результати показують, що важливими є не тільки властивості хімічних речовин, але і деякі риси залучених організмів, в даному випадку метаболічна здатність.
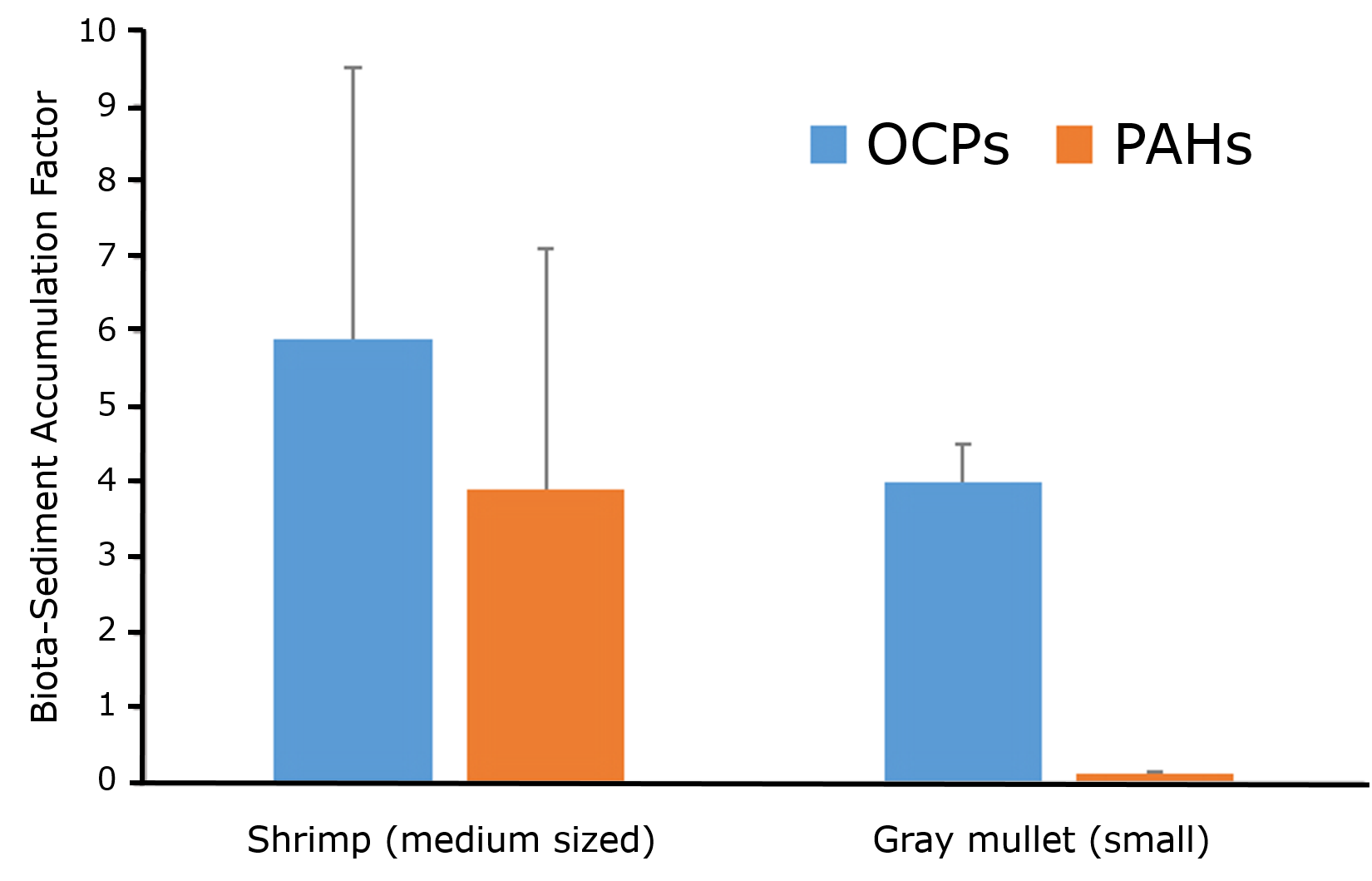
Вплив видових ознак та структури харчового полотна на накопичення харчової павутини
Накопичення хімічних речовин в харчовій павутині обумовлюється поглинанням їжі. При нижчих трофічних рівнях більшість організмів придбають відносно низькі концентрації з навколишнього середовища. По-перше, споживачі, що харчуються на цих організмах, будуть накопичувати хімічні речовини всіх з них, а в разі стійких хімічних речовин, які потрапляють в організм легко, концентрації у споживачів будуть вище, ніж в їх раціоні. Аналогічно концентрації будуть збільшуватися при переході хімічних речовин на наступний трофічний рівень. Цей процес називається біомагніфікацією, що вказує на збільшення концентрації стійких і накопичувальних хімічних речовин в харчових павутині. Найбільш знаковим прикладом цього є збільшення концентрації DDT у рибі, що їсть американську скопу (рис. 2), що призвело до заборони багатьох хлорорганічних хімічних речовин.
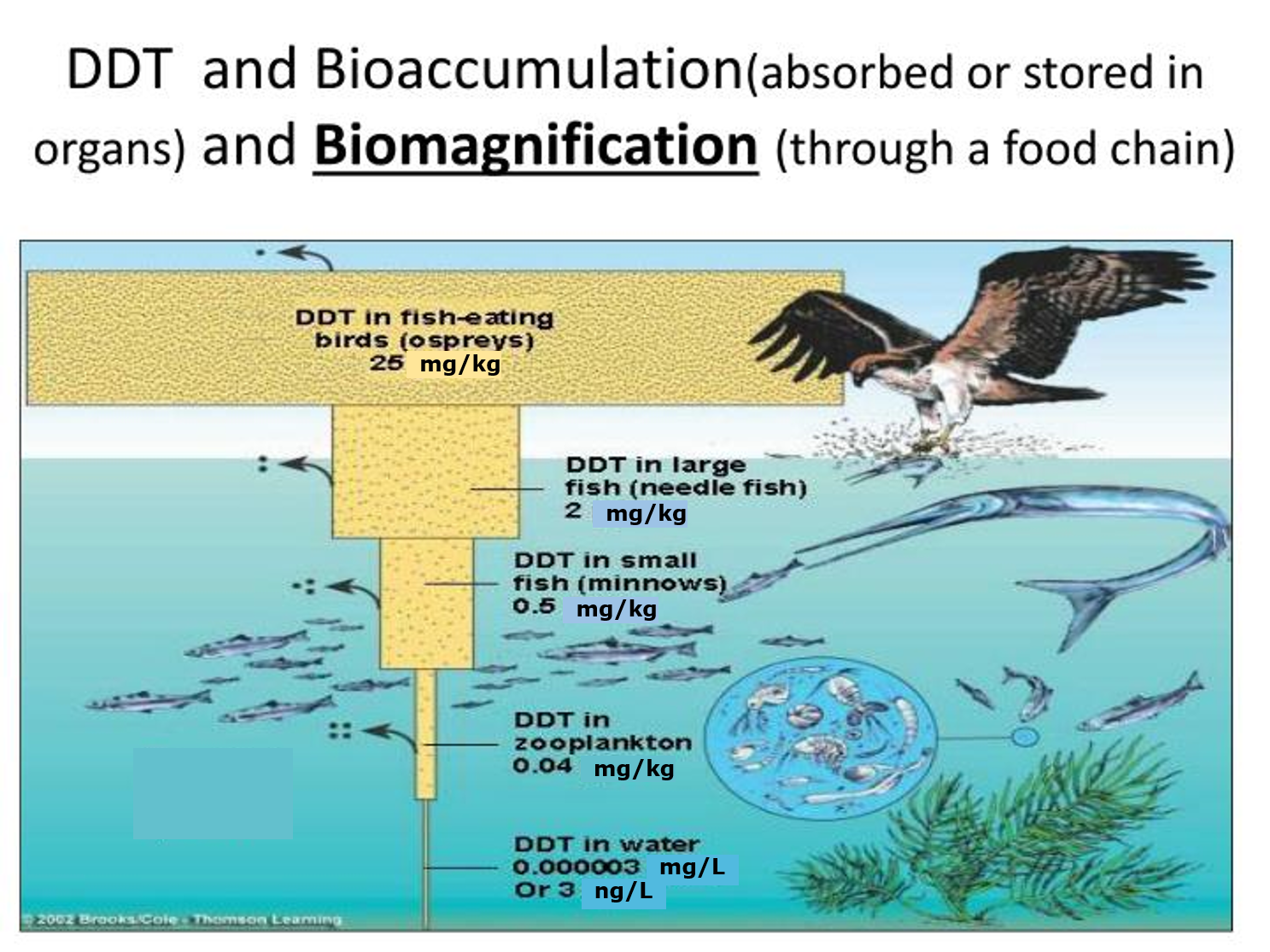
Оскільки біомагніфікація вздовж трофічних рівнів керується їжею, важливо включити склад дієти в дослідження. Це можна пояснити прикладом на дрібних ссавців в Нідерландах. Два подібні дрібні види ссавців, берегова полівка (Myodes glareolus) та звичайна полівка (Microtus arvalis), зустрічаються у більшій частині Нідерландів. Хоча види виглядають дуже схожими, вони різні за своїм раціоном і середовищем існування використання. Берегова полівка - всеїдний вид, що мешкає в різних типах середовища проживання, тоді як полівка звичайна строго вегетаріанська, що живе на пасовищах. У дослідженні щодо видового поглинання кадмію були проаналізовані продукти харчування обох видів, вказуючи на майже 3 порядку відмінностей у концентраціях кадмію між дощовими черв'яками та ягодами рослинності (рис. 3A, van den Brink et al., 2010). Стабільні ізотопні співвідношення вуглецю та азоту використовували для оцінки загального раціону організмів. Звичайна полівка харчувалася переважно жалючою кропивою і травою, включаючи насіння, тоді як берегова полівка показала корм травами та дощовими черв'яками. Ця різниця в раціоні відбилася в підвищеній концентрації кадмію в банківській полівці в порівнянні з звичайною полівки (обидві мешкають в одній місцевості). Концентрації однієї берегової полівки виявилися надзвичайно низькими (червоний алмаз на рис. 3б), і спочатку це вважалося артефактом. Однак детальний аналіз стабільних ізотопних співвідношень у цієї особи виявив, що вона харчувалася на кропиві та траві, отже, дієта більше відображає звичайну полівку. Це ще раз підкреслює, що організми накопичуються через свій раціон (ви накопичуєте те, що їсте!)
Тематичні дослідження
Коски або косатки (Orcinus orca) - великі морські хижі ссавці, які бродять по всьому океану, від Північного Льодовитого до глибокого південного регіону Антарктики. Хоча вони з'являються повсюдно у всьому світі, як правило, різні стручки косаток зустрічаються в різних регіонах морської екосистеми. Часто кожен стручок розробив спеціалізовану кормову поведінку, орієнтовану на конкретні види видобутку. Хоча коси, як правило, є вершинами верхніх хижаків у верхній частині (місцевої) харчової павутини, різні стратегії фуражу припускають, що вплив накопичених хімічних речовин може значно відрізнятися між стручками. Це дійсно було показано в дуже детальному дослідженні різних стручків косаток західного узбережжя Канади Ross et al. (2000). У регіоні Ванкувера є резидент стручок, тоді як регіон також часто відвідують дві перехідні групи косаток. Концентрації ПХБ були високими у всіх тварин, але перехідні тварини містили значно вищі рівні. Перехідні кити в основному харчувалися морськими ссавцями, тоді як тварини-резиденти в основному харчуються рибою, і ця різниця в раціоні, як вважалося, є причиною відмінностей у рівнях PCB між групами. У цьому дослідженні також було показано, що рівень ПХБ збільшувався з віком через стійкість друкованих плат, тоді як жіночі косаки містили значні нижчі концентрації ПХБ. Останнє викликано лактацією самки корок, під час якої вони годують своїх телят багатим ліпідними молоком, що містить відносно високий рівень (ліпофільних) ПХБ. Цим процесом самки розвантажують великі частини свого навантаження на тіло друкованої плати, однак, переносячи ці друковані плати своїм телятам, що розвиваються (див. Також рисунок 3 у розділі про біоакумуляцію). Недавнє дослідження показало, що хоча друковані плати заборонені протягом десятиліть, вони все ще становлять загрозу для популяцій косаток (Deforges et al., 2018). У цьому дослідженні були підтверджені регіональні відмінності в обтяженні друкованих плат, ймовірно, через відмінності в дієтичних уподобаннях, хоча і не згадується конкретно. Було показано, що рівні ПХБ у більшості популяцій Orca все ще перевищували токсичні порогові рівні, і були висловлені занепокоєння щодо життєздатності цих популяцій. Це дослідження підтверджує, що 1) Коски піддаються різному рівню ПХБ відповідно до їх раціону харчування, що впливає на біомагніфікацію ПХД, 2) Популяції Orca дуже неефективні для очищення ПХБ від людини через невеликий метаболізм, а також від населення через ефективну материнську перенесення від матері до телят, і 3) стійкі, що накопичуються хімічні речовини можуть становити загрозу для організмів навіть через десятиліття після їх використання. Розуміння механізмів та процесів, що лежать в основі біомагніфікації стійких та токсичних сполук, має важливе значення для глибокої оцінки ризику.
Посилання
Дефорж, Ж.-П., Холл, А., Макконнелл, Б., Розінг-Асвід, А., Барбер, Дж.Л., Браунлоу, А., Де Гіз, С., Еулаерс, І., Джепсон, П.Д., Летчер, Р.Дж., Левін, М., Росс, П.С., Самарра, Ф., Вінгсон, Г., Сонн, С., Дівінг, С., Ец Р. Прогнозування глобального колапсу популяції китів від забруднення друкованих плат. Наука 361, 1373-1376.
Форд, Дж.К.Б., Елліс, Г.А., Маткін, Д.Р., Балкомб, К.К., Бріггс, Д., Мортон, А.Б. (2005). Напади косатки на полосатиків: захоплення здобичі та тактика проти хижаків. Наука про морських ссавців 21, 603-618.
Гвіне, К. (1992). Хижацька поведінка косаток (Orcinus orca) навколо островів Грозет. Канадський журнал зоології 70, 1656-1667.
Квок, К.К., Лян, Ю., Люн, С.Ю., Ван, Х., Донг, Ю.Х., Янг, Л., Гісі, Дж. П., Вонг, М.Х. (2013). Фактор накопичення біота-осаду (BSAF), фактор біоакумуляції (BAF) та рівні забруднюючих речовин у видобутковій рибі для вказівки ступеня забруднення ПАУ та ОСП у яйцях водоплавних птахів. Наука про навколишнє середовище та дослідження забруднення 20, 8425-8434.
Росс, П.С., Елліс, Г.М., Іконому, М.Г., Барретт-Леннард, Л.Г., Аддісон, Р.Ф. (2000). Високі концентрації друкованих плат у вільних тихоокеанських китах-вбивць, Orcinus orca: Вплив віку, статі та дієтичних уподобань. Бюлетень забруднення моря 40, 504-515.
Самарра, Ф.І.П., Бассой, М., Бесо, Дж., Еліасдоттір, М.О., Гуннарссон, К., Мрусок, М.Т., Расмуссен, М., Ремпель, Дж., Торвальдссон, Б., Вікінгссон, Г.А. (2018). Видобуток косатки (Orcinus orca) в Ісландії. Плос Один 13, 20.
ван ден Брінк, Н., Ламмертсма, Д., Диммерс, В., Бурвінкель, М.-К., ван дер Хаут, А. Вплив властивостей ґрунту на накопичення харчової павутини важких металів у деревної миші (Apodemus sylvaticus). Забруднення навколишнього середовища 158, 245-251.
В озері екосистема складається з водоростей, дафнідів, що живляться водоростями, і риб, що харчуються дафнідами. Хімічна речовина А має низький Long K ow, але стійкий. Хімічна B має високий Log K ow, але може метаболізуватися дафнідами та рибою, а хімічна С має високий Log K ow і також стійкий. Де ви можете знайти найвищі концентрації хімічних A, B і C?
Назвіть дві ознаки видів, що визначають потенціал для хімічних речовин досягти високих концентрацій у ньому.
Це більш загальне питання, намагаючись розмістити інформацію в тексті цього розділу про біоакумуляцію на різних трофічних рівнях в більш широкому ракурсі:
Яка властивість хімічної речовини, окрім високого потенціалу біоакумуляції та стійкості, має високу ймовірність виникнення серйозних екологічних ризиків для організмів?
4.1.7. Критична концентрація тіла
Автор: Мартіна Григорівна Вайвер
Рецензенти: Кіс ван Гестель та Френк Гобас
Цілі навчання:
Ви повинні вміти
- описати концепцію критичної концентрації тіла (CBC) для оцінки токсичності хімічних речовин.
- графічно пояснити концепцію CBC і зробити різницю між повільною і швидкою кінетикою.
- згадати випадки, коли підхід CBC не вдається.
Ключові слова:
Ефекти залежні від часу, внутрішні концентрації тіла, модель одного відсіку
Вступ
Одним із завдань екотоксикології є те, як зв'язати токсичність з впливом та зрозуміти, чому деякі організми відчувають токсичні ефекти, тоді як інші не мають однакового рівня впливу. Загальноприйнятим підходом до оцінки можливого несприятливого впливу на біоту, незалежно від того, який вид, є концепція критичної концентрації тіла (CBC) (McCarty 1991). Відповідно до цієї концепції токсичність визначається кількістю споживаної хімічної речовини, так внутрішньою концентрацією, яка має зв'язок з тривалістю впливу, а також концентрацією експозиції.
На малюнку 1 показана залежність між розвитком з часом внутрішніх концентрацій хімічної речовини в організмі і часом, коли смертність настає при різних концентраціях впливу при постійному впливі. Незалежно від часу впливу або концентрації впливу, смертність відбувається при більш-менш фіксованій внутрішній концентрації. CBC визначається як найвища внутрішня концентрація речовини в організмі, яка викликає певний ефект, наприклад, 50% смертності або 50% зменшення кількості виробленого потомства. Порівнюючи внутрішні концентрації, виміряні в підданих організмах, зі значеннями CBC, отриманими в лабораторії, отримують міру ризику. CBC застосовується до летальності, а також до сублетальних ефектів, таких як розмноження або гальмування росту.
Відносно токсичності до токсикокінетики
З малюнка 1А також може з'ясуватися, що хімічні речовини, які мають швидку кінетику поглинання, досягнуть CBC швидше, ніж хімічні речовини, які мають повільну кінетику (див. Розділ про кінетику біоакумуляції). Як наслідок, також час досягнення постійної LC 50 (вказується як кінцева LC 50: LC 50 ¥; рис. 1B) залежить від кінетики. Отже, як токсичні ефекти, так і хімічна концентрація контролюються тією ж кінетикою. CBC може бути отриманий з LC 50 -часовий зв'язок і бути пов'язаний з LC 50 ¥, використовуючи константи швидкості поглинання та елімінації (k 1 і k 2). Слід зазначити, що k 2 в цьому випадку відображає не швидкість хімічної екскреції, а скоріше швидкість усунення токсичних ефектів, викликаних хімічною речовиною (отже, зверніть увагу на різницю тут з Розділом про кінетику біоакумуляції).
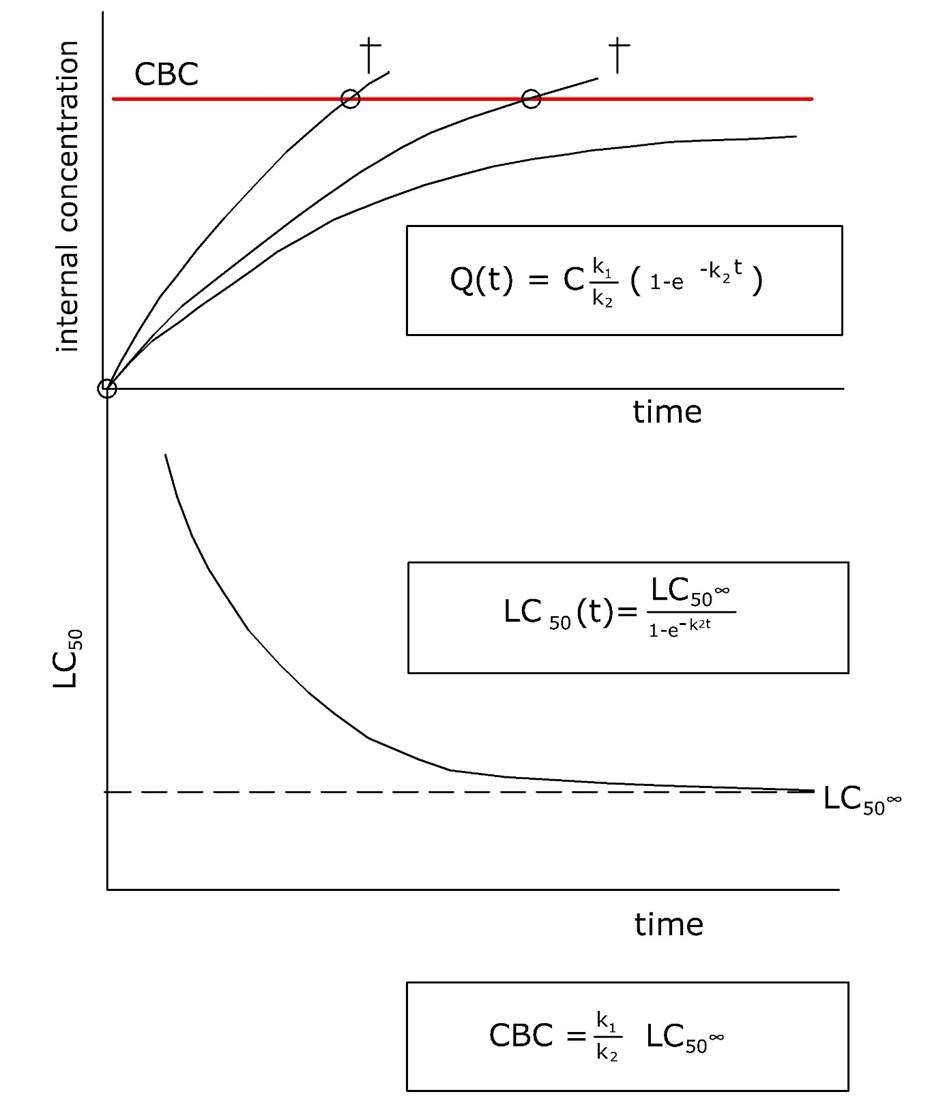

Час, необхідний для досягнення стійкого стану, залежить від розміру тіла організмів, причому більші організми потребують більше часу, щоб досягти стійкого стану в порівнянні з меншими організмами (McCarty 1991). Час, необхідний для досягнення стійкого стану, залежить також від площі поверхні опромінених організмів (Pawlisz and Peters 1993), а також від їх метаболічної активності. Організми, не здатні виводити або метаболізувати хімічну речовину, продовжуватимуть накопичуватися з часом, а LC 50 ¥ буде дорівнює нулю. Це, наприклад, стосується кадмію в ізоподах (Crommentuijn et al. 1994), але кінетика настільки повільна, що кадмій у цих тварин ніколи не досягає смертельних концентрацій у відносно чистих середовищах, оскільки їх тривалість життя занадто короткий.
CBC інтегрує екологічно доступні фракції з біодоступними концентраціями та токсичністю на конкретних рецепторах (McCarty and MackAy 1993). Див. також Розділ про біодоступність. Таким чином, фактична концентрація впливу в навколишньому середовищі не повинна бути відома для проведення оцінки ризику. Внутрішня концентрація хімічної речовини в організмі є єдиною концентрацією, необхідною для оцінки ризику. Тому багато труднощів долаються щодо проблем біодоступності, наприклад, це усуває деякі недоліки концентрації експозиції, вираженої на одиницю ґрунту, а також боротьби з експозиціями, які змінюються з часом або простором.
Доказ концепції CBC
Було зібрано переконливий корпус доказів на підтримку підходу CBC. Для органічних сполук з наркотичним способом дії ефекти можуть бути оцінені в широкому діапазоні організмів, тестових сполук і експозиційних середовищ. Для наркотичних сполук з коефіцієнтами поділу октанол-вода (K ow), що варіюються від 10 до 1000000 (докладніше див. Розділ про відповідні хімічні властивості), концентрація хімічної речовини, необхідної для летальності через наркоз, становить приблизно 1-10 ммоль/кг: рис. 2 (МакКарті і Маккей (1993).
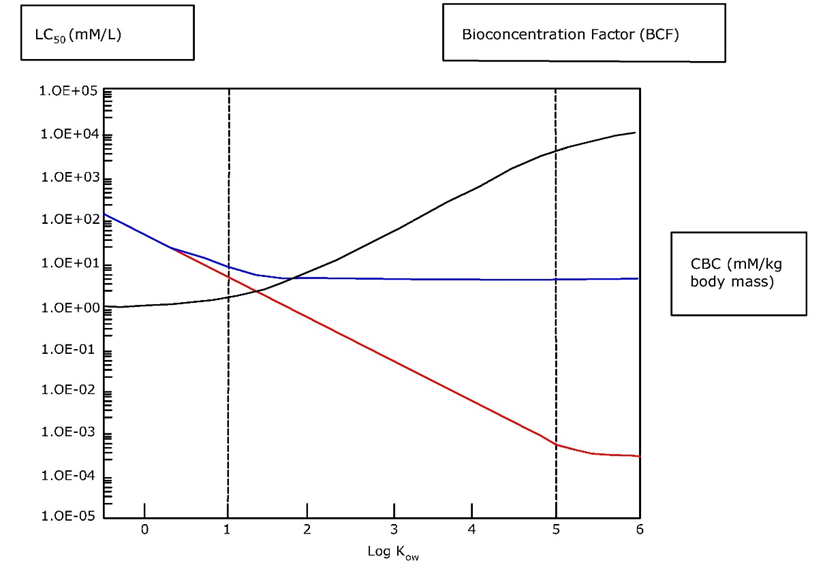
Для зменшення варіації значень фактора біоконцентрації (BCF) для накопичення хімічних речовин у організмах з води запропоновано нормалізацію вмісту ліпідів, що дозволяє визначити хімічну активність в організмі (US EPA 2003). З цієї причини протоколи екстракції ліпідів інтенсивно описуються в оновленому Керівництві ОЕСР щодо тестування хімічних речовин № 305 для тестів біоакумуляції риб, а також графік відбору проб вимірювання ліпідів у рибі. Корекція БКФ на відмінності вмісту ліпідів також описана в тому ж керівництві ОЕСР № 305. Якщо хімічний і ліпідний аналізи були проведені на одній і тій же рибі, це вимагає корекції відповідного вмісту ліпідів кожної окремої виміряної концентрації в рибі. Це слід зробити до використання даних для розрахунку кінетичного БКФ. Якщо вміст ліпідів не вимірюється на всіх відібраних рибах, середній вміст ліпідів приблизно 5% повинен бути використаний для нормалізації BCF. Слід зазначити, що ця корекція застосовується лише для хімічних речовин, що накопичуються в ліпідах, а не для хімічних речовин, які переважно зв'язуються з білками (наприклад, перфторованими речовинами).
Коли концепція CBC не застосовується?
Концепція CBC також має деякі обмеження. Crommentuijn et al. (1994) виявили, що токсичність металів для ґрунтових безхребетних не може бути пояснена, використовуючи критичні концентрації тіла. Те, як різні організми поводяться з накопиченими металами, має великий вплив на величину досягнутих концентрацій в організмі та супутню чутливість металів (Rainbow 2002). Більше того, адаптація або розробка допуску на метал обмежує застосування КБК для металів. Коли внутрішня концентрація металу не показує монотонного зв'язку з концентрацією експозиції, неможливо вивести КБК. Це означає, що всякий раз, коли організми здатні захопити частину металу у формах, які не є біологічно реактивними, прямий зв'язок між концентрацією металів тіла та токсичністю може бути відсутнім або менш очевидним (Luoma and Rainbow 2005, Vijver et al. 2004). Отже, для металів існує широкий діапазон концентрацій тіла з різним біологічним значенням. Тому залишається відкритим питання, чи застосовний цей підхід до способів токсичної дії, крім наркозу. Ще одним важливим моментом є питання, в якій мірі CBC підхід може бути застосований для оцінки впливу хімічних сумішей, особливо в тих випадках, коли хімічні речовини мають різний спосіб дії.
Посилання
Кромментюйн, Т., Дудеман, C.J.A.M., Дорнекамп, А., Ван дер Пол, J.J.C., Бедо, J.J.M., Ван Гестель, C.A.M. (1994). Смертельні концентрації тіла та структури накопичення визначають залежну від часу токсичність кадмію у ґрунтових членистоногих. Екологічна токсикологія та хімія 13, 1781-1789.
Луома, С.Н., Веселка, П.С. Чому біоакумуляція металів така мінлива? Біодинаміка як об'єднуюче поняття. Екологічна наука і технологія 39, 1921-1931
Маккарті, Л.С. (1991). Токсикантні залишки тіла: наслідки для водних біоаналізів з деякими органічними хімічними речовинами. В: Mayes, M.A., Barron, M.G. (ред.), Водна токсикологія та оцінка ризику: Чотирнадцятий том. АСТМА СТП 1124. Філадельфія: Американське товариство випробувань та матеріалів. С. 183-192. Я: 10,1520/ЗУПИНКА 23572С
Маккарті, Л.С., Маккей, Д. Покращення екотоксикологічного моделювання та оцінки. Екологічна наука і технологія 27, 1719-1727
Павліш А.В., Петерс Р.Х. Тест рівноважності внутрішнього тягаря дев'яти наркотичних хімічних речовин з використанням Daphnia magna. Екологічна наука і технологія 27, 2801-2806
Веселка П.С. (2002). Концентрації мікроелементів у водних безхребетних: чому і що? Забруднення навколишнього середовища 120, 497-507.
АМЕРИКАНСЬКИЙ ЕПП. (2003). В: Методологія визначення критеріїв якості навколишнього середовища для охорони здоров'я людини: документ технічного забезпечення. Том 2. Агентство з охорони навколишнього середовища США, Вашингтон, округ Колумбія: розробка національних факторів біоакумуляції.
Вайвер М.Г., Ван Гестель, C.A.M., Ланно, Р.П., Ван Страален, Н.М., Пейненбург, W.J.G.M. (2004) Внутрішня секвестрація металів та його екотоксикологічна актуальність: огляд. Екологічна наука і технологія 18, 4705-4712.
Поясніть, чому підхід CBC інтегрує хімічну та біологічну доступність.
Як динаміка часу бере участь у підході CBC?
За яких умов підхід CBC не може бути застосований?