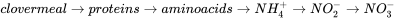4.3: Тестування на токсичність
- Page ID
- 18319
4.3. Тестування на токсичність
Автор: Кіс ван Гестель
Рецензент: Міхіл Краак
Цілі навчання:
Ви повинні вміти
- Згадайте два загальні типи кінцевих точок у тестах на токсичність
- Згадайте основні групи досліджуваних організмів, що використовуються в екологічній токсикології
- Згадайте різні критерії, що визначають дійсність тестів на токсичність
- Поясніть, чому тестування на токсичність може потребувати негативного та позитивного контролю
Ключові слова: одновидові тести на токсичність, селекція тестових видів, взаємозв'язки концентрація-реакція, кінцеві точки, тестування біоакумуляції, епідеміологія, стандартизація, контроль якості, транскриптоміка, метаболоміка,
Вступ
Лабораторні тести на токсичність можуть дати розуміння потенціалу хімічних речовин для біоакумулювання в організмах та їх небезпеки, причому останні зазвичай виражаються як значення токсичності, отримані з взаємозв'язків концентрація-реакція. Розділ 4.3.1 про тестування біоакумуляції описує, як проводити тести для оцінки потенціалу біоакумуляції хімічних речовин у водних і наземних організмах, а також в умовах статичного та динамічного впливу. Основним для тестування токсичності є встановлення зв'язку концентрація-реакція, яка пов'язує кінцеву точку, виміряну в тестових організмах, до концентрацій експозиції. Розділ 4.3.2 про взаємозв'язки концентрація-реакція розроблено на розрахунку відповідних параметрів токсичності, таких як медіана летальної концентрації (LC 50) та середньо-ефективної концентрації (EC 50) з таких тестів на токсичність. У ньому також обговорюються плюси і мінуси різних методів аналізу даних тестів на токсичність.
При розробці тестів на токсичність, які повинні бути вирішені кілька питань, які повинні дозволити оцінити екологічну або людську небезпеку хімічних речовин. Це стосується, серед іншого, вибору досліджуваних організмів (див. Розділ 4.3.4 про Вибір досліджуваних організмів для тестування на екотоксичність), експозиційних середовищ, умов випробувань, тривалості випробувань та кінцевих точок, але також вимагає чітких критеріїв перевірки якості проведених тестів на токсичність (див. Нижче). Різні кінцеві точки всього організму, які зазвичай використовуються в стандартних тестах на токсичність, такі як виживання, зростання, відтворення або уникнення поведінки, обговорюються в розділі 4.3.3 про Кінцеві точки. Розділи 4.3.4 - 4.3.7 зосереджені на відборі та проведенні тестів з організмами, представниками водних і наземних екосистем. Сюди входять мікроорганізми (розділ 4.3.6), рослини (розділ 4.3.5), безхребетні (розділ 4.3.4) та досліджувальні організми хребетних (наприклад, риби: розділ 4.3.4 про тести на екотоксичність та птиці: розділ 4.3.7). Тестування хребетних, в тому числі риб (розділ 4.3.4) і птахів (розділ 4.3.7), підпорядковується суворим регламентам, спрямованим на зменшення використання досліджуваних тварин. Тому дані про потенційну небезпеку хімічних речовин для здоров'я людини бажано отримувати іншими способами, наприклад, за допомогою методів випробувань in vitro (розділ 4.3.8), за допомогою даних післяреєстраційного моніторингу людей, що піддаються впливу (розділ 4.3.9 про тестування токсичності людини ), або з епідеміологічного аналізу на людей, що піддаються впливу (розділ 4.3.10).
Включення нових кінцевих точок у тестування токсичності
Традиційно тести на токсичність зосереджені на кінцевих точках всього організму, причому виживання, ріст і розмноження є найбільш виміряними параметрами (розділ 4.3.3). У разі тестування на токсичність хребетних також можуть бути використані інші кінцеві точки, спрямовані на вплив на рівні органів або тканин (розділ 4.3.9 про тестування токсичності людини). Поведінкова (наприклад, поведінка уникнення) та біохімічні кінцеві точки, такі як активність ферментів, також регулярно включаються в тестування на токсичність з хребетними та безхребетними (розділи 4.3.3, 4.3.4, 4.3.7, 4.3.9).
Зі зростанням молекулярної біології стали доступні нові методи, які можуть надати додаткову інформацію про вплив хімічних речовин. Молекулярні інструменти можуть, наприклад, застосовуватися в молекулярній епідеміології (розділ 4.3.11), щоб знайти причинно-наслідкові зв'язки між впливом на здоров'я та впливом хімічних речовин. Тестування токсичності може також використовувати реакції на експресію генів (транскриптоміка; розділ 4.3.12) або зміни метаболізму (метаболоміка; розділ 4.3.13) стосовно хімічного впливу, щоб допомогти розгадати механізм (и) дії хімічних речовин. Основною проблемою все ще є пояснення впливу на весь організм від таких молекулярних реакцій.
Стандартизація тестів
Стандартизація випробувань організована міжнародними органами, такими як Організація економічного співробітництва та розвитку (ОЕСР), Міжнародна організація стандартизації (ISO) та ASTM International (раніше відома як Американське товариство випробувань та матеріалів). Стандартизація спрямована на зменшення варіацій результатів випробувань шляхом ретельного опису методів культивування та поводження з досліджуваними організмами, процедур проведення тесту, властивостей та складу досліджуваних середовищ, умов впливу та аналізу даних. Стандартизовані рекомендації щодо тестування, як правило, засновані на обширному тестуванні методу різними лабораторіями в так званому круговому тесті.
Регулюючі органи, як правило, вимагають, щоб тести на токсичність, що підтримують реєстрацію нових хімічних речовин, виконувалися відповідно до міжнародних стандартизованих рекомендацій щодо випробувань Наприклад, в Європі всі тести на токсичність, подані в рамках REACH, повинні проводитися відповідно до рекомендацій ОЕСР щодо тестування хімічних речовин (див. Розділ «Регулювання хімічних речовин»).
Контроль якості тестів на токсичність
Оскільки тести на токсичність проводяться з живими організмами, це неминуче призводить до (біологічних) змін результатів. Справитися з цією варіацією вимагає використання достатньої реплікації, ретельного проектування випробувань та хорошого вибору кінцевих точок (розділ 4.3.3), щоб забезпечити належні оцінки відповідних даних про токсичність.
З метою контролю якості результатів випробувань на токсичність було розроблено кілька критеріїв, які в основному стосуються продуктивності досліджуваних організмів у непідданих контролах. Ці критерії можуть, наприклад, вимагати мінімального% виживання контрольних організмів, мінімальної швидкості росту або кількості потомства, що виробляється контролями, та обмеженої варіації (наприклад, < 30%) даних реплікації контролю росту або відтворення (розділи 4.3.4, 4.3.5, 4.3.6, 4.3.7). Коли тести не відповідають цим критеріям, результат схильний до сумнівів, оскільки, наприклад, поганий контроль виживання буде важко зробити обґрунтовані висновки про вплив тестової хімічної речовини на цю кінцеву точку. Як наслідок, тести, які не відповідають цим критеріям обґрунтованості, можуть не бути прийняті іншими вченими та контролюючими органами.
У разі, якщо досліджуваний хімікат додається до досліджуваного середовища за допомогою розчинника, тести на токсичність повинні також включати контроль розчинника, крім регулярного контролю, що не піддається впливу (див. Розділ 4.3.4 про вибір досліджуваних організмів для тестування на екотоксичність). У випадку, якщо реакція в контролі розчинника значно відрізняється від реакції при негативному контролі, контроль розчинника буде використовуватися як контроль для аналізу впливу досліджуваної хімічної речовини. Негативний контроль буде використовуватися лише для перевірки того, чи були дотримані критерії валідності, і для контролю стану досліджуваних організмів. У випадку, якщо відповіді в негативному контролі та контролі розчинника суттєво не відрізняються, обидва елементи керування можуть бути об'єднані для аналізу даних.
Більшість рекомендацій щодо тестування також вимагають частого тестування позитивного контролю, хімічної речовини з відомою токсичністю, щоб перевірити, чи не призводить тривале культивування досліджуваних організмів до змін їх чутливості.
Які основні кінцеві точки в тестуванні токсичності?
Які основні групи організмів використовуються при тестуванні на токсичність?
Чому потрібна стандартизація методів тестування токсичності?
Які елементи входять в контроль якості тестів на токсичність?
4.3.1. Тестування на біоакумуляцію
Автор: Кіс ван Гестель
Рецензенти: Joop Hermens, Міхіл Краак, Сусана Лурейро
Цілі навчання:
Ви повинні вміти
- описати методи визначення біоакумуляції хімічних речовин у наземних і водних організмах
- описати тестову конструкцію, придатну для оцінки кінетики біоакумуляції хімічних речовин в організмах
- згадати плюси і мінуси статичних і динамічних тестів на біоакумуляцію
Ключові слова: біоконцентрація, біоакумуляція, кінетика поглинання та елімінації, методи випробувань, ґрунт, вода
Біоакумуляція визначається як поглинання хімічних речовин організмами з навколишнього середовища. Ступінь біоакумуляції зазвичай вказується фактором біоконцентрації (BCF) у випадку, якщо експозиція здійснюється через воду, або коефіцієнтом накопичення біоти до ґрунту/осаду (BSAF) для впливу в ґрунті або осаду (див. Розділ Біоакумуляція).
Через потенційний ризик перенесення харчового ланцюга, експериментальне визначення потенціалу біоакумуляції хімічних речовин зазвичай потрібно у разі високої ліпофільності (log K ow> 3), якщо хімічна речовина не має дуже низьку стійкість. Для дуже стійких хімічних речовин експериментальне визначення потенціалу біоакумуляції вже може бути запущено при довгому K ow > 2. Експериментальне визначення значень BCF і BSAF використовує статичні або динамічні системи експозиції.
При статичних випробуваннях середовище дозується один раз з випробуваним хімічним речовиною, а організми піддаються впливу протягом певного періоду часу, після чого і організми, і досліджуване середовище аналізуються на досліджуваний хімікат. BCF або BSAF розраховуються з виміряних концентрацій. Є кілька проблем з цим способом тестування біоакумуляції.
По-перше, концентрації експозиції можуть зменшуватися під час випробування, наприклад, внаслідок (біо) деградації, випаровування, сорбції стінок тестового контейнера або поглинання досліджуваної сполуки досліджуваними організмами. Як наслідок, концентрація в досліджуваному середовищі, виміряна на початку тесту, може не свідчити про фактичну експозицію під час випробування. Щоб врахувати це, концентрації експозиції можна виміряти на початку та кінці тесту, а також у деяких проміжних точках часу. Концентрації тіла в досліджуваних організмах можуть бути пов'язані з середньозваженими за часом концентраціями експозиції (TWA). Крім того, для подолання проблеми зменшення концентрацій у водних випробувальних системах можуть бути застосовані системи безперервного потоку або пасивні методи дозування. Такі методи, однак, не застосовні до випробувань ґрунту або осаду, де повторний перенесення організмів у свіжошипуче середовище є єдиним способом гарантувати більш-менш постійну концентрацію експозиції в разі швидко деградуючих сполук. Щоб уникнути того, що поглинання досліджуваної хімічної речовини в досліджуваних організмах призводить до зниження концентрацій експозиції, кількість біомаси на об'єм або масу досліджуваного середовища повинна бути досить низькою.
По-друге, невідомо, чи в кінці періоду експозиції досягнуто стійкий стан або рівновага. Якщо це не так, отримані значення BSAF або BCF можуть занижувати потенціал біоакумуляції хімічної речовини. Для вирішення цієї проблеми можна запустити динамічний тест для оцінки констант швидкості поглинання та усунення для отримання значень BSAF або BCF за допомогою констант швидкості поглинання та усунення (див. Нижче).
Такі невизначеності також стосуються значень BCF та BSAF, отриманих шляхом аналізу організмів, зібраних з поля, та порівняння концентрацій тіла з рівнями впливу в навколишньому середовищі. Використання даних від польових організмів, з одного боку, має велику невизначеність, оскільки залишається незрозумілим, чи була досягнута рівновага, з іншого боку, вони відображають експозицію з плином часу в коливальних, але реалістичних умовах експозиції.
Динамічні тести, також зазначені як поглинання/усунення або токсикокінетичні тести, можуть подолати деякі, але не всі, недоліки статичних тестів. При динамічних випробуваннях організми протягом певного періоду часу піддаються впливу в шипоподібному середовищі для оцінки поглинання хімічної речовини, після чого переносяться в чисте середовище для визначення елімінації хімічної речовини. Під час фази поглинання та елімінації, у різні моменти часу, організми відбираються та аналізуються для досліджуваного хімічного речовини. Середовище також часто відбирається для перевірки можливого зниження концентрації експозиції під час фази поглинання. Також в динамічних тестах підтримка концентрації експозиції постійною, наскільки це можливо, є основною проблемою, що вимагає частого оновлення (див. Вище).
Токсикокінетичні тести також повинні включати контроль, що складається з досліджуваних організмів, інкубуються в чистому середовищі і переносяться в чисте середовище, одночасно переносяться організми з оброблюваного середовища. Такий контроль може допомогти виявити можливі порушення в тесті, такі як погане самопочуття досліджуваних організмів або несподіване (перехресне) забруднення, що виникають під час тесту.
Концентрації хімічної речовини, виміряні в тестових організмах, побудовані на основі часу експозиції, і модель першого порядку з одним відсіком пристосована до даних для оцінки констант швидкості поглинання та елімінації. Потім (динамічне) значення BSAF або BCF визначається як співвідношення констант швидкості поглинання та елімінації (див. Розділ про біоконцентрацію та кінетичні моделі).
У тесті на токсикокінетику зазвичай відбираються реплікаційні зразки в кожен момент часу, як під час поглинання, так і фази елімінації. Частота відбору проб може бути вище на початку, ніж в кінці обох фаз: типова схема вибірки показана на малюнку 1. Оскільки аналіз даних токсикокінетики за допомогою моделі з одним відсіком заснований на регресії, зазвичай бажано мати більше точок у часі, а не мати багато реплікацій за час відбору проб. З цієї точки зору часто використовується не більше 3-4 реплікацій за час відбору проб, і 5-6 разів відбору проб для фаз поглинання та елімінації кожна.
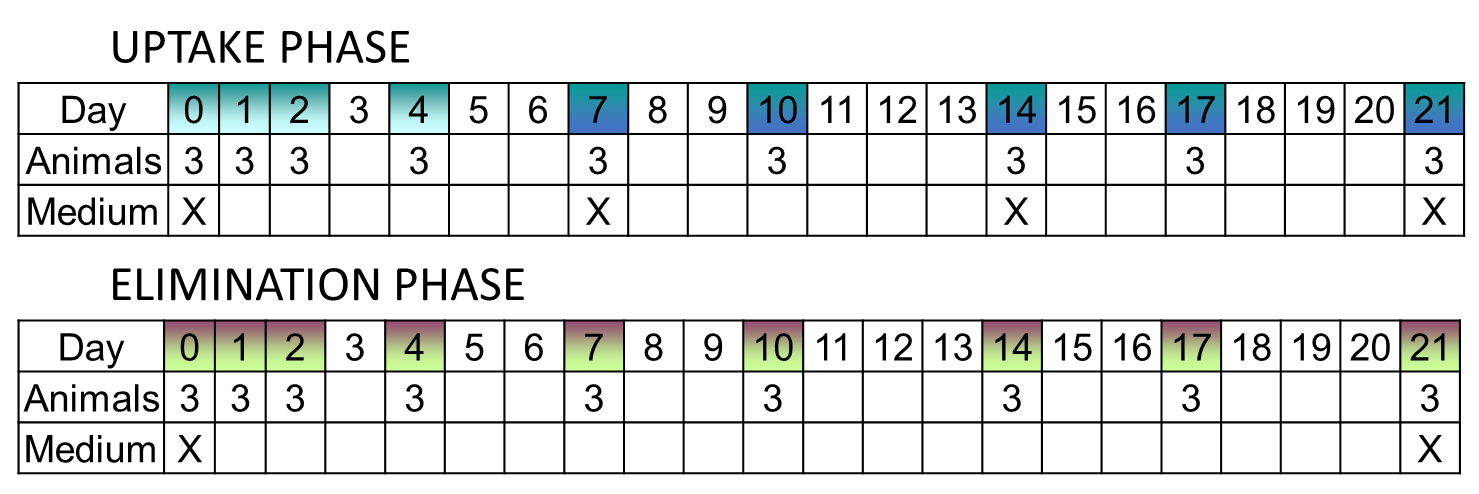
Переважно, що реплікації є незалежними, тому деструктивно вибіркові зразки в певній точці вибірки. Особливо у водній екотоксикології іноді використовуються масові експозиції, маючи всі досліджувані організми в одному або декількох реплікованих тестових контейнерах. У цьому випадку в кожен час відбору проб деякі репліковані організми беруться з тестового контейнера (ів), а в кінці фази поглинання всі організми переносяться в (а) контейнер (и) з чистим середовищем.
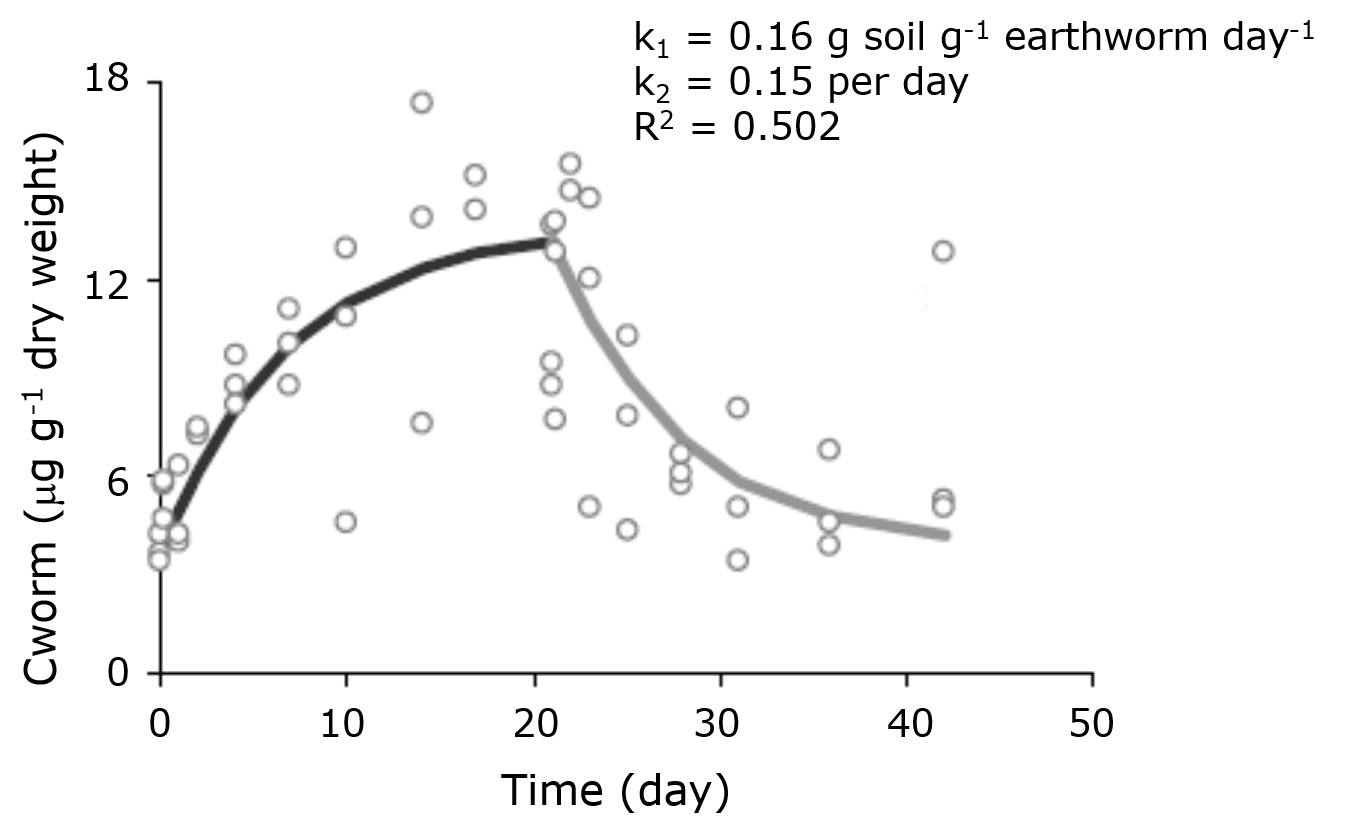
На малюнку 2 показаний результат тесту на кінетику поглинання і ліквідації молібдену у дощового черв'яка Eisenia andrei. З співвідношення константи швидкості поглинання (k 1) та константи швидкості елімінації (k 2) можна було б обчислити BSAF приблизно 1,0, що свідчить про низький потенціал біоакумуляції Mo у дощових черв'яків у досліджуваному грунті.
Інший спосіб оцінки потенціалу біоакумуляції хімічних речовин в організмах включає використання радіомаркованих хімічних речовин, що може полегшити легке виявлення досліджуваної хімічної речовини. Однак використання радіомаркованих хімічних речовин може завищувати потенціал біоакумуляції, коли немає різниці між материнською сполукою та потенційними метаболітами. У випадку металів стабільні ізотопи також можуть дати можливість оцінити потенціал біоакумуляції. Такий підхід застосовувався і для виділення ролі розчиненого (іонного) Zn в біоакумуляції Zn у дощових черв'яків від наночастинок ZnO. Дощові черв'яки піддавалися впливу ґрунтів, шипованих сумішами наночастинок 64 ZnCl 2 та 68 ZnO. Результати показали, що розчинення наночастинок було швидким і що дощові черв'яки в основному накопичили Zn, присутній в іонній формі в ґрунтовому розчині (Laycock et al., 2017).
Стандартні рекомендації щодо випробувань для оцінки біоакумуляції (кінетики) хімічних речовин були опубліковані Організацією економічного співробітництва та розвитку (ОЕСР) для олігохет, що мешкають в осадах (OECD, 2008), для земляних черв'яків/енхітраїдів у ґрунті (OECD, 2010) та для риб (OECD, 2012).
Посилання
Діц-Ортіс, М., Гіска, І., Грут, М., Боргман, Е.М., Ван Гестель, C.A.M. Вплив властивостей ґрунту на кінетику поглинання та елімінації молібдену у дощового черв'яка Ейзенія андрія Хемосфера 80, 1036-1043.
Лейкок, А., Ромеро-Фрейре, А., Найорка, Дж., Свендсен, К., Ван Гестель, C.A.M., Рекемпер, М. Новий багатоізотопний простежувальний підхід до випробування наночастинок ZnO та біодоступності розчинних Zn при спільних впливах ґрунту. Екологічна наука і технологія 51, 12756−12763.
ОЕСР (2008). Методичні вказівки щодо випробувань хімічних речовин № 315: Біоакумуляція в донних олігохетах, що мешкають на осаді. Організація економічного співробітництва та розвитку, Париж.
ОЕСР (2010). Методичні вказівки щодо тестування хімічних речовин № 317: Біоакумуляція у наземних олігохет. Організація економічного співробітництва та розвитку, Париж.
ОЕСР (2012). Методичні вказівки щодо тестування хімічних речовин № 305: Біоакумуляція в рибі: водний та дієтичний вплив. Організація економічного співробітництва та розвитку, Париж.
Чому значення BSAF і BCF, отримані в результаті статичних випробувань, не відображають реальний потенціал біоакумуляції хімічних речовин, навіть якщо можна було підтримувати концентрації експозиції постійними?
Охарактеризуйте експериментальну конструкцію тесту для оцінки кінетики поглинання та ліквідації хімічних речовин у досліджуваних організмах, у ґрунті або воді.
а. з якою експериментальною проблемою можна зіткнутися при визначенні біоакумуляції хімічних речовин у наземних або водних організмах?
б. і як ці проблеми можуть бути подолані у випадку водних організмів?
c Чи можливо таке рішення і для наземних організмів?
4.3.2. Відносини концентрації-відповідь
Автор: Кіс ван Гестель
Рецензенти: Міхіл Краак, Томас Бакхаус
Цілі навчання:
Ви повинні вміти
- зрозуміти поняття взаємозв'язку концентрація-реакція
- визначити заходи токсичності
- розрізняють квантові і безперервні дані
- згадати причини віддати перевагу значенням ECx вище значень NOEC
Ключові слова: концентраційні ефекти, міра летального ефекту, міра сублетального ефекту, регресійний аналіз
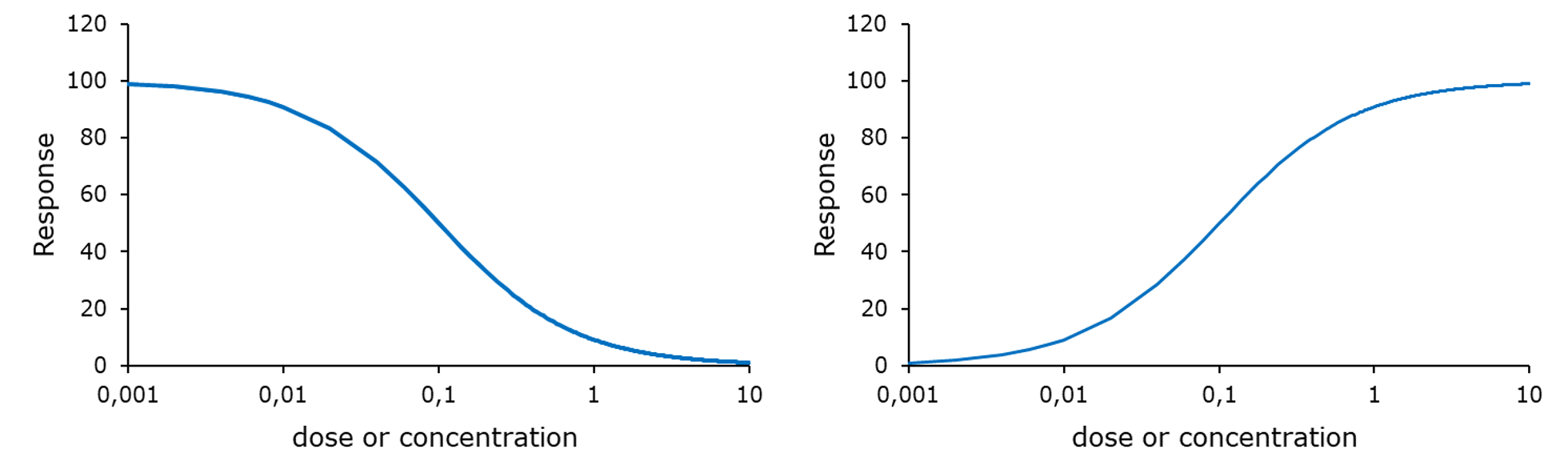
Ключова парадигма в токсикології людини та навколишнього середовища полягає в тому, що доза визначає ефект. Ця парадигма сходить до Парацельса, заявляючи, що будь-яка хімічна речовина токсична, але що доза визначає тяжкість ефекту. На практиці ця парадигма використовується для кількісної оцінки токсичності хімічних речовин. З цією метою проводяться тести на токсичність, в яких організми (мікроби, рослини, безхребетні, хребетні) або клітини піддаються впливу діапазону концентрацій хімічної речовини. Такі тести також включають інкубації в неочищеному контрольному середовищі. Реакція досліджуваних організмів визначається шляхом моніторингу вибраних кінцевих точок, таких як виживання, зростання, розмноження або інші параметри (див. Розділ Кінцеві точки). Кінцеві точки можуть збільшуватися (наприклад, смертність) або зменшуватися зі збільшенням концентрації впливу (наприклад, виживання, відтворення, зростання). Відповідь кінцевих точок будується на основі концентрації експозиції, і встановлені так звані криві концентрації-реакції (рис. 1), з яких можуть бути розраховані заходи токсичності хімічної речовини.
Одиниця впливу, концентрація або доза, можуть виражатися по-різному в залежності від підданого суб'єкта. Доза виражається як мг/кг маси тіла в токсикології людини і після одноразових (пероральних або шкірних) подій впливу на ссавців або птахів. Для інших оральних або шкірних (безхребетних) організмів, таких як медоносні бджоли, доза може бути виражена на тварину, наприклад, мкг/бджола. Вплив навколишнього середовища, як правило, виражає вплив як концентрація в мг/кг їжі, мг/кг ґрунту, мг/л поверхні, питній або грунтовій воді або мг/м 3 повітря.
Зрештою, саме концентрація (кількість молекул хімічної речовини) в цільовому місці визначає ефект. Отже, експресування концентрацій експозиції на молярній основі (моль/л, моль/кг) є кращим, але рідше застосовується.
При низьких концентраціях або дозах на вимірювану кінцеву точку не впливає вплив впливу. При збільшенні концентрації кінцева точка показує зниження або збільшення концентрації, пов'язане з концентрацією. З цього зниження або підвищення можуть бути розраховані різні заходи токсичності:
ECX/EDX: «ефективна концентрація» відповідь. «ефективна доза»; «х» позначає процентний ефект щодо необробленого контролю. За цим завжди слід вказувати вибрану кінцеву точку.
LCX/LDx: однаковий, але вказаний для конкретної кінцевої точки: летальність.
EC50/ED50: концентрація або доза медіани ефекту, при цьому «x» встановлено 50%. Це найпоширеніша оцінка, яка використовується в екологічній токсикології. За цим завжди слід вказувати вибрану кінцеву точку.
LC50/LD50: однаковий, але вказаний для конкретної кінцевої точки: летальність.
Терміни LCx і LDx позначають частку тварин, що реагують (вмирають), тоді як ECx і edX вказують на ступінь зниження вимірюваного параметра. ECX/EDX описують загальну середню продуктивність досліджуваних організмів з точки зору виміряного параметра (наприклад, зростання, розмноження). Значення LCX/LDx здається очевидним: це стосується летальності досліджуваного хімічного речовини. Однак використання ECX/EDX завжди вимагає чіткого згадки про кінцеву точку, яку він стосується.
Моделі концентрації-відгуку зазвичай розрізняють квантові і неперервні дані. Квантові дані відносяться до обмежених відповідей («так/ні») і включають, наприклад, дані про виживання, але також можуть бути застосовані до відповідей на уникнення. Постійні дані стосуються таких параметрів, як ріст, розмноження (кількість молодих або вироблених яєць) або біохімічні та фізіологічні вимірювання. Найважливішою відмінністю між квантовими та безперервними відповідями є те, що квантові відповіді - це відповіді на рівні населення, тоді як безперервні відповіді також можна спостерігати на рівні індивідів. Організм не може бути напівмертвим, але він, безумовно, може рости лише з половиною контрольної швидкості.
Моделі концентрації-відгуку зазвичай сигмоїдальні на колодній шкалі і характеризуються чотирма параметрами: мінімальним, максимальним, нахилом і положенням. Мінімальний відгук часто встановлюється на контрольний рівень або на нуль. Максимальна реакція часто встановлюється на 100%, стосовно контролю або біологічно правдоподібного максимуму (наприклад, 100% виживання). Ухил визначає крутизну кривої, і визначає відстань між EC50 і EC10. Параметр position вказує, де на осі x розміщена крива. Позиція може дорівнювати EC50, і в цьому випадку вона називається поворотною точкою. Але це насправді тримається лише для невеликої частки моделей, а не для моделей, які не симетричні EC50.
У екологічній токсикології значення параметрів зазвичай представлені з 95% довірчих інтервалів, що вказують межі невизначеності. Статистичні програмні пакети використовуються для обчислення цих відповідних 95% довірчих інтервалів.
Проекти випробувань на основі регресії вимагають декількох тестових концентрацій, і результати залежать від використовуваної статистичної моделі, особливо в області з низьким ефектом. Іноді просто неможливо використовувати дизайн на основі регресії, оскільки кінцева точка не охоплює достатньо високий діапазон ефектів (для точного підгонки зазвичай потрібен ефект > 50%).
У разі квантових реакцій, особливо виживання, нахил кривої концентрація-реакція є показником розподілу чутливості особин всередині популяції досліджуваних організмів. Для дуже однорідної популяції лабораторних випробувань тварин, що мають однаковий вік і розмір тіла, очікується більш крута крива концентрації-реакції, ніж при використанні польових тварин, що представляють більш широкий діапазон вікових груп і розмірів тіла (рис. 2).
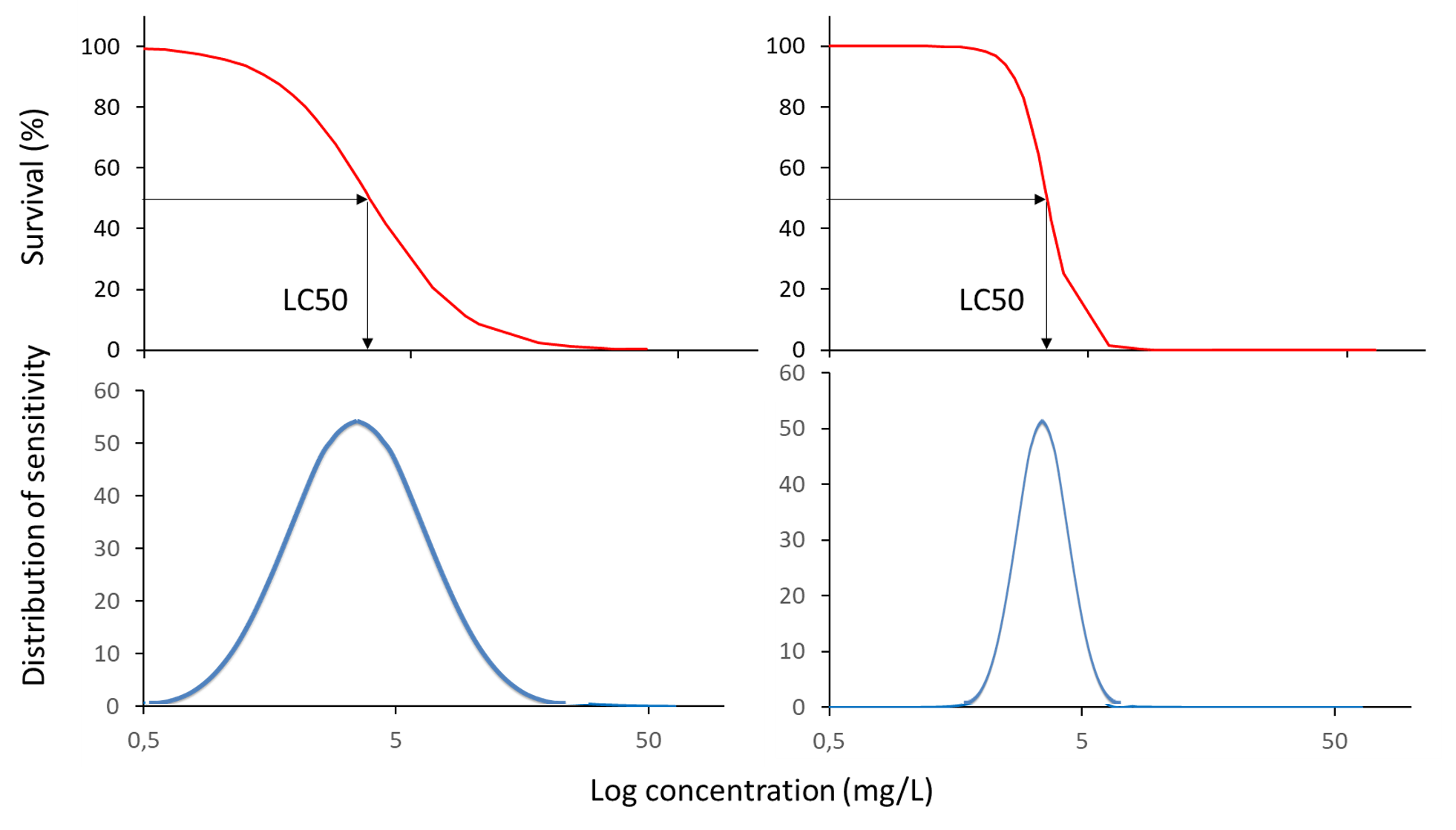
На додаток до значень ECx, тести на токсичність також можуть бути використані для отримання інших заходів токсичності:
NOEC/NOEL: Концентрація ефекту або рівень ефекту, що не спостерігається
LOEC/LOEL: Найнижча концентрація ефекту або рівень ефекту
NOAEL: Рівень несприятливого ефекту не спостерігається. Те саме, що і NOEL, але зосереджуючись на негативних (несприятливих) ефектах порівняно з контролем.
LOAEL: Найнижчий спостережуваний рівень несприятливих ефектів. Те саме, що LOEL, але зосереджуючись на негативних (несприятливих) ефектах порівняно з контролем.
Там, де ECx виводяться шляхом підгонки кривої, NOEC та LOEC виводяться статистичним тестом, порівнюючи реакцію при кожній тестовій концентрації з реакцією елементів управління. NOEC визначається як найвища тестова концентрація, де реакція не суттєво відрізняється від контролю. LOEC є наступною більш високою концентрацією, тому найнижча випробувана концентрація, при якій реакція значно відрізняється від контрольної. На малюнку 3 показані значення NOEC та LOEC, отримані в результаті гіпотетичного тесту. Зазвичай аналіз дисперсії (ANOVA) використовується в поєднанні з пост-hoc тестом, наприклад, Tukey, Bonferroni або Dunnett, для визначення NOEC і LOEC.
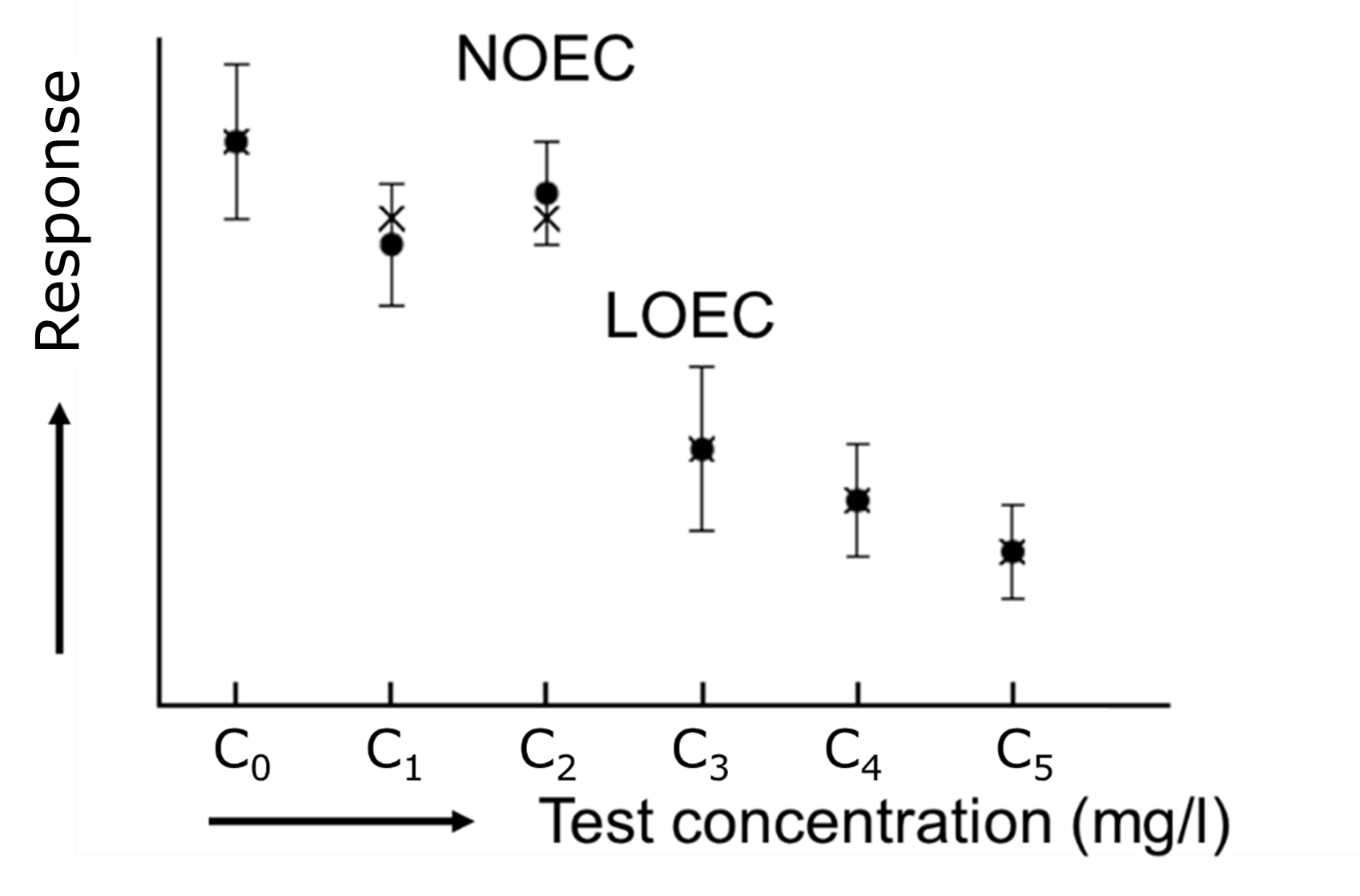
Більшість доступних даних про токсичність - це NOECs, отже, вони є найбільш поширеними значеннями, знайденими в базах даних і тому використовуються для регуляторних цілей. З наукової точки зору, однак, є досить деякі недоліки, пов'язані з використанням NOECs:
- Отримано статистичним тестом (тестування гіпотез) (порівняно з регресійним аналізом);
- дорівнює одній з тестових концентрацій, тому не використовуючи всі дані тесту на токсичність;
- Чутливий до кількості реплікацій, використовуваних на концентрацію та контроль експозиції;
- Чутливий до варіацій у відповідь, тому для відмінностей між реплікаціями;
- Залежить від обраного статистичного тесту, і від дисперсії (σ);
- Не має довірчих інтервалів;
- Утруднює порівняння даних про токсичність між лабораторіями та між видами.
NOEC може, через свою чутливість до варіацій та тестового дизайну, іноді дорівнювати або навіть вище EC50.
Через недоліки NOEC рекомендується використовувати заходи токсичності, отримані шляхом підгонки кривої концентрація-реакція до даних, отриманих в результаті тесту на токсичність. Як альтернатива NOEC зазвичай використовується EC10 або EC20, який має ті переваги, що він отримується з використанням всіх даних тесту і що він має 95% довірчий інтервал, що вказує на його надійність. Наявність 95% довірчого інтервалу також дозволяє статистичне порівняння значень ECx, що неможливо для значень NOEC.
Які чотири параметри описують криву доза-відповідь?
Якою буде краща одиниця вимірів токсичності (наприклад, EC20 або EC50), що описує вплив хімічної речовини на виживання ґрунтових безхребетних, що піддаються стандартизованому випробувальному ґрунту?
Чому ви очікуєте, що використання синхронізованої за віком лабораторної популяції досліджуваних організмів призводить до набагато крутішої кривої концентрації-реакції на вплив на виживання хімічної речовини, ніж зібрана на полі популяція несинхронізованих індивідів?
Чому значення EC10 віддають перевагу перед NOECs при використанні результатів тестів на токсичність для оцінки ризику хімічних речовин?
4.3.3. Кінцеві точки
Автор: Міхіл Краак
Рецензенти: Кіс ван Гестель, Карлос Барата
Цілі навчання:
Ви повинні вміти
- перерахуйте наявні цілі кінцеві точки організму в тестах на токсичність.
- мотивувати важливість сублетальних кінцевих точок в тестах на гостру та хронічну токсичність.
- опишіть, як вимірюються сублетальні кінцеві точки в тестах на гостру та хронічну токсичність.
Ключові слова: смертність, виживання, сублетальні кінцеві точки, зростання, відтворення, поведінка, фотосинтез
Вступ
Більшість тестів токсичності, проведених короткострокові високі дози експериментів, гострі тести, в яких смертність часто є єдиною кінцевою точкою. Смертність, однак, є сирим параметром у відповідь на відносно високі і тому часто екологічно невідповідні концентрації токсикантів. При значно нижчих і, отже, екологічно більш релевантних концентраціях токсикантів організми можуть страждати від найрізноманітніших сублетальних ефектів. Отже, тести на токсичність набувають екологічного реалізму, якщо на додаток до смертності розглядаються сублетальні кінцеві точки.
Смертність
Смертність може визначатися як в тестах на гостру, так і при хронічній токсичності. У гострих тестах смертність часто є єдиною можливою кінцевою точкою, хоча деякі гострі тести займають досить багато часу, щоб також виміряти сублетальні кінцеві точки, особливо зростання. Як правило, це обмежується тестами на хронічну токсичність, в яких на додаток до смертності можна оцінити широкий спектр сублетальних кінцевих точок (Таблиця 1).
Смертність в кінці періоду впливу оцінюється простим підрахунком кількості вижили особин, але вона також може бути виражена або у відсотках від початкового числа осіб, або у відсотках від відповідного контролю. Зростаюча смертність зі збільшенням концентрацій токсикантів може бути побудована у співвідношенні доза-відповідь, з якого можна отримати LC50 (див. Розділ про співвідношення концентрації-відповідь). Якщо оцінка смертності неруйнівна, наприклад, якщо це можна зробити за допомогою візуального огляду, вона може бути оцінена через різні проміжки часу під час тесту на токсичність. Хоча повторні спостереження можуть потребувати певних зусиль, вони, як правило, генерують цінну інформацію в процесі інтоксикації з часом.
Сублетальні кінцеві точки в тестах на гостру токсичність
У тестах на гостру токсичність важко оцінити інші кінцеві точки, ніж смертність, оскільки вплив токсикантів на сублетальні кінцеві точки, такі як ріст та розмноження, потребують набагато більшого часу впливу, щоб стати вираженим (див. Розділ Хронічна токсичність). Таким чином, включення сублетальних кінцевих точок у тести на гостру токсичність вимагає швидкої реакції на вплив токсикантів. Фотосинтез рослин і поведінка тварин - це елегантні, чутливі та швидко реагуючі кінцеві точки, які можуть бути включені в тести на гостру токсичність (табл. 1).
Поведінкові кінцеві точки
Поведінка є недостатньо вивченою, але чутливою та екологічно важливою кінцевою точкою в тестуванні на екотоксичність, оскільки тонкі зміни в поведінці тварин можуть вплинути на трофічні взаємодії та функціонування екосистеми. Кілька досліджень повідомили про вплив на поведінку тварин при концентраціях порядків величин нижче смертельних концентрацій. Van der Geest et al. (1999) показали, що зміни у вентиляційній поведінці личинок п'ятої зірки Hydropsyche angustipennis відбувалися приблизно в 150 разів нижчі концентрації Cu, ніж смертність личинок першої зірки. Поведінка уникнення амфіпод Corophium volutator до забруднених відкладень була в 1000 разів більш чутливою, ніж виживання (Hellou et al., 2008). Chevalier et al. (2015) перевірили вплив дванадцяти сполук, що охоплюють різні режими дії на плавальну поведінку дафнідів, і зауважили, що більшість сполук індукували раннє та значне збільшення швидкості плавання при концентраціях поблизу або нижче 10% ефективної концентрації (48-h EC 10) тесту гострої іммобілізації. Barata et al. (2008) повідомили, що короткостроковий (24 ч) аналіз на інгібування годівлі D. magna був в середньому в 50 разів більш чутливим, ніж гострі стандартизовані тести при оцінці токсичності суміші 16 хімічних речовин у різних комбінаціях типів води. Ці та багато інших прикладів показують, що організми можуть проявляти змінену поведінку при відносно низьких і, отже, часто екологічно важливих концентраціях токсикантів.
Поведінкові реакції на вплив токсикантів також можуть бути дуже швидкими, що дозволяє організмам уникати подальшого впливу та подальшої біоакумуляції та токсичності. Широкий спектр таких відповідей на уникнення було включено в тестування екотоксичності (Araújo et al., 2016), включаючи уникнення забрудненого ґрунту дощовими черв'яками (Eisenia fetida) (Rastetter & Gerhardt; 2018), пригнічення годування мідій (Corbicula fluminea) (Castro et al., 2018), аверсивна реакція плавання на наночастинки срібла одноклітинними зеленими водоростями Chlamydomonas reinhardtii (Mitzel et al., 2017) та дафнідами на дванадцять сполук, що покривають різні режими токсичної дії (Chevalier et al., 2015).
Фотосинтез
Фотосинтез є чутливою і добре вивченою кінцевою точкою, яка може бути застосована для виявлення небезпечного впливу гербіцидів на первинних продуцентів. У біоаналізах з рослинами або водоростями фотосинтез часто кількісно оцінюється за допомогою флюорометрії імпульсної амплітудної модуляції (PAM), методу швидкого вимірювання, придатного для швидкого скринінгу. Фотосинтез водоростей переважно кількісно оцінюється у світлі адаптованих клітинок як ефективна ефективність фотосистеми II (PSII) (ΦPSII) (Ralph et al., 2007; Sjollema et al., 2014). Ця кінцева точка найбільш чутливо реагує на активність гербіцидів, оскільки найчастіше застосовуються гербіциди прямо або опосередковано впливають на PSII (див. Розділ про токсичність гербіцидів).
Сублетальні кінцеві точки в тестах на хронічну токсичність
Крім смертності, зростання і розмноження є найбільш часто оцінюваними кінцевими точками в тестах на екотоксичність (Таблиця 1). Зростання можна виміряти двома способами, як збільшення довжини і як збільшення ваги. Часто визначається тільки довжина або вага в кінці періоду експозиції. Це, однак, включає як зростання до, так і під час впливу. Тому більш характерно виміряти довжину або вагу на початку, а також в кінці експозиції, а потім відняти індивідуальну або середню початкову довжину або вагу від остаточної індивідуальної довжини або ваги. Зростання в період впливу згодом може виражатися у відсотках від початкової довжини або ваги. В ідеалі початкова довжина або вага вимірюється від тих же особин, які будуть піддаватися впливу. Коли організми приносять в жертву для вимірювання початкової довжини або ваги, що особливо стосується сухої ваги, це неможливо. У цьому випадку підзразок від осіб розбирається на початку тесту.
Розмноження є чутливою та екологічною відповідною кінцевою точкою в тестах на хронічну токсичність. Це інтегрований параметр, що включає багато різних аспектів процесу, який можна оцінити один за іншим. Перший параметр розмноження - день першого розмноження. Це екологічно дуже релевантний параметр, оскільки затримка відтворення, очевидно, має значні наслідки для зростання населення. Наступний параметр розмноження - кількість потомства. При цьому можна підрахувати кількість яєць, насіння, новонароджених або молодих. Для організмів, які виробляють яєчні мотузки або яєчні маси, можна визначити як кількість яєчних мас, так і кількість яєць на масу. Нарешті якість потомства можна кількісно оцінити. Це може бути досягнуто шляхом визначення їх фізіологічного статусу (наприклад, вмісту жиру), їх розміру, виживання і, нарешті, їх шансу або досягнення повноліття.
Таблиця 1. Кінцеві точки всього організму часто використовуються в тестах на токсичність. Quantal відноситься до кінцевої точки так/ні, тоді як градуйований відноситься до безперервної кінцевої точки (див. Розділ про співвідношення концентрації-відповідь).
|
Кінцева точка |
Гострий/хронічний |
Квантовий/градуйований |
|
смертності |
обидва |
квантовий |
|
поведінка |
гострий |
градуйовані |
|
уникнення |
гострий |
квантовий |
|
фотосинтез |
гострий |
градуйовані |
|
зростання (довжина і вага) |
переважно хронічний |
градуйовані |
|
розмноження |
хронічного |
градуйовані |
При хронічному впливі можна оцінити широкий спектр інших, рідше застосовуваних сублетальних кінцевих точок всього організму. Можливості безмежні, причому деякі конкретні кінцеві точки розробляються для впливу лише однієї сполуки або конкретних кінцевих точок, іноді описаних лише для одного організму. Суборганізмальні кінцеві точки описані в окремому розділі (див. Розділ Молекулярні кінцеві точки в тестах на токсичність).
Посилання
Араухо, С.В.М., Морейра-Сантос, М., Рібейро Р. Активне та пасивне просторове уникнення водними організмами від стресорів навколишнього середовища: Додаткова перспектива та критичний огляд. Міжнародне довкілля 92-93, 405-415.
Барата, К., Аланон, П., Гутьєррез-Алонсо, С., Ріва, М.К., Фернандес, К., Таразона, Ю.В. (2008). Біоаналіз годівлі Daphnia magna як економічно ефективний та екологічно відповідний тест на сублетальну токсичність для оцінки екологічного ризику токсичних стоків. Наука загального середовища 405 (1-3), 78-86.
Кастро, Б.Б., Сільва, К., Макаріо, І.П.Е., Олівейра, Б., Консалвес, Ф., Перейра, Дж. Л. Інгібування годівлі у Corbicula fluminea (OF Muller, 1774) як критерій впливу забруднюючих речовин: Перспективи скринінгу екотоксичності та вдосконалення хімічного контролю. Водна токсикологія 196, 25-34.
Шевальє, Дж., Харскоет, Е., Келлер, М., Пандард, П., Кашот, Дж., Грот, М. (2015). Дослідження профілів поведінкових ефектів Дафнії, індукованих широким спектром токсикантів з різними режимами дії. Екологічна токсикологія та хімія 34, 1760-1769.
Хеллу Дж., Чізмен, К., Деснойерс, Е., Джонстон, Д., Жувенель, М.Л., Леонард, Дж., Робертсон, С., Уокер, П. (2008). Нелетальний хімічно заснований підхід до дослідження якості відкладів гавані. Наука про загальне довкілля 389, 178-187.
Мітцель, М.Р., Лін Н., Кий, Дж. К., Туфенкі, Н. Chlamydomonas reinhardtii відображає зворотну реакцію плавання на наночастинки срібла Екологічна наука: Nano 4, 1328-1338.
Ральф, П.Дж., Сміт, Р.А., Macinnis-Ng, C.M.O., Сері, C.R. (2007). Використання екотоксикологічних біоаналізів на основі флуоресценції для моніторингу токсикантів та забруднення у водних системах: Огляд. Токсикологічна та екологічна хімія 89, 589-607.
Растеттер Н., Герхардт А. Постійний моніторинг поведінки уникнення з дощовим черв'яком Eisenia fetida. Журнал ґрунтів та відкладень 18, 957-967.
Шоллема, С.Б., Ван Беусеком, С.А.М., Ван дер Гест, Г.Г., Буй, П., Де Зварт, Д., Ветхаак, А.Д., Адміраал, В. (2014). Лабораторні біоаналізи водоростей з використанням флюорометрії ПАМ: Вплив умов випробувань на визначення токсичності гербіцидів та польових зразків. Екологічна токсикологія та хімія 33, 1017-1022.
Ван дер Гест, Г.Г., Греве, Г.Д., Де Хаас, Е.М., Шепер, Б.Б., Краак, М.Х.С., Штуйфзанд, С.К., Августин, К.Х., Адмірааль, W. (1999). Виживання і поведінкові реакції личинок кардісмухи Hydropsyche angustipennis на мідь і діазинон. Екологічна токсикологія та хімія 18, 1965-1971.
Яке значення має включення сублетальних кінцевих точок у тести на гостру та хронічну токсичність?
Назвіть одну тварину та одну рослину специфічну сублетальну кінцеву точку, яка може бути включена в тест на гостру токсичність.
Назвіть дві найбільш часто оцінювані кінцеві точки в тестах на хронічну токсичність.
4.3.4. Вибір досліджуваних організмів - Еко тварини
Автор: Міхіл Краак
Рецензенти: Kees van Gestel, Йорг Рьомбке
Цілі навчання:
Ви повинні вміти
- назвіть вимоги до відповідних лабораторних мікроорганізмів для тестування екотоксичності.
- перерахуйте найбільш часто використовувані стандартні тестові організми для кожного екологічного відсіку.
- аргументують необхідність більш ніж одного досліджуваного виду і необхідність нестандартних досліджуваних організмів.
Ключові слова: досліджуваний організм, стандартизовані лабораторні екотоксичні випробування, екологічний відсік, середовище проживання, різні трофічні рівні
Вступ
Стандартизовані лабораторні тести на екотоксичність вимагають постійних умов випробувань, стандартизованих кінцевих точок (див. Розділ Кінцеві точки) та хорошої продуктивності в контрольних процедурах. Власне, в надійних, відтворюваних і простих у виконанні тестах на токсичність тестова сполука повинна бути єдиною змінною. Це ставить високі вимоги до вибору досліджуваних організмів.
Для належної оцінки ризику дуже важливо, щоб тестові види були представниками спільноти чи екосистеми, яку потрібно захистити. Критерії відбору організмів, які будуть використовуватися в тестах на токсичність, були узагальнені Van Gestel et al. (1997). До них відносяться: 1. Практичні аргументи, включаючи доцільність, економічність та швидкість проведення тесту, 2. Прийнятність і стандартизація тестів, включаючи генерацію відтворюваних результатів, і 3. Екологічне значення, включаючи чутливість, біологічну валідність тощо Найбільш практичною вимогою є те, що досліджуваний організм повинен бути легким для культивування та підтримки, але не менш важливим є те, що досліджувані види повинні бути чутливими до різних стресових факторів. Однак ці дві основні вимоги часто суперечать. Види, які легко культивувати, часто менш чутливі, просто тому, що вони в основному універсали, тоді як чутливі види часто є фахівцями, що значно ускладнює їх культивування. Для наукової та суспільної підтримки вибору досліджуваних організмів бажано вони повинні бути як екологічно, так і економічно актуальними або служити флагманськими видами, але знову ж таки, це протилежні вимоги. Економічно відповідні види, такі як сільськогосподарські культури та велика рогата худоба, навряд чи відіграють якусь роль у природних екосистемах, тоді як екологічно релевантні види не мають очевидної економічної цінності. Це відображається дослідницькими зусиллями щодо цих видів, оскільки про економічно відповідних видах відомо набагато більше, ніж про екологічно відповідних видах.
Не існує видів, які найбільш чутливі до всіх забруднюючих речовин. Який вид найбільш чутливий, залежить від способу дії і, можливо, також інших властивостей хімічної речовини, шляху впливу, його наявності та властивостей організму (наприклад, наявності конкретних мішеней, фізіології тощо). Тому важливо завжди перевіряти ряд видів, з різними життєвими рисами, функціями та позиціями в харчовій павутині. За даними Van Gestel et al. (1997) такий акумулятор досліджуваних видів повинен бути:
1. Представник екосистеми для захисту, тому включаючи організми, що мають різну життєву історію, що представляють різні функціональні групи, різні таксономічні групи і різні шляхи впливу;
2. Представник відповідей, що стосуються захисту населення та громад; і
3. Рівномірний, тому всі випробування в акумуляторі повинні застосовуватися до одного і того ж тестового середовища та застосовуватися до тих самих умов випробувань, наприклад, однакового діапазону значень рН.
Представлення екологічних відсіків
Кожен екологічний відсік, вода, повітря, грунт і осад, вимагає свого конкретного набору досліджуваних організмів. Найбільш часто застосовуваними дослідницькими організмами є дафніди (Daphnia magna) для води, хірономіди (Chironomus riparius) для опадів та дощові черв'яки (Eisenia fetida) для ґрунту. Для повітря, в області інгаляційної токсикології, людина і гризуни насправді є найбільш вивченим організмом. В екотоксикології випробування повітря здебільшого обмежуються рослинами, що стосуються досліджень токсичних газів. Окрім найбільш часто застосовуваних організмів, існує довгий перелік інших стандартних тестових організмів, для яких доступні протоколи випробувань (Таблиця 1; сайт ОЕСР).
Таблиця 1. Невичерпний перелік стандартних видів тесту на екотоксичність.
|
Екологічний відсік (и) |
Група організму |
Види випробувань |
|
Вода |
Рослина |
Перистолистник спікатум |
|
Вода |
Рослина |
Ряска |
|
Вода |
Водорості |
різновиди вибору |
|
Вода |
Ціанобактерії |
різновиди вибору |
|
Вода |
Риба |
Даніо Реріо |
|
Вода |
Риба |
Латипи Оризіас |
|
Вода |
Земноводні |
Ксенопус |
|
Вода |
Комаха |
Хирономус Ріпаріус |
|
Вода |
Ракоподібні |
Дафнія магна |
|
Вода |
Равлик |
Лімнея застійна |
|
Вода |
Равлик |
Потамопіргус антиподарний |
|
Вода-осад |
Завод |
Перистолистник спікатум |
|
Вода-осад |
Комаха |
Хирономус Ріпаріус |
|
Вода-осад |
Олигохетний черв'як |
Поперековий поперековий |
|
Осад |
Анаеробні бактерії |
Осад стічних вод |
|
Грунт |
Завод |
різновиди вибору |
|
Грунт |
Олигохетний черв'як |
Ейзенія фетида або Е. андрей |
|
Грунт |
Олигохетний черв'як |
Енхітрей альбідус або E. crypticus |
|
Грунт |
Коллемболан |
Фольсомія кандидозна або F. fimetaria |
|
Грунт |
Кліщ |
Гіпоаспіс (Геолалапс) акулейфер |
|
Грунт |
Мікроорганізми |
Природна мікробна спільнота |
|
Гній |
Комаха |
Скатофага стеркорарія |
|
Гній |
Комаха |
Мускус осінній |
|
Повітряно-ґрунтовий |
Завод |
різновиди вибору |
|
Наземні |
Птах |
різновиди вибору |
|
Наземні |
Комаха |
Апіс меліфера |
|
Наземні |
Комаха |
Бомбові землі/Б. нетерплячі |
|
Наземні |
Комаха |
Афідій ропалозифій |
|
Наземні |
Кліщ |
Тифлодромус пірі |
Нестандартні тестові організми
Використання стандартних тестових організмів у стандартних тестах на екотоксичність, що виконуються відповідно до міжнародно прийнятих протоколів, значно зменшує невизначеність при тестуванні на екотоксичність. Тим не менш, є вагомі причини відхилення від цих протоколів. Види в таблиці 1 перераховані відповідно до їх відповідного екологічного відсіку, але ігнорують відмінності між екосистемами та середовищами існування. Ґрунти можуть сильно відрізнятися за складом, залежно, наприклад, від вмісту піску, глини або мулу та властивостей, наприклад, рН та вмісту води, кожен з яких містить різні види. Так само застійна та поточна вода має мало спільних видів. Це означає, що на основі екологічних аргументів можуть бути вагомі підстави для вибору нестандартних тестових організмів. Вплив сполук у потоках можна краще оцінити з річковими комахами, а не із застійною водою, що мешкає дафнідів, тоді як компостний черв'як Eisenia fetida не обов'язково є найбільш підходящим видом для піщаних ґрунтів. Список нестандартних тестових організмів, звичайно, нескінченний, але якщо методи добре задокументовані у відкритій літературі, немає обмежень щодо використання цих альтернативних видів. Однак вони пов'язані з експериментальними проблемами, оскільки нестандартні тестові організми можуть бути важко культивувати та підтримувати в лабораторних умовах, а протоколи для тесту на екотоксичність не доступні. Таким чином, підвищення екологічної актуальності тестів на екотоксичність також збільшує логістичні та експериментальні обмеження (див. Розділ 6 про оцінку ризику).
Збільшення кількості видів випробувань
Переважна більшість тестів на токсичність проводиться з одним видом випробувань, що призводить до великих полів невизначеності щодо небезпечності сполук. Щоб зменшити ці невизначеності та підвищити екологічну актуальність, рекомендується включати більше тестових видів, що належать до різних трофічних рівнів, для води, наприклад, водоростей, дафнідів та риб. Для отримання стандартів якості навколишнього середовища з розподілів чутливості видів (див. Розділ про SSD) потрібні дані про токсичність для мінімум восьми видів, що належать до різних таксономічних груп. Це, очевидно, викликає напругу між науковими вимогами та наявними фінансовими ресурсами.
Посилання
Сайт ОЕСР. https://www.oecd-ilibrary.org/enviro...stems_20745761.
Ван Гестель, C.A.M., Леон, C.D., Ван Страален, Н.М. (1997). Оцінка тестів екотоксичності ґрунтової фауни щодо їх використання в оцінці ризиків. В: Тарраделлас, Дж., Біттон, Г., Россел, Д. (Ред.). Екотоксикологія грунту. CRC Прес, Інк., Бока-Ратон: 291-317.
Назвіть вимоги до відповідних лабораторних мікроорганізмів для тестування екотоксичності.
Перерахуйте найбільш часто використовувані стандартні тестові організми для кожного екологічного відсіку.
Аргументуйте 1] необхідність більш ніж одного досліджуваного виду, і 2] необхідність нестандартних досліджуваних організмів.
4.3.5. Вибір досліджуваних організмів - Еко рослини
Автор: Дж. Арі Вонк
Рецензенти: Міхіл Краак, Gertie Arts, Сергі Сабатер
Цілі навчання:
Ви повинні вміти
- назвіть вимоги до відповідних лабораторних тестів на екотоксичність для первинних виробників
- перелік найбільш часто використовуваних первинних виробників та кінцевих точок у стандартизованих тестах на екотоксичність
- аргументувати необхідність вибору первинних виробників з різних екологічних відсіків як тест-організмів для тестів на екотоксичність
Ключові слова: Тестовий організм, стандартизований лабораторний екотоксичний тест, первинні продуценти, водорості, рослини, екологічний відсік, фотосинтез, ріст
Вступ
Фотоавтотрофні первинні продуценти використовують хлорофіл для перетворення CO 2 і H 2 O в органічну речовину за допомогою фотосинтезу під (сонцем) світлом. Ці первинні виробники є основою харчової павутини і утворюють найважливіший компонент екосистем. Окрім того, що служать джерелом їжі, багатоклітинні фотоавтотрофи також утворюють середовище існування для інших первинних виробників (епіфітів) та багатьох видів фауни. Первинні виробники - це дуже різноманітна група, починаючи від крихітного одноклітинного піко-планктону і закінчуючи гігантськими деревами. Для стандартизованих тестів на екотоксичність первинні продуценти представлені (мікро) водоростями, водними макрофітами і наземними рослинами. Оскільки гербіциди є найбільшою групою пестицидів, що використовуються в усьому світі для підтримки високого врожаю в сільському господарстві, важливо оцінити їх вплив на первинних виробників (Wang & Freemark, 1995). Однак щодо інтенсивності тестування первинні виробники недостатньо вивчені порівняно з тваринами.
Стандартизовані лабораторні екотоксичні тести з первинними виробниками вимагають належного контролю за умовами випробувань, стандартизованими кінцевими точками (Arts et al., 2008; див. Розділ про кінцеві точки) та зростанням елементів контролю (тобто подвоєння кількості клітин, довжини та/або біомаси протягом експериментального періоду). Оскільки на метаболізм первинних продуцентів сильно впливають світлові умови, наявність води і неорганічного вуглецю (CO 2 і/або HCO 3 - і CO 3 2-), температура і концентрації розчинених поживних речовин, всі ці умови повинні бути уважно стежать. Загальні критерії відбору досліджуваних організмів описані в попередньому розділі (див. Розділ «Вибір екотоксичних тест-організмів»). Для первинних виробників вибір в основному базується на наявних рекомендаціях щодо випробувань, видах випробувань та екологічному відсіку, що викликає занепокоєння.
Стандартизоване тестування екотоксичності з первинними виробниками
Існує ряд тестів на екотоксичність з різними первинними виробниками, стандартизованими різними організаціями, включаючи ОЕСР та USEPA (Таблиця 1). Характерним для більшості первинних виробників є те, що вони ростуть не в одному екологічному відсіку (грунт/осад; вода; повітря). Внаслідок цього поглинання токсикантів для цих фотоавтотрофів може бути різноманітним, залежно від хімічної речовини та відсіку, де відбувається вплив (повітря, вода, осадок/ґрунт).
Як для морських, так і для прісноводних екосистем доступні стандартизовані тести на екотоксичність для мікроводоростей (одноклітинні мікроорганізми, іноді утворюють більші колонії), включаючи прокаріотичні ціанобактерії (синьо-зелені водорості) та еукаріотичну хлорофіту (зелені водорості) та бациляріофіцеї (діатомові водорості). Макрофіти (макроводорості і водні рослини) - багатоклітинні організми, останні складаються з диференційованих тканин, при цьому ряд видів включений в стандартизовані тести на екотоксичність. Хоча макроводорості ростуть лише у водному відсіку, водні рослини поділяються на групи, пов'язані з їх формою росту (виникають; вільно плаваючі; занурені та осадові корінені; плаваючі та осадові коріння) і можуть виходити з осаду (коріння та кореневі запаси) через воду в повітря. Як макроводорості, так і водні рослини містять широкий спектр таксонів і присутні як в морських, так і в прісноводних екосистемах.
Наземні вищі рослини дуже різноманітні, починаючи від дрібних трав і закінчуючи великими деревами. Рослини, що входять до стандартизованих тестів на екотоксичність, складаються з сільськогосподарських та некультурних видів. Важлива відмінність наземних рослин відображається в дводольних і монокотах, оскільки обидві групи відрізняються за своїми метаболічними шляхами і можуть відображати різницю в чутливості до забруднюючих речовин.
Таблиця 1. Стандартні рекомендації з відкритим вихідним кодом для тестування впливу сполук на первинних виробників. Всі тести виконуються в (мікро) космах, крім маркованих знаком*
|
Первинний виробник |
Види |
Відсік |
Номер тесту |
Організація |
|
Мікроводорості & Ціано-бактерії |
різні види |
Прісноводні |
201 |
|
Анабаена флос-аке |
Прісноводні |
850.4550 |
||
|
Псевдокірхнерієлла субкапітальна, Скелет берегової |
Прісноводні, Морська вода |
850.4500 |
||
|
Плаваючі макрофіти |
Лимонна сп. |
Прісноводні |
221 |
|
|
Лимонна сп. |
Прісноводні |
850.4400 |
||
|
Занурені макрофіти |
Перистолистник спікатум |
Прісноводні |
238 |
|
Перистолистник спікатум |
Осад (прісноводний) |
239 |
||
|
Водні рослини* |
не вказано |
Прісноводні |
850.4450 |
|
|
Наземні рослини |
широке розмаїття видів |
Повітря |
227 |
|
|
широке розмаїття видів |
Повітря |
850.4150 |
||
|
широке розмаїття видів (сільськогосподарських і беззернових) |
Грунт і повітря |
850.4230 |
||
|
бобові та ризобіум симбіонт |
Грунт і повітря |
850.4600 |
||
|
широке розмаїття видів (сільськогосподарських і беззернових) |
Грунт |
208 |
||
|
широке розмаїття видів (сільськогосподарських і беззернових) |
Грунт |
850.4100 |
||
|
різні види сільськогосподарських культур |
Грунт і повітря |
850.4800 |
||
|
Наземні рослини* |
не вказано |
Наземні |
850.4300 |
Представлення екологічних відсіків
Оскільки первинні виробники можуть приймати багато сполук безпосередньо клітинами та таллі (водоростями) або їх листям, стеблами, корінням та кореневищами (рослинами), різні екологічні відсіки повинні бути включені в тестування на екотоксичність залежно від хімічних характеристик забруднюючих речовин. Більш того, хімічні характеристики розглянутої сполуки визначають, чи може і як сполука потрапити в первинних виробників і як воно транспортується через організми.
Для всіх водних первинних виробників актуальним є вплив через водну фазу. Вплив повітря відбувається в виникаючих і плаваючих водних рослин, тоді як вкорінюються рослини та водорості з ризоїдами можуть піддаватися через осад. Вплив осаду створює додаткові проблеми для стандартизованих умов випробувань, оскільки зміни окислювально-відновних умов та вмісту органічних речовин у відкладах можуть змінити поведінку сполук у цьому відсіку.
Всі наземні рослини піддаються впливу через повітря, грунт і воду (вологість грунту, дощ, полив). Вплив повітря та відкладення води (дощ або обприскування) безпосередньо оголює надземні частини наземних рослин, тоді як підземні частини рослин та насіння піддаються впливу ґрунтової та ґрунтової вологи. Експозиція ґрунту створює додаткові проблеми для стандартизованих умов випробувань, оскільки зміни вмісту органічної речовини у ґрунтах у воді або осадах можуть змінити поведінку сполук у цьому відсіку.
Тестові кінцеві точки
Біоакумуляція після поглинання та транслокації до специфічних клітинних органел або рослинної тканини може призвести до включення сполук до первинних продуцентів. Це спостерігалося для важких металів, пестицидів та інших органічних хімічних речовин. Потім накопичені сполуки у первинних виробників можуть потрапити в харчовий ланцюг і бути переведені на більш високі трофічні рівні (див. Розділ про Біомагніфікація). Хоча концентрації у первинних виробників свідчать про наявність біодоступних сполук, ці концентрації не обов'язково означають несприятливий вплив на ці організми. Тому вимірювання біоакумуляції найкраще поєднувати з однією або декількома наступними оцінками кінцевих точок.
Фотосинтез є найважливішим метаболічним шляхом для первинних виробників. Таким чином, спосіб дії багатьох гербіцидів полягає в інгібуванні фотосинтезу, за допомогою якого можуть бути націлені різні метаболічні етапи (див. Розділ про токсичність гербіцидів). Ця кінцева точка актуальна для оцінки гострого впливу на транспорт електронів хлорофілу за допомогою флюорометрії імпульсної амплітудно-модуляції (PAM) або як міра виробництва кисню або вуглецю первинними виробниками.
Зростання являє собою накопичення біомаси (мікроводоростей) або маси (багатоклітинні первинні продуценти). Пригнічення росту є найважливішою кінцевою точкою в тесті з первинними виробниками, оскільки ця кінцева точка інтегрує відповіді широкого спектру метаболічних ефектів у цілий організм або реакцію населення первинних виробників. Однак оцінка займає більше часу, особливо для великих первинних виробників. Кількість клітин, збільшення розміру з часом для листя, коренів або цілих організмів, і (біо) маса (свіжа вага і суха вага) є кінцевими точками росту, які в основному використовуються.
Поява розсади відображає проростання і ранній розвиток розсади в рослини. Ця кінцева точка особливо актуальна для багаторічних та дворічних рослин залежно від розгону насіння та успішного проростання для підтримки здорових популяцій.
Інші кінцеві точки включають подовження різних частин рослин (наприклад, коренів), некроз листя або порушення взаємозв'язків між рослинами та мікробними симбіонтами.
Сучасні обмеження та проблеми використання первинних виробників у тестах на екотоксичність
Для наземних судинних рослин багато видів сільськогосподарських та несільськогосподарських культур можуть бути використані в стандартизованих тестах, однак для інших екологічних відсіків (водних і морських) мало видів доступні в стандартизованих рекомендаціях щодо випробувань. Також не всі екологічні відсіки в даний час покриті стандартизованими тестами для первинних виробників. Загалом, існують обмежені випробування на водні відкладення і існує повна відсутність випробувань на морські відкладення. Нарешті, не всі основні групи первинних виробників представлені в стандартизованих тестах на токсичність, наприклад, відсутні мохи та деякі основні групи водоростей.
Проблеми покращення тестів на екотоксичність з рослинами полягають у тому, щоб включити більш чутливі та ранні кінцеві точки реагування. Для впливу ґрунту та осаду рослин забруднюючих речовин розвиток кінцевих точок, пов'язаних з морфологією коренів та кореневим метаболізмом, може дати уявлення про ранній вплив речовин на відкриті частини рослин. Також розробка екотоксикогеномних кінцевих точок (наприклад, метаболоміка) (див. Розділ на Метаболоміка) у галузі тестів на токсичність рослин дозволить нам визначити вплив на більш широкий спектр метаболічних шляхів рослин.
Посилання
Мистецтво, Г.Х.П., Бельгерс, J.D.M., Hoekzema, C.H., Тіссен, J.T.N.M. (2008). Чутливість занурених прісноводних макрофітів та кінцевих точок у лабораторних тестах на токсичність. Забруднення навколишнього середовища 153, 199-206.
Ван, W.C., Freemark, К. (1995) Використання рослин для моніторингу та оцінки навколишнього середовища. Екотоксикологія та екологічна безпека 30:289-301.
Які умови потрібно ретельно контролювати в лабораторних тестах на екотоксичність з первинними виробниками?
Перелічіть різні групи первинних виробників, які використовуються в стандартизованих тестах для кожного екологічного відсіку.
Аргументуйте, чому тестування первинних виробників є актуальним стосовно [А] екологічного впливу екосистем пестицидів та [B] ролі первинних виробників в екосистемах
4.3.6. Вибір досліджуваних організмів - Мікроорганізми
Автор: Патрік ван Білен
Відгуки: Кіс ван Гестель, Ерланд Бот, Марія Ніклінська
Цілі навчання:
Ви повинні вміти
- опишіть життєво важливу роль мікроорганізмів в екосистемах.
- пояснити різницю між тестами токсичності для захисту біорізноманіття та захисту екосистемних послуг.
- пояснити, чому короткочасні мікробні тести можуть бути більш чутливими, ніж довгострокові.
Ключові слова: мікроорганізми, процеси, перетворення азоту, методи випробувань
важливість мікроорганізмів
Більшість організмів є мікроорганізмами, а це означає, що вони, як правило, занадто малі, щоб побачити неозброєним оком. Проте мікроорганізми впливають практично на всі аспекти нашого життя. Віруси - найдрібніші з мікроорганізмів, прокаріотичних бактерій і архей більше (в мікрометровому діапазоні), а розміри еукаріотичних мікроорганізмів коливаються від трьох до ста мікрометрів. Мікроскопічні еукаріоти мають більші клітини з ядром і бувають різної форми, як зелені водорості, протисти та гриби.
Ціанобактерії та еукаріотичні водорості здійснюють фотосинтез в океанах, морях, солонуватих і прісноводних екосистемах. Вони фіксують вуглекислий газ в біомасі і складають основу найбільших водних екосистем. Бактерії і гриби розкладають складні органічні молекули на вуглекислий газ і мінерали, які необхідні для росту рослин.
Рослини часто живуть в симбіозі зі спеціалізованими мікроорганізмами на коренях, які полегшують їх ріст, посилюючи поглинання води і поживних речовин, прискорюючи ріст рослин. Безхребетні та хребетні тварини, включаючи людину, мають бактерії та інші мікроорганізми в кишечнику для полегшення перетравлення їжі. Корови, наприклад, не можуть перетравлювати траву без мікроорганізмів у рубці. Крім того, терміти не змогли б перетравлювати лігнін, важко засвоюваний деревний полімер, без допомоги кишкових грибів. Мурахи листорізака транспортують листя в своє гніздо, щоб годувати гриби, від яких вони залежать. Також люди споживають багато продуктів харчування з дріжджами, грибами або бактеріями для збереження їжі і приємного смаку. Пиво, вино, сир, йогурт, квашена капуста, оцет, хліб, темпех, ковбаса та багато інших продуктів харчування потребують правильного типу мікроорганізмів, щоб бути смачними. Наявність правильного типу мікроорганізмів також життєво важливо для здоров'я людини. Молоко матері людини містить олігосахариди, які неперетравлюються для новонародженої дитини. Вони служать основним джерелом їжі для кишкових бактерій у дитини, які знижують ризик небезпечних інфекцій.
Це показує, що взаємодія між конкретними мікроорганізмами і вищими організмами часто є високоспецифічним. Морські віруси дуже рясні і можуть обмежувати цвітіння водоростей, сприяючи більш різноманітному морському фітопланктону. Патогенні віруси, бактерії, гриби та протисти посилюють біорізноманіття рослин і тварин наступним механізмом: Найщільніші популяції більш сприйнятливі до захворювань, оскільки передача захворювання стає частішою. Коли найпоширеніші види стають рідше, з'являється більше місця для інших видів, а біорізноманіття посилюється. У сільському господарстві це посилене біорізноманіття є небажаним, оскільки худоба та урожай є найпоширенішими видами. Саме тому боротьба з хворобами набуває більшого значення у високоінтенсивному тваринництві та у великих монокультурах сільськогосподарських культур. Мікроорганізми лежать в основі всіх екосистем і життєво важливі для здоров'я людини та навколишнього середовища.
Мікробіологічне суспільство має гарне відео, що пояснює, чому мікробіологія має значення.
Цілі захисту
Функціонуванню природних екосистем на землі загрожує багато факторів, таких як втрата середовища проживання, фрагментація середовища існування, глобальне потепління, вимирання видів, надмірне запліднення, підкислення та забруднення. Природні та техногенні хімічні речовини можуть виявляти токсичний вплив на різні організми в природних екосистемах. Токсичні хімічні речовини, що виділяються в навколишнє середовище, можуть мати негативний вплив на біорізноманіття або мікроб В екосистемі, сильно постраждалій від таких змін, велика кількість різних видів могла бути меншою. Втрата біорізноманіття виду в конкретній екосистемі може бути використана як міра деградації екосистеми. Люди отримують користь від наявності належним чином функціонуючих екосистем. Ці переваги можна кількісно оцінити як екосистемні послуги. Мікробні процеси значним чином сприяють багатьом екосистемним послугам Підземні води, наприклад, часто є підходящим джерелом питної води, оскільки мікроорганізми видалили забруднюючі речовини та патогенні мікроорганізми з проникаючої води. Див. розділ про екосистемні послуги та цілі захисту.
Випробування на токсичність навколишнього середовища
Більшість тестів на токсичність навколишнього середовища - це тести одного виду. Такі тести, як правило, визначають токсичність хімічної речовини для конкретного біологічного виду, як, наприклад, біолюмінесценція бактеріями Allivibrio fisheri в тесті Microtox або тест на пригнічення росту прісноводних водоростей і ціанобактерій (див. Розділ про вибір тесту). організми - Еко рослини). Ці тести відносно прості, використовуючи специфічну токсичну хімічну речовину на конкретний біологічний вид в оптимальних умовах. Керівні принципи ОЕСР щодо тестування хімічних речовин, розділ 2, вплив на біотичні системи дає перелік стандартних тестів. У таблиці 1 перераховані різні тести з мікроорганізмами, стандартизовані Організацією економічного співробітництва та розвитку (ОЕСР).
Таблиця 1. Загальноприйняті тести на екологічну токсичність з використанням мікроорганізмів, стандартизовані Організацією економічного співробітництва та розвитку (ОЕСР).
|
Тест ОЕСР Немає |
Назва |
Середній |
Тип тесту |
|
Прісноводні водорості та ціанобактерії, тест на пригнічення росту (посилання на розділ) |
Водні |
поодинокі види |
|
|
Активований мул, тест на гальмування дихання |
Осад |
Процес |
|
|
224 (проект керівного принципу) |
Визначення пригнічення активності анаеробних бактерій |
Осад |
Процес |
|
Грунтові мікроорганізми: тест на перетворення вуглецю |
Грунт |
Процес |
|
|
Грунтові мікроорганізми: тест на перетворення азоту |
Грунт |
Процес |
Результати цих тестів можна узагальнити у вигляді значень ЄС 10 (див. Розділ «Співвідношення концентрація-реакція»), які можуть бути використані при оцінці ризику (див. Розділи, присвячені підходам та інструментам прогнозної оцінки ризику та підходи до оцінки діагностичного ризику). і інструменти) В основному існує три типи тестів. Тести окремих видів, тести спільноти та тести з використанням мікробних процесів.
Тести одиночного виду
Екологічна актуальність одного виду тесту може бути предметом дискусії. У більшості випадків непрактично працювати з екологічно відповідними видами, оскільки їх важко підтримувати в лабораторних умовах. Кожна екосистема також матиме свої екологічно відповідні види, які потребують надзвичайно великої батареї різних видів випробувань та тестів, які важко виконати відтворюваним способом. Для вирішення цих проблем передбачається, що випробувані види виявляють подібну чутливість до токсикантів, як екологічно відповідні види. Це припущення підтвердилося в ряді випадків. Якщо розподіл чутливості даного токсиканту для ряду тестових видів буде подібним до розподілу чутливості відповідних видів у певній екосистемі, можна використовувати статистичний метод для оцінки безпечної концентрації для більшості видів.
Тести на токсичність з коротким часом інкубації часто обговорюються, оскільки потрібен час для накопичення токсикантів у тестових тварин. Це не є проблемою в тестах на токсичність мікробів, оскільки невеликий розмір досліджуваних організмів дозволяє швидко рівновагу концентрацій токсиканту у воді та в досліджуваному організмі. Навпаки, тривалий час інкубації в умовах, що сприяють зростанню, може привести до виникнення резистентних мутантів, що знизить видиму чутливість досліджуваного організму. Однак цей вибір і зростання стійких мутантів не можна розглядати як позитивний момент, оскільки ці мутанти відрізняються від батьківського штаму і можуть також мати різні екологічні властивості. Насправді вибір антибіотикорезистентних мікроорганізмів у навколишньому середовищі вважається проблемою, оскільки вони можуть перейти до патогенних (сприяння захворюванню) мікроорганізмів, що створює проблеми для пацієнтів, які лікуються антибіотиками.
Тест ОЕСР № 201, який використовує прісноводні водорості та ціанобактерії, є відомим та чутливим однотипним випробуванням мікробної екотоксичності. Більш детально про них розповідається в розділі «Вибір досліджуваних організмів - Еко рослин».
Тести спільноти
Мікроорганізми мають дуже широкий спектр метаболічного різноманіття. Це ускладнює екстраполяцію з одного виду тесту на всі можливі мікробні види, включаючи гриби, протести, бактерії, архей та віруси. Одне рішення полягає в тому, щоб перевірити безліч видів (ціле співтовариство), що піддаються в одному експерименті з токсичністю, стає складніше віднести зниження або збільшення видів до токсичних ефектів. Зростання і занепад видів також можуть бути викликані іншими факторами, включаючи взаємодію видів. Метод толерантності громад, індукованої забрудненням, використовується для виявлення токсичного впливу на громади. Організми виживають у забрудненому середовищі лише тоді, коли вони можуть переносити токсичні хімічні концентрації в своєму середовищі існування. Під час впливу забруднення чутливі види вимерли, а толерантні види займають своє місце та роль в екосистемі (рис. 1). Це поглинання можна контролювати за допомогою дуже простих тестів на токсичність, використовуючи частину громади, витягнутої з навколишнього середовища. Деякі тести використовують включення будівельних блоків для ДНК (тимідин) та білка (лейцин). Інші тести використовують різні субстрати для росту мікробів. Спостереження за тим, що ця частина спільноти стає більш толерантною, як вимірюється цими простими тестами на токсичність, показує, що забруднювач дійсно впливає на мікробне співтовариство. Це особливо корисно, коли вивчаються складні та різноманітні середовища, такі як біоплівки, відкладення та ґрунти.
Тести з використанням мікробних процесів
Захист екосистемних послуг принципово відрізняється від захисту біорізноманіття. Коли людина хоче захистити біорізноманіття, всі види однаково важливі і їх варто захищати. Коли хочеться захистити екосистемні послуги, лише ті види, які виконують процес, повинні бути захищені. Багато видів, що сприяють, можуть перебувати в стані алкогольного сп'яніння, не маючи особливого впливу на процес. Прикладом може служити перетворення азоту, яке перевіряється шляхом вимірювання перетворення амонію в нітрит і нітрат (див.
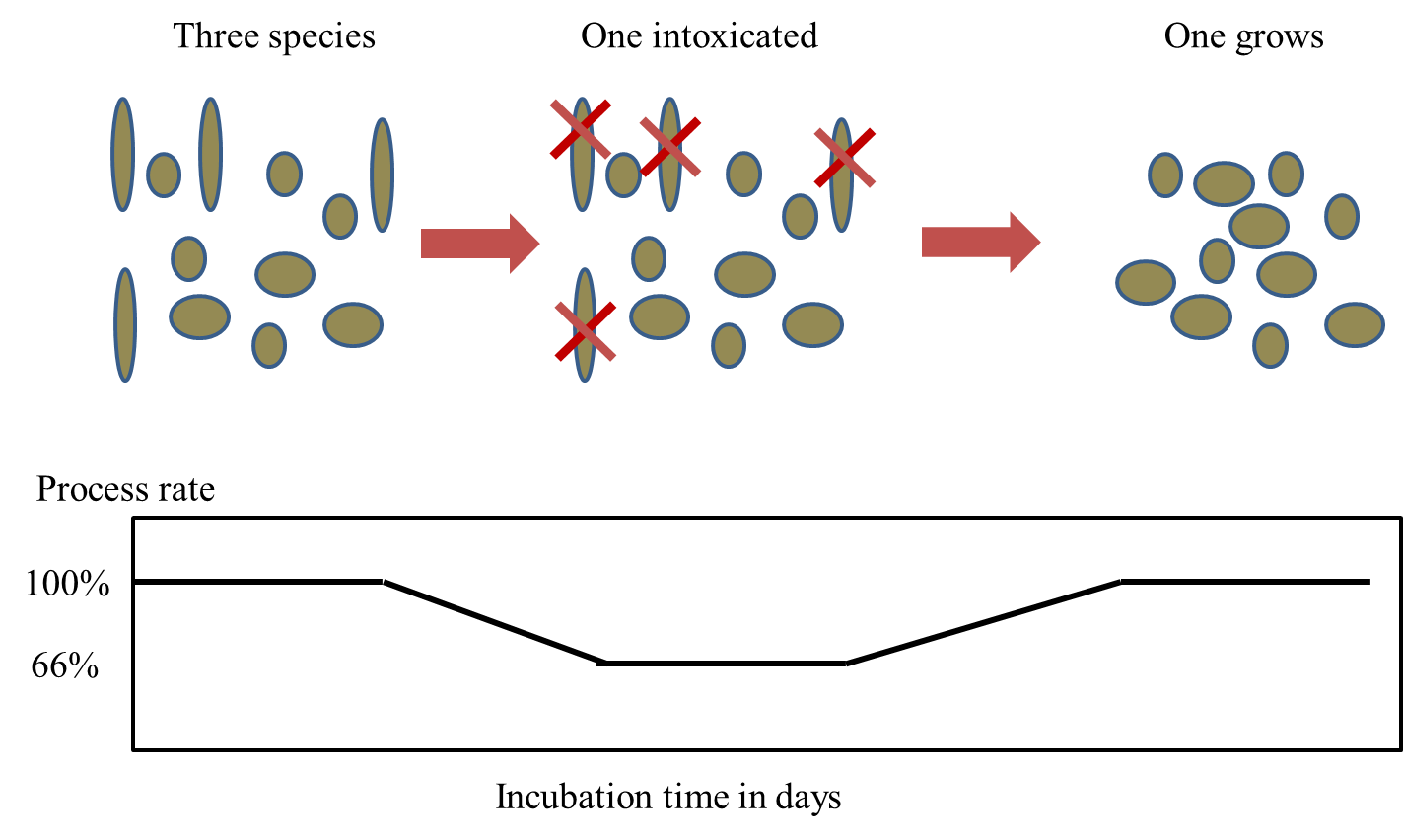
Інактивація найбільш чутливих видів може бути компенсована тривалою активністю або зростанням менш чутливих видів. Тестова конструкція тестів мікробних процесів спрямована на захист процесу, а не видів, що сприяють. Отже, технологічні випробування з таблиці 1 рідко відіграють вирішальну роль у зниженні максимально допустимої концентрації хімічної речовини. Причина полягає в тому, що тести на токсичність окремих видів, як правило, більш чутливі, оскільки вони використовують конкретний біологічний вид як тестовий організм замість процесу.
|
Box: Тест на перетворення азоту Тест ОЕСР № 216 Грунтові мікроорганізми: Тест на трансформацію азоту - це дуже відомий тест на токсичність з використанням ґрунтового процесу перетворення азоту. Тест для неагрохімікатів призначений для виявлення стійких несприятливих впливів токсиканту на процес перетворення азоту в ґрунтах. Порошкова мука конюшини містить азот в основному у вигляді білків, які можуть деградувати та окислюватися з утворенням нітратів. Грунт вносять конюшиновий шрот і обробляють різними концентраціями токсиканту. Грунт забезпечує як досліджувані організми, так і досліджуване середовище. Піщаний грунт з низьким вмістом органічного вуглецю використовується для мінімізації сорбції токсиканту в грунт. Сорбція може зменшити токсичність токсиканту в грунті. Згідно з рекомендацією, ґрунтові мікроорганізми не повинні піддаватися впливу добрив, засобів захисту рослин, біологічних матеріалів або випадкових забруднень протягом принаймні трьох місяців до відбору проб ґрунту. Крім того, грунтові мікроорганізми повинні утворювати не менше 1% ґрунтового органічного вуглецю. Це говорить про те, що мікроорганізми ще живі. Грунт інкубують з конюшиною і токсикантом в сприятливих для мікроорганізмів умовах росту (оптимальна температура, вологість). Кількість утвореної нітрату вимірюють через 7 і 28 днів інкубації. Це дозволяє зростати мікроорганізмів, стійких до токсиканту під час тесту, що може зробити більш тривалий час інкубації менш чутливим. Азот в білках муки конюшини буде перетворений в аміак загальними процесами деградації. Перетворення муки конюшини в аміак може здійснюватися безліччю видів і тому не дуже чутливий до гальмування токсичними сполуками.
Перетворення аміаку в нітрат зазвичай виконується в два етапи. По-перше, бактерії, що окислюють аміак або архей, окислюють аміак в нітрит. По-друге, нітрит окислюється нітритними окислювальними бактеріями в нітрат. Ці останні два етапи, як правило, набагато повільніші, ніж вироблення амонію, оскільки вони вимагають спеціалізованих мікроорганізмів. Ці спеціалізовані мікроорганізми також мають меншу швидкість росту, ніж звичайні мікроорганізми, що беруть участь у загальній деградації білків на амінокислоти. Це робить тест на перетворення азоту набагато чутливішим порівняно з тестом на перетворення вуглецю, який використовує більше поширених мікроорганізмів. За оптимальних умов у випробуванні на перетворення азоту деякі незначні види окислення аміаку або нітритів можуть здатися неважливими, оскільки вони не сприяють загальному процесу. Тим не менш, ці незначні види можуть набути великого значення в менш оптимальних умовах. Наприклад, у кислотних умовах лише архея окислює аміак у нітрит, тоді як бактерії, що окислюють аміак, інгібуються. Тест на перетворення азоту має мінімальну тривалість 28 днів при 20° C при оптимальних умовах вологості, але може бути продовжений до 100 днів. Коротший час інкубації зробить тест більш чутливим. |
У чому недолік зростання під час тесту на токсичність з використанням мікробного процесу?
Згадайте проміжні продукти під час деградації муки конюшини до нітратів.
Чому коротші мікробні тести часто більш чутливі, ніж більш тривалі?
Коли один мікробний вид у навколишньому середовищі замінюється іншим, чи може він впливати на тварин чи рослини?
4.3.7. Вибір досліджуваних організмів - Птахи
Автор: Аннегаайке Леопольд
Рецензенти: Ніко ван ден Брінк, Кіс ван Гестель, Пітер Едвардс
Цілі навчання:
Ви повинні вміти
- Розуміти і аргументувати, чому птахи є важливою моделлю в екотоксикології;
- розуміти та аргументувати мету тестування на токсичність птахів, що проводяться в регуляторних цілях;
- перерахувати найбільш часто використовувані види птахів;
- перерахувати кінцеві точки, які використовуються в тестах на токсичність птахів;
- Назвіть приклади того, як може бути знижена невизначеність в оцінці ризику хімічних речовин для птахів.
Ключові слова: птахи, оцінка ризику, місця проживання, гостре, розмноження.
Вступ
Птахи розглядаються як важливі моделі в екотоксикології з ряду причин:
- вони являють собою різноманітний, рясний і поширений порядок, що населяє багато людських змінених середовищ існування, таких як сільське господарство;
- вони мають фізіологічні особливості, які роблять їх відмінними від інших класів хребетних, що може вплинути на їх чутливість до хімічного впливу;
- вони відіграють особливу роль в екологічному відношенні та виконують важливу роль в екосистемах (наприклад, у розсіюванні насіння, як біологічні засоби контролю за допомогою поїдання комах та видалення туш, наприклад, грифами);
- Цілі захисту часто зосереджені на знакових видах, які звертаються до громадськості.
Тут буде розглянуто кілька специфічних фізіологічних особливостей. Птахи яйцекладові, відкладають ікру з твердою шкаралупою Це призводить до концентрованого впливу (на відміну від впливу через кровотік, як у більшості інших видів хребетних) до матеріально перенесеного матеріалу та, де це актуально, його метаболітів. Це також означає, що потомство отримує єдиний запас поживних речовин (а не безперервне постачання через кровотік). Це робить птахів чутливими до забруднень іншим способом, ніж неяйцекладних хребетних, оскільки ембріони розвиваються без фізіологічного втручання матері. Пташиний ембріон починає регулювати власний гормональний гомеостаз на ранніх стадіях свого розвитку на відміну від ембріонів ссавців. В результаті забруднення, відкладені в яйці самкою птиці, можуть викликати порушення регуляції цих ембріональних процесів (Murk et al., 1996). Птахи мають більш високу температуру тіла (40,6 ºC) і відносно високу швидкість метаболізму, що може вплинути на їх реакцію на хімічні речовини. Як пташенята, птахи, як правило, мають швидку швидкість росту, порівняно з багатьма видами хребетних. Пташенята докоціальних (або неприступних) видів залишають гніздо після вилуплення і, хоча вони можуть слідувати за батьками навколо, вони повністю пернаті і харчуються самостійно. Їм, як правило, потрібно кілька місяців, щоб вирости до повного розміру. Altricial види голі, сліпі і безпорадні в люку і вимагають батьківського піклування, поки вони не оперуть гніздо. Вони часто ростуть швидше - горобині (наприклад, ластівки) можуть досягати повних розмірів і оперізуватися через 14 днів після вилуплення. Багато видів птахів сезонно мігрують на великі відстані і адаптуючись до цього, змінює свою фізіологію і біохімічні процеси. Внутрішні концентрації органічних забруднювачів, наприклад, можуть значно збільшуватися через використання запасів ліпідів під час міграції, тоді як зміни в біохімії можуть підвищувати чутливість птахів до хімічної речовини.
Птахи функціонують як хороші біологічні показники якості навколишнього середовища багато в чому через їх положення в харчовому ланцюзі і залежність від середовища проживання. Цілі захисту часто зосереджені на знакових видах, наприклад, Атлантичний пуфін, європейська горлиця та звичайна сипуха (Birdlife International, 2018).
На початку було визнано, що вплив птахів пестицидами може відбуватися через багато шляхів дієтичного впливу. Враховуючи їх асоціацію з широким діапазоном середовищ існування, вплив може відбуватися шляхом харчування самою культурою, бур'янами або (обробленими) насінням бур'янів, наземним житлом або позакореневим житлом безхребетних, харчуючись безхребетними в грунті, такими як дощові черв'яки, питною водою із забруднених потоків або харчування рибами, що мешкають в забруднених потоках (рис. 1, Brooks et al., 2017). Після введення стійких та високотоксичних синтетичних пестицидів у 1950-х роках та до правил безпеки використання багатьох синтетичних органічних пестицидів призвело до втрат дикої природи - птахів, риб та інших диких тварин (Kendall and Lacher, 1994). В результаті були розроблені національні та міжнародні рекомендації щодо оцінки першого гострого та підгострого впливу пестицидів на птахів у 1970-х роках. На початку 1980-х були розроблені тести для вивчення довгострокового або репродуктивного впливу пестицидів. Поточні рекомендації щодо тестування птахів зосереджені насамперед на активні інгредієнти, що використовуються в засобах захисту рослин, ветеринарних препаратах та біоцидах. В Європі регулювання промислових хімічних речовин REACH вимагає лише інформації про довгострокову або репродуктивну токсичність для речовин, вироблених або імпортованих в кількості не менше 1000 тонн на рік. Ці дані можуть знадобитися для оцінки ризиків вторинного отруєння речовиною, яка, ймовірно, біоакумулюється і не швидко деградує. Вторинне отруєння може виникнути, наприклад, коли хищники споживають заражену рибу. У Сполучених Штатах жодних випробувань на птахів не потрібно відповідно до законодавства про промислові хімікати.

Метою проведення тестів на токсичність птахів є інформування оцінки ефектів птахів (Hart et al., 2001) з метою:
- надати науково обґрунтовану інформацію про тип, розмір, частоту та структуру протягом часу ефектів, очікуваних від певного впливу птахів хімічними речовинами.
- зменшити невизначеність щодо потенційного впливу хімічних речовин на птахів.
- надати інформацію у формі, придатній для використання при оцінці ризиків.
- надавати цю інформацію таким чином, щоб ефективно використовувати ресурси та уникнути зайвого використання та страждань тварин.
Види птахів, що використовуються при випробуванні токсичності
Відбір видів птахів для перевірки токсичності відбувається насамперед на основі їх екологічної актуальності, доступності та здатності пристосовуватися до лабораторних умов для розведення та тестування. Це означає, що більшість випробуваних видів були одомашнені протягом багатьох років. Вони повинні були бути показані відносно чутливими до хімічних речовин через попередній досвід або опубліковану літературу і в ідеалі мати доступні історичні дані контролю.
Види птахів, які найчастіше використовуються при тестуванні на токсичність, були одомашнені:
- вид водоплавних птахів крижень качка (Anas platyrynchos) знаходиться в середньому діапазоні чутливості до хімічних речовин, всеїдна годівниця, багата в багатьох куточках світу, докоціальний вид; вирощені комерційно і випробувальні птахи показують оперення дикого типу;
- наземний вид дичини боб-білий перепел (Colinus virginianus) поширений в США і схожий за чутливістю до крижнів; харчується переважно насінням і безхребетними; докоціальний вид; вирощені комерційно і випробувальні птахи показують оперення дикого типу;
- наземний вид японських перепелів (Coturnix coturnix japonica) зустрічається природним чином в Східній Азії; харчується рослинами матеріальними і наземними безхребетними. Одомашнені в значній мірі, ніж крижани або боббілі перепели, а птиці, вирощені комерційно (для яєць або для м'яса), додатково видаляються генетично з дикого типу. Цей вид унікальний тим, що молодняк року дозріває і розмножується (себе) протягом 12 місяців;
- горобиний, альтріціальний вид зебра в'юрок (Taeniopygia guttata) зустрічається природним чином в Австралії та Індонезії; вони харчуються насінням; містяться і продаються як домашні тварини; недалеко віддалені від дикого типу;
- budgerigar (Melopsittacus hindulates) також альтріціал); зустрічається природним чином в Австралії; їсть насіння, що їсть; розводять в неволі і утримують і продають як домашні тварини.
Інші види птахів іноді використовуються для конкретних, часто спеціально розроблених досліджень. До таких видів відносяться:
- канарейка (Serinus canaria domestica).
- скельний голуб (Columba livia)
- будинковий горобець (Passer domesticus),
- червонокрилий дрізд (Agelaius phoeniceus) - тільки в США
- фазан кільцеподібний, (Phasianus colchicus),
- куріпка сіра (Perdix perdix)
Найбільш поширені тести на токсичність птахів:
У таблиці 1 наведено огляд усіх тестів на токсичність птахів, які були розроблені протягом останніх приблизно 40 років, найбільш часто використовуваних керівних принципів, рекомендованих видів, кінцевих точок, зафіксованих у кожному з цих тестів, типовий вік птахів на початку тесту, тривалість тесту та довжина впливу.
Таблиця 1: Найбільш поширені тести на токсичність птахів з їх рекомендованими видами та ключовими характеристиками.
|
Тест на токсичність птахів |
Орієнтир |
Рекомендовані види |
Кінцеві точки |
Вік на початку тесту |
Тривалість навчання |
тривалість експозиції |
|
Гострий пероральний прийом - послідовне тестування - в середньому 26 птахів |
боб-білий перепел, японський перепел, зебра в'юрок, бугородик |
смертність, клінічні ознаки, маса тіла, споживання їжі, груба некропсія |
Молоді птахи ще не спаровуються, віком не менше 16 тижнів на початку випробування. |
Не менше 14 днів |
Разова пероральна доза на початку тесту |
|
|
Гострий оральний гаваж - 60 дизайн птахів |
УЕПА ОСПП 850.2100 |
Боб-білий перепел Рекомендуються одиночні види горобиних. |
Див. Вище |
Молоді птахи ще не спаровуються, віком не менше 16 тижнів на початку випробування. |
14 днів |
Разова пероральна доза на початку тесту |
|
Підгостра дієтична токсичність* |
Бобайт перепел, крижень |
Див. Вище |
Крижень: 5 днів Бобайт перепел: 10-14 днів |
8 днів |
5 днів |
|
|
Розмноження одного покоління |
КОСПП 850.2200 |
Бобайт перепел, крижень, японський перепіл** |
Маса тіла дорослих, споживання їжі, несучість, фертильність, виживання ембріонів, хетракт, виживання пташенят. |
Наближається перший сезон розмноження: крижень (від 6 до 12 місяців) Боб-білий перепел 20 -24 тижнів |
20 - 22 тижні |
10 тижнів |
|
Тестування на уникнення (випробування пера) |
Як можна тісно пов'язане з видами, що піддаються ризику; наприклад: горобець скельний голуб, фазан, куріпка сіра |
Прийом їжі, смертність, Сублетальні ефекти |
Молоді дорослі, якщо це можливо (залежить від дизайну дослідження) |
Від одного до декількох днів, залежно від дизайну дослідження. |
Від одного до декількох днів, залежно від дизайну дослідження. |
|
|
Тест ендокринного розладу двох поколінь |
Японські перепели |
На додаток до кінцевих точок, перерахованих для дослідження одного покоління: чоловіча сексуальна поведінка, біохімічні, гістологічні та морфологічні кінцеві точки |
4 тижні після люка |
38 тижнів |
8 тижнів - доросла (F0) генерація +14 тижнів покоління F1. |
|
|
Польові дослідження для уточнення залишків їжі в оцінках ризику птахів вищого рівня. |
Додаток N керівництва птахів і ссавців EFSA. |
Залежить від видів, що піддаються ризику в зоні використання пестицидів. |
Залежить від розробленого дизайну дослідження. |
Некерований у польових дослідженнях |
Залежить від розробленого дизайну дослідження. |
Залежить від розробленого дизайну дослідження. |
* Це дослідження навряд чи кожен просив більше.
** Тільки в Керівних принципах ОЕСР
Тестування гострої токсичності
Для оцінки короткострокового ризику для птахів необхідно провести тести на гостру токсичність для всіх пестицидів (їх діючої речовини), яким птиці, ймовірно, піддаються впливу, в результаті чого ЛД 50 (мг/кг тіла/день) (див. Розділ про співвідношення концентрація-реакція). Тест на гостру пероральну токсичність включає дозування або капсули на початку дослідження (рис. 2). Необхідно дотримуватися обережності при дозуванні птахів пероральним прийомом. Деякі види можуть легко відригувати, що призводить до невизначеності в наведеній дозі. До них відносяться крижень качка, голуби і деякі види горобиних. У таблиці 1 наведено види птахів, рекомендовані відповідно до рекомендацій ОЕСР та USEPA. Ігрові птахи та горобині - це гарне поєднання для врахування філогенії та хороша відправна точка для кращого розуміння розподілу чутливості до видів.
Керівництво ОЕСР 223 використовує в середньому 26 птахів і є послідовним дизайном (Edwards et al., 2017). Відповіді птахів на кожен етап випробування об'єднуються для оцінки та поліпшення оцінки ЛД 50 і схилу. Тестування може бути зупинено на будь-якому етапі після того, як точність оцінки LD 50 відповідає вимогам оцінки ризику, отже, використовуючи набагато менше птахів для відповідності 3Rs (зменшення, уточнення та заміни). Якщо очікується, що токсичність буде низькою, 5 птахів дозують в граничній дозі 2000 мг/кг (що є найвищою прийнятною дозою для прийому всередину, з гуманної точки зору). При відсутності смертності в лімітному тесті через 14 днів дослідження є завершеним і ЛД 50>2000 мг/кг маси тіла. Якщо є смертність, одна людина лікується в кожній з 4 різних доз на стадії 1. З цими результатами визначається робоча оцінка LD 50 для вибору 10 подальших рівнів дози для кращої оцінки LD 50 на етапі 2. Якщо потрібно нахил, потрібна подальша стадія 3 з використанням ще 10 птахів у комбінації доз, вибраних на основі попередньої оцінки схилу.
Керівництво USEPA - це одноетапна конструкція, якій передує тест на визначення діапазону (використовується лише для встановлення концентрацій для основного тесту). Тест LD 50 використовує 60 птахів (по 10 в кожній з п'яти тестових концентрацій і 10 птахів у контрольній групі). Незважаючи на велику кількість використовуваних птахів, здатність оцінювати нахил є поганою порівняно з OECD223 (здатність обчислювати LD 50 аналогічна керівництву ОЕСР 223).

Тестування на токсичність дієтичного харчування
Для середньострокової оцінки ризику в минулому регулярно проводився тест на токсичність птахів, піддаючи неповнолітніх (пташенят) боббілих перепелів, японських перепелів або крижень на оброблену дієту. Цей тест визначає серединну летальну концентрацію (LC 50) хімічної речовини у відповідь на 5-денний дієтичний вплив. Враховуючи наукові обмеження та проблеми добробуту тварин, пов'язані з цим тестом (EFSA, 2009), чинні європейські правила рекомендують виконувати цей тест тільки тоді, коли очікується, що значення LD 50, виміряне середньостроковим дослідженням, буде нижче гострого LD 50 тобто. якщо хімічна речовина є накопичувальним за своєю дією.
Тестування відтворення
Для реєстрації всіх пестицидів, яким, ймовірно, будуть піддаватися птахи під час періоду розмноження, потрібні тести на розмноження одного покоління у боббілих перепелів та/або крижень. У таблиці 1 представлені два стандартні дослідження: тест ОЕСР 206 та дослідження EPA OCSPP 850.2100 США. Речовина, що підлягає дослідженню, змішується в раціон з самого початку тесту. Годують птахів ad libitum протягом рекомендованого періоду 10 тижнів до початку відкладання яєць у відповідь на зміну фотоперіоду. Період відкладання яєць повинен тривати не менше десяти тижнів. Кінцеві точки включають масу тіла дорослих, споживання їжі, макроскопічні результати в некропсії та репродуктивних кінцевих точках, причому кількість 14-денних вижили пташенят і каченят як загальна кінцева точка.
У керівництві ОЕСР зазначено, що японський перепел (Coturnix coturnix japonica) також прийнятний.
Тестування на уникнення (або відлякування)
Поведінка птахів у польових умовах може розглядатися як зниження ризику впливу пестициду, і тому може розглядатися при оцінці ризику. Однак виникнення уникнення в лабораторії має заплутаний вплив на оцінки токсичності в дієтичних дослідженнях (LD 50). Тести на уникнення досі мають найбільшу актуальність при оцінці ризику обробки насіння. Необхідно враховувати ряд факторів, включаючи швидкість годування та концентрацію їжі, які можуть визначити, чи є уникнення чи смертність результатом. Наступний всеосяжний звіт ОЕСР містить огляд розробки керівних принципів та дослідницької діяльності, що відбулися на сьогоднішній день під прапором ОЕСР. Іноді ці дослідження проводяться як напівпольові (або перо) дослідження.
Тестування ендокринного деструктора
Ендокринні речовини можуть бути визначені як матеріали, що викликають вплив на розмноження через порушення ендокринних опосередкованих процесів. Якщо є підстави підозрювати, що речовина може мати ендокринний ефект у птахів, може бути виконано два покоління птахів тест дизайн, спрямований спеціально на оцінку ендокринних ефектів. Цей тест був розроблений USEPA (OCSPP 890.210). Однак тест не був прийнятий як тест ОЕСР на сьогоднішній день. Він використовує японських перепелів як кращий вид. Основними причинами, за якими для цього тесту були обрані японські перепели: 1) Японські перепели - це докоціальний вид, як згадувалося раніше. Це означає, що при вилупленні пташенята японських перепелів набагато далі за своєю статевою диференціацією і розвитком, ніж пташенята альтріціальних видів були б. Гормональні процеси, що відбуваються у японських перепелів на цих ранніх стадіях розвитку, можуть порушуватися хімічними речовинами, материнськими відкладеннями в яйці (Ottinger and Dean, 2011). І навпаки, альтріціальні види проходять ці самі стадії статевого розвитку після вилуплення і можуть піддаватися впливу хімічних речовин в їжі, які можуть вплинути на ці самі гормональні процеси. 2) як згадувалося вище, молодь року дозріває і розмножується (себе) протягом 12 місяців, що робить тест більш ефективним, ніж якщо один використовується бобуайт перепел або крижень.
Серед пташиних токсикологів стверджується, що необхідно розробити ендокринну систему аналізу зебри в'юрків, поряд з японською системою перепелів, оскільки це дозволить більш систематично визначити відмінності між реакціями на EDC у альтріціальних та докоціальних видів, дозволяючи кращу оцінку та подальша оцінка ризику потенційних ендокринних ефектів у птахів. Відмінності батьківського піклування, гніздової поведінки та територіальності є прикладами аспектів, які можуть бути включені в такий підхід (Jones et al., 2013).
Польові дослідження:
Польові дослідження можуть бути використані для перевірки несприятливих впливів на цілий ряд видів одночасно, в умовах фактичного впливу в навколишньому середовищі (Hart et al, 2001). Кількість ділянок і контрольних полів і методів (обшуки трупів, переписи та радіотрекінг) потребують ретельного розгляду для оптимального використання польових досліджень у токсикології птахів. Місце поля визначатиме вивчені види, і важливо враховувати актуальність цього виду в інших місцях. Для подальшого читання про методи та методи, які будуть використані в дослідженнях пташиного поля Sutherland et al і Bibby et al. (2000) рекомендуються.
Посилання
Біббі, К., Джонс, М., Марсден, С. Експедиційні польові методи обстеження птахів. Birdlife Інтернешнл.
Пташине життя Інтернешнл (2018). Статус птахів світу. https://www.birdlife.org/sites/default/files/attachments/BL_ReportENG_V11_spreads.pdf
Брукс, А.К., Фритєр, М., Лоуренс, А., Паскуаль, Дж., Шарп, Р. (2017). Роздуми про оцінку ризику птахів та ссавців для засобів захисту рослин у Європейському Союзі: минуле, сьогодення та майбутнє. Екологічна токсикологія та хімія 36, 565-575.
Едвардс, П.Дж., Леопольд, А., Бобри, Дж. Б., Спрингер, Т.А., Чепмен, П., Мейнард, С.К., Хаббард, П. Більш-менш: Аналіз ефективності пташиного гострого усного керівництва ОЕСР 223 за емпіричними даними. Інтегрована екологічна оцінка та управління 13, 906-914.
Харт, А., Баллуфф, Д., Барфкнехт, Р., Чепмен, П.Ф., Хоукс, Т., Йорманн, Г., Леопольд, А., Луттік, Р. (ред.) (2001). Оцінка ефектів птахів: Рамки для досліджень забруднюючих речовин. Доповідь семінару SETAC на тему «Гармонізовані підходи до оцінки впливу птахів», проведеного за підтримки ОЕСР, у Вудсхотені, Нідерланди, вересень 1999 року. Книга SETAC.
Джонс, П.Д., Хеккер, М., Уайзмен, С., Гісі, Дж. П. Птахи. Глава 10 В: Маттіссен, П. (Ред.) Ендокринні руйнівники - методи тестування та оцінки небезпеки. Вілі та сини.
Кендалл, Р.Дж., Лачер-молодший, Т.Е. (ред.) (1994). Токсикологія дикої природи та моделювання популяцій - комплексні дослідження агрохекосистем. Спеціальна публікація SETAC.
Мурк, А.Й., Будевейн, Т.Й., Майнінгер, П.Л., Босвельд, А.Т.К., Россаерт, Г., Єберт, Т., Мейре, П., Дірксен, С. (1996). Вплив полігалогенізованих ароматичних вуглеводнів та пов'язаних з ними забруднень на загальне розмноження крячків: Інтеграція біологічних, біохімічних та хімічних даних. Архіви забруднення навколишнього середовища та токсикології 31, 128-140.
Оттінгер, М.А., Дін К. Нейроендокринні наслідки хімічних речовин, що руйнують ендокринну систему у птахів: життєва стадія та чутливість видів. Журнал токсикології та охорони навколишнього середовища, частина B: критичні огляди. 26 липня 2011 року.
Сазерленд, В.Дж., Ньютон, І., Грін, Р.Е. (ред.) (2004). Біологічна екологія та збереження. Посібник з методик. Преса Оксфордського університету
Наведіть три причини, чому птахи є важливою моделлю в екотоксикології?
Яка мета тестування на токсичність птахів?
Які види птахів найчастіше використовуються і чому?
У чому різниця між докоціальними і альтріціальними видами?
Які кінцеві точки зазвичай використовуються в стандартизованих тестах на токсичність птахів?
Назвіть два приклади того, як можна зменшити невизначеність при оцінці ризиків хімічних речовин для птахів.
4.3.8. Тестування токсичності in vitro
Автор: Тімо Хаммерс
Рецензент: Арно Гутлеб
Цілі навчання
Ви повинні вміти:
- пояснити різницю між біоаналізами in vitro та in vivo
- опишіть принцип аналізу зв'язування лігандів, аналізу на інгібування ферментів та біоаналізу репортерного гена
- пояснити різницю між первинними клітинними культурами, кінцевими клітинними лініями та безперервними клітинними лініями
- описати різні рівні потенції диференціації клітин від тотипотентного до уніпотентного;
- вказати, як in vitro культури диференційованих клітин можуть бути отримані з ембріональних стовбурових клітин і з індукованих плюрипотентних стовбурових клітин
- наведіть приклади кінцевих точок, які можна виміряти в біоаналізах на основі клітин
- обговорити своїми словами майбутню перспективу тестування токсичності in vitro
Ключові слова: лігандний зв'язуючий аналіз; ферментний інгібування; культура первинних клітин; клітинна лінія; стовбурові клітини; орган на чіпі
Вступ
Біоаналізи in vitro відносяться до методів тестування з використанням тканин, клітин або білків. Термін «in vitro» (означає «у склі») позначає пробірки або чашки Петрі, виготовлені зі скла, які традиційно використовувалися для проведення цих видів тестів на токсичність. В даний час біоаналізи in vitro частіше виконуються в пластикових мікротитрових колодязях, що містять множинні (6, 12, 24, 48, 96, 384 або 1536) тестові контейнери (звані «колодязями») на пластину (рис. 1). Біоаналізи in vitro зазвичай проводяться для скринінгу окремих речовин або зразків на конкретні біологічно активні властивості. Таким чином, токсикологія in vitro відноситься до науки про тестування речовин або зразків на конкретні токсичні властивості з використанням тканин, клітин або білків.

Більшість біоаналізів in vitro показують реакцію, специфічну для механізму, яка, наприклад, свідчить про інгібування конкретного ферменту або активації конкретного молекулярного рецептора. Більше того, біоаналізи in vitro зазвичай проводяться в невеликих обсягах тесту і мають короткі терміни тесту (зазвичай інкубаційні періоди коливаються від 15 хвилин до 48 годин). Як наслідок, кілька зразків можуть бути перевірені одночасно в одному експерименті, а кілька експериментів можуть бути виконані за відносно короткий тестовий період. Ця «середня пропускна здатність» характеристика біоаналізів in vitro може бути навіть збільшена до високої пропускної здатності», якщо кроки, що обмежують час у процедурі тестування (наприклад, підготовка зразків, культивування клітин, піпетування, зчитування) додатково автоматизовані.
Токсичність тести з використанням бактерій також часто виконуються в невеликих обсягах, що дозволяє короткий тест тривалості і високу пропускну здатність. Тим не менш, такі тести використовують неушкоджені організми, і тому їх слід суворо розглядати як біоаналізи in vivo. Це особливо актуально, якщо бактерії використовуються для вивчення кінцевих точок, таких як виживання або зростання населення. Однак тест-системи бактерій, що вивчають специфічні токсичні механізми, такі як тест Еймса, який використовується для скринінгу речовин на мутагенні властивості (див. Розділ Канцерогенність та генотоксичність), часто розглядаються як біоаналізи in vitro через схожість характеристик тесту при порівнянні до тестів на токсичність in vitro з клітинами, отриманими з вищих організмів.
Аналізи на основі білків
Найпростіша форма аналізу зв'язування in vitro складається з очищеного білка, який інкубується потенційно токсичною речовиною або зразком. Очищені білки зазвичай отримують шляхом виділення з інтактного організму або з культур рекомбінантних бактерій, які генетично модифіковані для вираження цікавить білка.
Аналізи зв'язування лігандів використовуються для визначення того, чи здатна досліджувана речовина зв'язуватися з білком, тим самим пригнічуючи зв'язуючу здатність природного (ендогенного) ліганду з цим білком (див. Розділ Інактивація білка). Білки, що представляють інтерес, наприклад, протеїни рецепторів або білки-транспортери. Аналізи зв'язування лігандів часто використовують природний ліганд, який був позначений радіоактивним ізотопом. Білок інкубується з маркованим лігандом в присутності різної концентрації досліджуваної речовини. Якщо зв'язування білка досліджуваної речовиною перешкоджає зв'язуванню ліганду з білком, вільний ліганд показує залежне від концентрації підвищення радіоактивності (див. Рис. Отже, ліганд-білковий комплекс показує залежне від концентрації зниження радіоактивності. Як варіант, природний ліганд може бути позначений флуоресцентною групою. Зв'язування такого міченого ліганду з білком часто викликає збільшення флуоресценції. Отже, зниження флуоресценції спостерігається, якщо досліджувана речовина перешкоджає зв'язуванню ліганду з білком.
Аналізи на інгібування ферментів використовуються для визначення того, чи здатна досліджувана речовина пригнічувати ферментативну активність білка. Ферментативна активність зазвичай визначається як швидкість перетворення субстрату в продукт. Інгібування ферменту визначається як зниження швидкості конверсії, що відповідає меншим концентраціям продукту і більш високим концентраціям субстрату після різних періодів інкубації. Кількісні заходи зникнення субстрату або утворення продукту можуть бути зроблені шляхом хімічного аналізу субстрату або продукту. Переважно, однак, швидкість реакції вимірюється спектрофотометрією або флуоресценцією. Це досягається шляхом виконання реакції з підкладкою, яка має певний колір або флуоресценцію сама по собі або яка дає продукт з певним кольором або флуоресценцією, в деяких випадках після реакції з додатковим індикаторним з'єднанням. Відомим прикладом аналізу на інгібування ферментів є аналіз інгібування ацетилхолінестерази (див. Розділ Діагностика - біоаналізи in vitro).
Клітинні культури
Біоаналізи на основі клітин використовують культури клітин, які підтримуються в лабораторії. Культування клітин починається з механічного або ферментативного виділення окремих клітин з тканини (отриманої від тварини або рослини). Згодом клітини вирощуються в середовищі культури клітин, тобто рідини, яка містить всі необхідні поживні речовини, необхідні для оптимального росту клітин (наприклад, фактори росту, вітаміни, амінокислоти) і регулює фізико-хімічне середовище клітин (наприклад, буфер рН, солоність). Зазвичай можна виділити кілька видів клітинних культур (рис. 3).
Первинні культури клітин складаються з клітин, які безпосередньо виділені від організму донора і підтримуються in vitro. Як правило, такі клітинні культури складаються або з клітинної суспензії неприлиплих клітин, або з моношару прилиплих клітин, прикріплених до субстрату (тобто часто дна культуральної судини). Клітини можуть піддаватися декільком поділам клітин до тих пір, поки клітинна суспензія не стане занадто щільною або прилеглі клітини ростуть один на одного. Потім клітини можуть бути додатково підкультивовані шляхом перенесення частини клітин з первинної культури в нову культуральну посудину, що містить свіже середовище. Це потомство первинної культури клітин називається клітинною лінією, тоді як подія субкультивування називається проходженням. Зазвичай клітинні лінії, отримані з первинних клітин, піддаються старінню і припиняють проліферацію після обмеженої кількості (20-60) клітинних поділів. Отже, така скінченна клітинна лінія може піддаватися лише обмеженій кількості проходів. Первинні клітинні культури і їх наступні кінцеві клітинні лінії мають ту перевагу, що вони дуже нагадують фізіологію клітин in vivo. Недоліком таких клітинних культур для тестування токсичності є те, що вони діляться відносно повільно, вимагають специфічних умов культивування клітин і є кінцевими. Нові культури можна отримати лише з нових донорських організмів, що займає багато часу, дорого і може внести генетичні зміни.
Крім того, були встановлені безперервні клітинні лінії, які мають невизначений термін життя, оскільки клітини безсмертні. Через генетичних мутацій клітини з безперервної клітинної лінії можуть піддаватися невизначеній кількості поділів клітин і вести себе як ракові клітини. Увічнюючі мутації могли бути присутніми в початковій культурі первинних клітин, якщо ці клітини були виділені зі злоякісної пухлинної тканини раку. Крім того, вихідна лінія скінченних клітин може бути перетворена в безперервну клітинну лінію шляхом введення вірусної або хімічної індукованої мутації. Перевага безперервних клітинних ліній полягає в тому, що клітини швидко розмножуються і їх легко культивувати та маніпулювати (наприклад, шляхом генетичної модифікації). Недоліком є те, що безперервні клітинні лінії мають інший генотип і фенотип, ніж оригінальні здорові клітини in vivo (наприклад, втратили ферментативну здатність) і поводяться як ракові клітини (наприклад, втратили диференціюючі здібності та здатність утворювати щільні з'єднання).
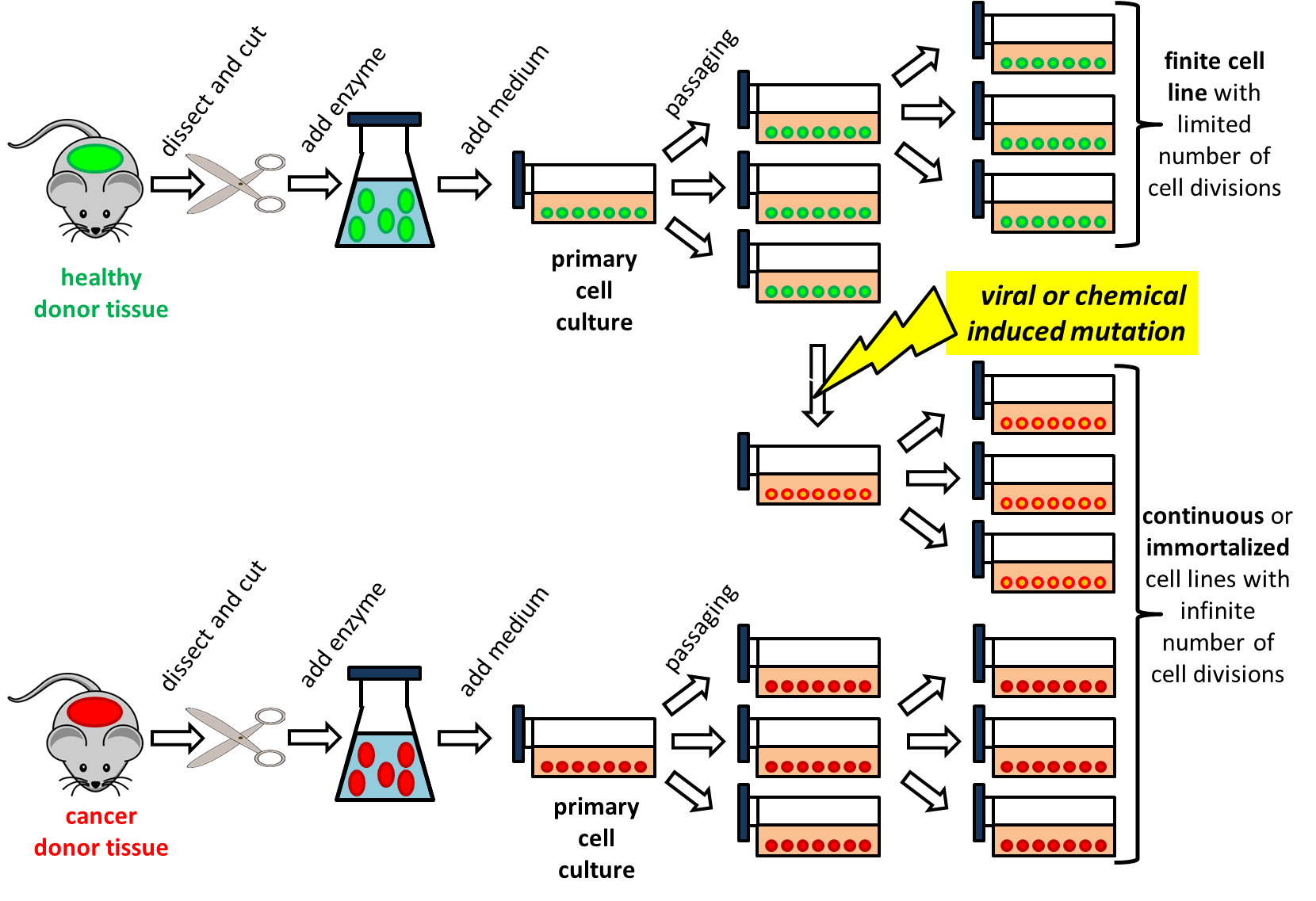
Моделі диференціації
Для вивчення токсичної дії сполук in vitro токсикологи вважають за краще використовувати клітинні культури, які нагадують диференційовані здорові клітини, а не недиференційовані ракові клітини. Тому моделі диференціації привертають все більшу увагу в токсикології in vitro в останні роки. Такі моделі диференціювання засновані на стовбурових клітині, які є клітинами, які мають потенцію диференціювати на соматичні клітини. Стовбурові клітини можуть бути отримані з ембріональних тканин на різних стадіях нормального розвитку, кожна зі своєю потенцією диференціювати в соматичні клітини (див. Рис. 1 в Berdasco and Esteller, 2011). На самому ранньому ембріональному етапі клітини з «стадії морули» (тобто після декількох клітинних відділів зиготи) є тотипотентними, що означає, що вони можуть диференціюватися у всіх типах клітин організму. Пізніше в розвитку клітини з внутрішньої клітинної маси трофобласта є плюрипотентними, що означає, що вони можуть диференціюватися у всіх типах клітин, крім екстраембріональних клітин. Під час гаструляції клітини з різних зародкових шарів (тобто ектодерми, мезодерми та ентодерми) є мультипотентними, що означає, що вони можуть диференціюватися на обмежену кількість типів клітин. Подальша диференціація призводить до клітини-попередників, які є уніпотентними, що означає, що вони прагнуть диференціюватися на єдиний кінцевий диференційований тип клітин.
Залишаючись недиференційованими, культури ембріональних стовбурових клітин in vitro (ESC) можуть ділитися нескінченно довго, оскільки вони не страждають від старіння. Однак клітинну лінію ESC не можна розглядати як безперервну (або увічнену) клітинну лінію, оскільки клітини не містять генетичних мутацій. ESC можна диференціювати на тип клітин, що цікавлять, маніпулюючи умовами культури клітин таким чином, що конкретні сигнальні шляхи стимулюються або інгібуються в тій же послідовності, що і під час диференціації типу клітин in vivo. Маніпуляція може складатися з додавання факторів росту, факторів транскрипції, цитокінів, гормонів, стресових факторів тощо Такий підхід вимагає хорошого розуміння того, які фактори впливають на етапи прийняття рішень в клітинній лінії цікавить типу клітин.
Диференціація ЕСК на диференційовані клітини застосовується не тільки при тестуванні на токсичність in vitro, але й у відкритті лікарських засобів, регенеративній медицині та моделюванні захворювань. Тим не менш, знищення людського ембріона з метою виділення - переважно плюрипотентних - людських ЕСК (HESC) викликає етичні питання. Тому досліджено альтернативні джерела ГЕСК. Виділення та подальша in vitro диференціація мультипотентних стовбурових клітин з навколоплідних вод (зібраних під час кесаревого розтину), пуповинної крові та кісткового мозку дорослої людини є дуже актуальною сферою досліджень.
Революційним розвитком у галузі моделей диференціювання неембріональних стовбурових клітин стало відкриття того, що диференційовані клітини можуть бути перепрограмовані на недиференційовані клітини з плюрипотентними можливостями, які називаються індукованими плюрипотентними стовбуровими клітинами (IPSCs) (рис. 4). У 2012 році Нобелівська премія з фізіології або медицини була присуджена Джону Гурдону та Шіні Яманаці за це новаторське відкриття. Перепрограмування диференційованих клітин, виділених від дорослого донора, отримують шляхом впливу на клітини суміші факторів перепрограмування, що складаються з факторів транскрипції, характерних для плюрипотентних стовбурових клітин. Отримані ІПСК можна знову диференціювати (аналогічно ESC) на будь-який тип диференційованих клітин, для яких відомі необхідні умови для клітинного роду і можуть бути змодельовані in vitro.
У той час як моделі диференціації на основі IPsC вимагають повного перепрограмування диференційованої соматичної клітини назад на рівень стовбурових клітин, трансдиференціація (або перепрограмування лінії) є альтернативною методикою, за допомогою якої диференційовані соматичні клітини можуть бути перетворені в іншу тип диференційованих соматичних клітин, що не проходять проміжну плюрипотентну стадію. Особливо лінії клітин фібробластів відомі своєю здатністю трансдиференціюватися в різні типи клітин, такі як нейрони або адипоцити (рис. 5).
Біоаналізи на основі клітин
У клітинних біоаналізах in vitro культури клітин піддаються впливу тестових сполук або зразків і вимірюється їх реакція. В принципі, всі типи моделей культури клітин, розглянуті вище, можуть бути використані для тестування токсичності in vitro. З міркувань часу, грошей та комфорту зазвичай використовуються безперервні клітинні лінії, але все частіше використовуються первинні клітинні лінії та клітинні лінії, отримані IPSC, з міркувань вищої біологічної актуальності. Кінцеві точки, які вимірюються в культурах клітин in vitro, що піддаються впливу токсичних сполук, зазвичай варіюються від впливу на життєздатність клітин (вимірюється як зниження функціонування мітохондрій, збільшення пошкодження мембран або зміни метаболізму клітин; див. розділ про цитотоксичність) і росту клітин до впливу на клітини кінетика (абсорбція, елімінація і біотрансформація клітинних субстратів), зміни в клітинному транскриптомі, протеомі або метаболомі, або вплив на залежне від типу клітин функціонування. Крім того, моделі диференціації клітин можуть бути використані не тільки для вивчення впливу сполук на диференційовані клітини, але і для вивчення впливу на процес диференціації клітин як такої шляхом оголення клітин під час диференціювання.
Специфічним типом біоаналізів на основі клітин є біоаналізи репортерів генів, які часто використовуються для скринінгу окремих сполук або складних сумішей, витягнутих із зразків навколишнього середовища для їх потенції для активації або інактивації рецепторів, які відіграють певну роль у експресії генів, які грають важливу роль в конкретному шляху. Біоаналізи генів репортера використовують генетично модифіковані клітинні лінії або бактерії, які містять вбудовану генну конструкцію, що кодує для легко вимірюваного білка (тобто білка репортера). Цей генний конструкт розроблений таким чином, що його експресія викликається специфічною взаємодією між токсичною сполукою і клітинним рецептором. Якщо рецептор активується токсичною сполукою, відбувається транскрипція та трансляція білка репортера, який можна легко виміряти як зміна кольору, флуоресценції або люмінесценції (див. Розділ Діагностика - біоаналізи in vitro).
Майбутні розробки
Незважаючи на те, що існує соціальна потреба в нетоксичному середовищі, існує також соціальний попит на R зменшити, R визначити та R замінити дослідження тварин (три принципи R). Заміна досліджень на тварині тестами in vitro вимагає, щоб отримані результати in vitro були показовими та прогнозуючими для того, що відбувається в ситуації in vivo. Очевидно, що культура клітин, що складається з одного типу клітин, не порівнянна зі складним організмом. Наприклад, токсикокінетичні аспекти навряд чи враховуються в біоаналізах на основі клітин. Хоча деякі клітини можуть мати метаболічні можливості, такі процеси, як адсорбція, розподіл та елімінація, не представлені як вплив, як правило, безпосередньо на клітини. Більше того, клітинним культурам часто бракує механізмів відновлення, петель зворотного зв'язку та будь-якої іншої взаємодії з іншими типами/тканинами/органами клітин, як це виявлено в інтактних організмах. Для розширення сфери застосування екстраполяції in vitro - in vivo (IVIVE) сьогодні розробляються більш складні моделі in vitro, які мають більш близьку схожість з ситуацією in vivo. Наприклад, якщо культивування клітин традиційно проводилося в двовимірних моношарах (тобто в шарах товщиною 1 клітина), 3D-культивування клітин набирає обертів. Перевага 3D-культивування полягає в тому, що він являє собою більш реалістичний тип росту клітин, включаючи клітинно-клітинні взаємодії, поляризацію, диференціювання, позаклітинний матрикс, градієнти дифузії тощо Для епітеліальних клітин (наприклад, клітин легенів) такі 3D-культури навіть можуть вирощуватися в міжфазі повітря-рідина відображаючи ситуацію in vivo. Іншим розвитком є спільне культивування клітин, де різні типи клітин культивуються разом у культурі клітин. Наприклад, два типи клітин, які взаємодіють в органі, можуть бути спільно культивовані. Крім того, диференційований тип клітин, який має погану метаболічну здатність, може бути спільно культивований з клітиною печінки, щоб врахувати можливу детоксикацію або біоактивацію після біотрансформації. Новітньою розробкою у зростаючій складності тестових систем in vitro є так звані пристрої «орган на мікросхемі», в яких різні типи клітин спільно культивуються в мініатюризованих малих каналах. Клітини можуть піддаватися різним потокам, що представляють, наприклад, потік крові, який може містити токсичні сполуки (див. Наприклад, відеокліпи на https://wyss.harvard.edu/technology/human-organs-on-chips/). На основі подібних методик можуть бути побудовані навіть пристрої людського тіла на мікросхемі. Такі чіпи містять різні мініатюризовані відсіки, що містять клітинні ко-культури, що представляють різні органи, які всі з'єднані між собою різними каналами, що представляють мікрорідинну кровоносну систему (рис. 6). Хоча такі пристрої знаходяться в дитинстві і регулярно стикаються з непрактичностями, слід очікувати, що ці інноваційні розробки зіграють свою роль у найближчому майбутньому випробувань на токсичність.
Який принцип аналізу на зв'язування лігандів?
Який принцип аналізу на інгібування ферментів?
Який принцип біоаналізу генів репортера?
Які переваги та недоліки первинних клітинних культур порівняно з безперервними клітинними лініями?
У чому різниця між ембріональними стовбуровими клітинами та індукованими плюрипотентними стовбуровими клітинами?
4.3.9. Тестування на токсичність людини - I. Загальні аспекти
У підготовці
4.3.9. Тестування токсичності людини - II. Тести in vitro
(Чернетка)
Автор: Неллі Саєнен
Рецензенти: Карен Смітс, Френк Ван Беллегхем
Цілі навчання:
Ви повинні вміти
- аргументувати необхідність альтернативних методів випробувань на токсичність
- список часто використовуваних аналізів цитотоксичності in vitro і пояснити, як вони працюють
- описати різні типи токсичності шкіри та методи тестування in vitro для оцінки цього типу токсичності
Ключові слова: in vitro, токсичність, цитотоксичність, шкіра
Вступ
Тести на токсичність необхідні для оцінки потенційної небезпеки нових сполук для людини. Ці тести виявляють видові, органо-та дозоспецифічні токсичні ефекти досліджуваної сполуки. Токсичність може спостерігатися як при дослідженнях in vitro з використанням клітин/клітинних ліній (див. Розділ про біоаналіз in vitro), так і шляхом впливу in vivo на лабораторних тварин; і включає різні тривалості впливу (гострий, субхронічний та хронічний). Відповідно до Директиви 2010/63/ЄС про захист тварин, що використовуються в наукових цілях, рекомендується використовувати альтернативи тестуванню на тварин (ОЕСР: альтернативні методи тестування на токсичність). Першим кроком до заміни тварин є використання методів in vitro, які можуть бути використані для прогнозування гострої токсичності. У цьому розділі ми представляємо тести на гостру цитотоксичність in vitro (= якість токсичності для клітин) та шкірні корозійні, подразнюючі, фототоксичні та чутливі тести, оскільки шкіра є найбільшим органом організму.
- Тести на цитотоксичність
Тест на цитотоксичність є одним з біологічних оціночних та скринінгових тестів in vitro для спостереження життєздатності клітин. Рівні життєздатності клітин є хорошими показниками здоров'я клітин. Умовно використовувані тести на цитотоксичність включають виключення барвника або поглинання аналізів, таких як Трипан синій виключення (TBE) і Нейтральний червоний поглинання (NRU).
Тест TBE використовується для визначення кількості життєздатних клітин, присутніх у клітинній суспензії. Живі клітини мають інтактними клітинними мембранами, які виключають певні барвники, такі як трипан синій, тоді як мертві клітини цього не роблять. У цьому аналізі клітинну суспензію, інкубовану з серійними розведеннями досліджуваної сполуки, змішують з барвником, а потім візуально досліджують. Життєздатна клітина матиме прозору цитоплазму, тоді як нежиттєздатна клітина матиме блакитну цитоплазму. Кількість життєздатних і/або мертвих клітин на одиницю об'єму визначають за допомогою світлової мікроскопії за допомогою лічильної камери гемацитометра (рис. 1). Цей метод простий, недорогий і хороший показник цілісності мембрани, але помилки підрахунку (~ 10%) можуть виникати через погану дисперсію осередків або неправильного заповнення лічильної камери.
Аналіз NRU - це підхід, який оцінює клітинне поглинання барвника (нейтральний червоний) у присутності певної досліджуваної речовини (див. Наприклад, рис. 1 у Repetto et al., 2008). Цей тест заснований на здатності життєздатних клітин включати та зв'язувати нейтральний червоний колір у лізосомах, процес, заснований на універсальних структурах та функціях клітин (наприклад, цілісність клітинної мембрани, виробництво енергії та метаболізм, транспортування молекул, секреція молекул). Життєздатні клітини можуть займати нейтральний червоний за допомогою активного транспорту та включати барвник у свої лізосоми, тоді як нежиттєздатні клітини не можуть. Після промивання життєздатні клітини можуть вивільнити включений барвник в умовах підкислено-екстрагованих. Кількість виділеного барвника можна виміряти за допомогою спектрофотометрії.
У наш час стали популярними колориметричні аналізи для оцінки життєздатності клітин. Наприклад, МТТ-аналіз (3- (4,5-диметилтіазол-2-іл) -2,5-дифенілтетразолій бромід) перевіряє життєздатність клітин шляхом оцінки активності мітохондріальних ферментів. NAD (P) Н-залежні ферменти оксидоредуктази, які при певних умовах відображають кількість життєздатних клітин, здатні відновлювати жовтий барвник солі формазана в нерозчинний фіолетовий кристалічний продукт. Після солюбілізації кінцевого продукту з використанням диметилсульфоксиду (ДМСО) продукт можна кількісно виміряти за допомогою поглинання світла на певній довжині хвилі. Цей метод простий у використанні, безпечний і високовідтворюваний. Одним з недоліків є те, що МТТ формазан нерозчинний, тому ДМСО необхідний для солюбілізації кристалів.
2. Корозія шкіри і роздратування
Корозія шкіри відноситься до вироблення незворотних пошкоджень шкіри; а саме, видимий некроз (= локалізована загибель живих клітин, див. Розділ про загибель клітин) через епідерміс і в дерму, що відбувається після впливу речовини або суміші. Роздратування шкіри - менш важкий вплив, при якому спостерігається місцева запальна реакція на шкіру після впливу речовини або суміші. Прикладами цих речовин є миючі засоби та луги, які зазвичай впливають на руки.
Ідентифікація та класифікація подразнюючих речовин умовно досягається за допомогою спостереження за шкірою або очима in vivo. Традиційні випробування тварин використовували кроликів через тонку шкіру. У тесті Draize, наприклад, досліджувана речовина наноситься на очі або поголену шкіру кролика і покривається протягом 24 годин. Через 24 і 72 год очей або шкіру візуально оглядають і градуюють суб'єктивно на основі появи еритеми та набряку. Оскільки ці тести in vivo піддавалися сильній критиці, вони зараз припиняються на користь альтернатив in vitro.
Тест на корозію шкіри (SCT) та Тест на подразнення шкіри (SIT) - це аналізи in vitro, які можуть бути використані для виявлення того, чи має хімічна речовина потенціал корозії або подразнення шкіри. Спосіб використовує тривимірну (3D) модель шкіри людини (модель Епіскіна), яка складається з основного базального, надбазального, остистого та зернистого шарів та функціонального рогового шару (зовнішнього бар'єрного шару шкіри). Він передбачає місцеве застосування досліджуваної речовини і подальшу оцінку життєздатності клітин (МТТ-аналіз). Досліджувані сполуки, які вважаються корозійними або подразнюючими речовинами, ідентифікуються за їх здатністю знижувати життєздатність клітин нижче визначеного порогового рівня (летальна доза, при якій 50% клітин все ще життєздатні - ЛД 50).
3. Фототоксичність шкіри
Фототоксичність (фотоподразнення) визначається як токсична реакція, яка виникає після первинного впливу на шкіру певних хімічних речовин та подальшого впливу світла (наприклад, хімічних речовин, які поглинають видиму або ультрафіолетову (УФ) енергію світла, що викликає токсичні молекулярні зміни).
Аналіз 3T3 NRU PT заснований на увічненій клітинній лінії фібробластів миші під назвою BALB/c 3T3. Він порівнює цитотоксичність хімічної речовини за наявності або відсутності нецитотоксичної дози імітованого сонячного світла. Тест виражає залежне від концентрації зниження поглинання життєво важливого барвника нейтрального червоного кольору при вимірюванні через 24 години після обробки хімічним та світловим опроміненням. Опромінення може змінити поверхню клітин і, таким чином, може призвести до зниження поглинання та зв'язування нейтрального червоного кольору. Ці відмінності можна виміряти за допомогою спектрофотометра.
4. Сенсибілізація шкіри
Сенсибілізація шкіри - це регуляторна кінцева точка, спрямована на ідентифікацію хімічних речовин, здатних викликати алергічну реакцію у чутливих осіб. У минулому сенсибілізація шкіри була виявлена за допомогою морських свинок (наприклад, тест на максимізацію морської свинки та тести оклюзії Buehler) або мишей (наприклад, аналіз місцевих лімфатичних вузлів мишей). Остання заснована на кількісному визначенні проліферації Т-клітин в дренуючих лімфатичних вузлах за вухом (вушних) мишей після багаторазового місцевого застосування досліджуваної сполуки.
Ключові біологічні події (рис. 2), що лежать в основі процесу сенсибілізації шкіри, добре встановлені і включають:
- гаптенація, ковалентне зв'язування хімічних сполук (гаптенів) з білками шкіри (ключова подія 1);
- сигналізація, вивільнення прозапальних цитокінів і індукція цитопротекторних шляхів в кератиноцитах (ключова подія 2);
- дозрівання та мобілізація дендритних клітин, імунокомпетентних клітин шкіри (ключова подія 3);
- міграція дендритних клітин, переміщення дендритних клітин, що несуть гаптен-білкові комплекси, від шкіри до дренажу локального лімфатичного вузла;
- презентація антигену наївним Т-клітинам та проліферація (клональна експансія) гаптен-пептидних специфічних Т-клітин (ключова подія 4)
Малюнок в підготовці
Малюнок 2: Ключові біологічні події при сенсибілізації шкіри. Малюнок адаптований з ...
Сьогодні може бути використаний ряд нетваринних методів, що стосуються кожного конкретного ключового механізму індукційної фази сенсибілізації шкіри. До них відносяться прямий пептидний аналіз реактивності (DPRA), метод тесту на люциферазу ARE-NRF2: Кератинозенс, Тест активації лінії клітин людини (H-CLAT), тест активації клітинної лінії U937 (U-SENS) та аналіз генів інтерлейкіну-8 Reporter (IL-8 Luc аналіз). Детальну інформацію про ці методи можна знайти на сайті ОЕСР: сенсибілізація шкіри.
Посилання
Сайт Євро-LEX. https://eur-lex.europa.eu/legal-content/EN/ALL/?uri=CELEX:32010L0063
Сайт ОЕСР. Альтернативні методи тестування токсичності. https://ec.europa.eu/jrc/en/eurl/ecvam/alternative-methods-toxicity-testing
Модель Епіскіна. http://www.episkin.com/Episkin
Сайт ОЕСР. Сенсибілізація шкіри. https://ec.europa.eu/jrc/en/eurl/ecvam/alternative-methods-toxicity-testing/validated-test-methods/skin-sensitisation
Репетто, Г., Дель Песо, А., Зуріта, Дж. Л. Нейтральний аналіз поглинання червоного кольору для оцінки життєздатності клітини/цитотоксичності. Протоколи природи 3 (7), 1125.
4.3.9. Тестування токсичності людини - III. Канцерогенні аналізи
(Чернетка)
Автор: Ян-Пітер Плоем
Рецензенти: Френк ван Беллегем
Цілі навчання:
Ви повинні вміти
- пояснити різні підходи, що використовуються для тестування канцерогенів.
- перерахуйте деякі переваги і недоліки різних методів
- зрозуміти різницю між сполуками GTX та NGTX та її наслідки щодо тестування токсичності
Вступ
Термін «канцерогенність» відноситься до властивості речовини індукувати або збільшувати захворюваність на рак після інгаляції, прийому всередину, ін'єкцій або шкірного застосування.
Традиційно канцерогени класифікуються за способом їх дії (MoA). Сполуки, безпосередньо взаємодіючі з ДНК, що призводить до пошкодження ДНК або хромосомних аберацій, класифікуються як генотоксичні (GTX) канцерогени. Негенотоксичні (NGTX) сполуки безпосередньо не впливають на ДНК і, як вважають, впливають на експресію генів, трансдукцію сигналу, порушують клітинні структури та/або змінюють регуляцію клітинного циклу.
Різниця в механізмі дії між GTX і NGTX вимагає різного підходу у багатьох випадках.
Генотоксичні канцерогени
Генотоксичність сама по собі вважається кінцевою точкою. Виникнення ДНК-пошкодження можна спостерігати/визначити кинути легко різними методами, заснованими як на бактеріальних, так і на клітині ссавців. Часто багаторівневий метод тестування використовується для оцінки як спадкових пошкоджень лінії статевих клітин, так і канцерогенності.
В даний час було надано вісім аналізів in vitro керівних принципів ОЕСР, чотири з яких зазвичай використовуються.
- Тест Еймса
Золотим стандартом тестування генотоксичності є тест Еймса, тест, який був розроблений на початку сімдесятих років. Тест оцінює потенціал хімічної речовини для індукування мутацій (заміщення базової пари, індукція зсуву кадру, окислювальний стрес тощо) у Salmonella typhimurium. Під час процесу оцінки безпеки це перший тест, проведений, якщо він не буде визнаний непридатним з конкретних причин (наприклад, під час тестування на антибактеріальні речовини). При чутливості 70-90% є відносно хорошим предиктором генотоксичності.
Принцип роботи тесту досить простий. Штам бактерій, з генетичним дефектом, поміщається на мінімальне середовище, що містить розглянуту хімічну речовину. Якщо мутації індукуються, генетичний дефект у деяких клітині буде відновлений, тим самим надаючи клітинам можливість синтезувати дефіцитну амінокислоту, викликану дефектом вихідних клітин.
- Аналіз зворотної мутації кишкової палички
Аналіз Еймса - це в основному бактеріальний аналіз зворотної мутації. При цьому різні штами кишкової палички, які мають дефіцит як в ДНК-репарації, так і в амінокислоті, використовуються для ідентифікації генотоксичних хімічних речовин. Часто використовується комбінація різних штамів бактерій, щоб максимально підвищити чутливість.
- Аналіз аберації хромосом у ссавців in vitro
Хромосомні мутації можуть виникати як в соматичних клітині, так і в статевих клітині, що призводить до неоплазії або аномалій народження та розвитку відповідно. Існує два типи хромосомних мутацій:
Структурні зміни: стабільні аберації, такі як транслокації та інверсії, та нестабільні аберації, такі як розриви та розриви.
Числові зміни: анеуплоїдія (втрата або посилення хромосом) і поліплоїдія (кратні комплементу диплоїдної хромосоми).
Для проведення аналізу клітини ссавців піддаються in vitro потенційному канцерогену, а потім збирають. За допомогою мікроскопії визначається частота аберацій. Хромосомна аберація може бути і виконується як з гризунами, так і з клітинами людини, що є цікавим подвигом щодо поступальної сили аналізу.
- Тест на мутацію гена клітин ссавців in vitro
Цей аналіз генотоксичності ссавців використовує ген HPRT, ген-репортер, розташований Х-хромосомою. Тест спирається на те, що клітини з інтактним геном HPRT сприйнятливі до токсичного впливу 6-тіогуаніну, в той час як мутанти стійкі до цього пуринового аналогу. Клітини дикого типу чутливі до цитостатичної дії сполуки, тоді як мутанти зможуть розмножуватися в присутності 6-тіогуаніну.
- Тест на мікроядра
Поряд з чотирма згаданими аналізами є більш пізній розроблений тест, який вже виявився цінним ресурсом для тестування генотоксичності. Тест забезпечує альтернативу аналізу аберації хромосом, але його можна оцінити швидше. Тест дозволяє автоматизувати вимірювання, оскільки аналіз пошкоджень виявляється менш суб'єктивним. Мікроядра - це «вторинні» ядра, що утворюються в результаті анеугенного або кластогенного ураження.
Важливо зазначити, що всі ці аналізи описані з точки зору in vivo. Однак завжди можна використовувати підхід in vivo, див. Дворічний аналіз гризунів. У такому випадку живі тварини піддаються впливу з'єднання, після чого збирають конкретні клітини. Перевагою такого підходу є наявність природної ніші, в якій нормально ростуть чутливі клітини, що призводить до більш релевантного діапазону ефектів. Недоліком аналізів in vivo є нинішній етичний тиск на такі методи. Кілька екземплярів активно сприяють розробці та використанню альтернативних методів in vitro або просто нетваринних.
- Дворічний аналіз канцерогенності гризунів
Протягом понад 50 років 2-річний аналіз канцерогенності гризунів є золотим стандартом для тестування канцерогенності. Аналіз спирається на вплив сполуки протягом більшої частини життєдіяльності організму. Під час подальшого розвитку аналізу кращим методом стала установка 2 видів/2 статі, оскільки деякі сполуки показали різні результати, наприклад, у щурів та мишей і навіть між особинами чоловічої та жіночої статі.
Для такого підходу модельні організми піддаються протягом двох років з'єднанню. Залежно від можливого режиму впливу (тобто інгаляції, прийому всередину, шкіра/око/... контакту) при надходженні сполук у відповідну галузь вибирається конкретний режим впливу на модель. За цей часовий період здоров'я модельного організму документується за різними параметрами. На підставі цього робиться висновок щодо з'єднання.
Негенотоксичні канцерогени
Канцерогени, що не викликають прямого пошкодження ДНК, класифікуються як сполуки NGTX. Через те, що існує велика кількість потенційних злоякісних шляхів або ефектів, які можуть бути індуковані, ідентифікація канцерогенів NGTX значно складніше порівняно зі сполуками GTX.
Дворічний аналіз канцерогенності гризунів є одним із аналізів, здатних точно ідентифікувати сполуки NGTX. Використання трансгенних моделей значно підвищило чутливість та специфічність цього аналізу щодо обох груп канцерогенів, а також покращило уточнення аналізу шляхом скорочення необхідного часу для формування висновку щодо сполуки.
Метод in vitro для ідентифікації сполук NGTX зустрічається рідко. Не багато альтернативних аналізів здатні впоратися з великою різноманітністю можливих ефектів, викликаних сполуками, що призводять до багатьох помилкових негативів. Однак методи, засновані на морфології клітин, такі як аналіз трансформації клітин, можуть стати хорошим початком у розробці методів для цього типу канцерогенів.
Посилання
Стенлі Л. Молекулярна та клітинна токсикологія. стор. 434.
4.3.10. Епідеміологія навколишнього середовища - Основні принципи та проекти дослідження
Автори: Єва Сугенг та Лілі Фредрікс
Рецензенти: Любіца Мурінова та Раймонд Нєсінк
Цілі навчання:
Ви повинні вміти
- описувати та застосовувати визначення епідеміологічних досліджень.
- назвати та визначити проекти дослідження в епідеміології, описати дизайн, а також переваги та недоліки конструкції.
1. Визначення епідеміології
Епідеміологія (походить від давньогрецької: Epi -upon, demos - люди, логотипи - вивчення) - це вивчення розподілу та детермінант пов'язаних зі здоров'ям станів або подій у певних популяціях та застосування цього дослідження для профілактики та контроль проблем зі здоров'ям (Останній, 2001). Епідеміологи вивчають людські популяції за допомогою вимірювань в один або кілька моментів часу. Коли група людей стежить з часом, ми називаємо це когортою (походить від латинської: когори (латиниця), група римських солдатів). В епідеміології досліджується взаємозв'язок між детермінантом або фактором ризику та результатом здоров'я - змінною. Змінна результату здебільшого стосується захворюваності: захворювання, наприклад, раку легенів, або параметра здоров'я, наприклад, артеріального тиску або смертності: смерті. Детермінант визначається як колективний або індивідуальний фактор ризику (або сукупність факторів), який (причинно) пов'язаний зі станом здоров'я, результатом або іншою визначеною характеристикою. У здоров'ї людини - і, зокрема, при захворюваннях складної етіології - набори детермінант часто діють спільно в відносно складних і довгострокових процесах (Міжнародна епідеміологічна асоціація, 2014).
Люди, які є предметом інтересу, є цільовим населенням. У більшості випадків неможливо і непотрібно включати всіх людей з цільової групи населення і тому буде взята вибірка з цільової популяції, яка називається досліджуваної популяцією. Вибірка ідеально репрезентативна для цільової популяції (рис. 1). Щоб отримати репрезентативну вибірку, можна набирати суб'єктів навмання.
2. Вивчення конструкцій
Епідеміологічні дослідження можуть бути як спостережними, так і експериментальними (рис. 2). Спостережні дослідження не включають втручання (наприклад, виділення суб'єктів у експонутовані/неекспоновані групи), тоді як експериментальні дослідження роблять. Відносно спостережних досліджень можна виділити аналітичні та описові дослідження. Описові дослідження описують детермінант (и) та результат без порівняння, тоді як аналітичні дослідження порівнюють певні групи та виводять висновки.
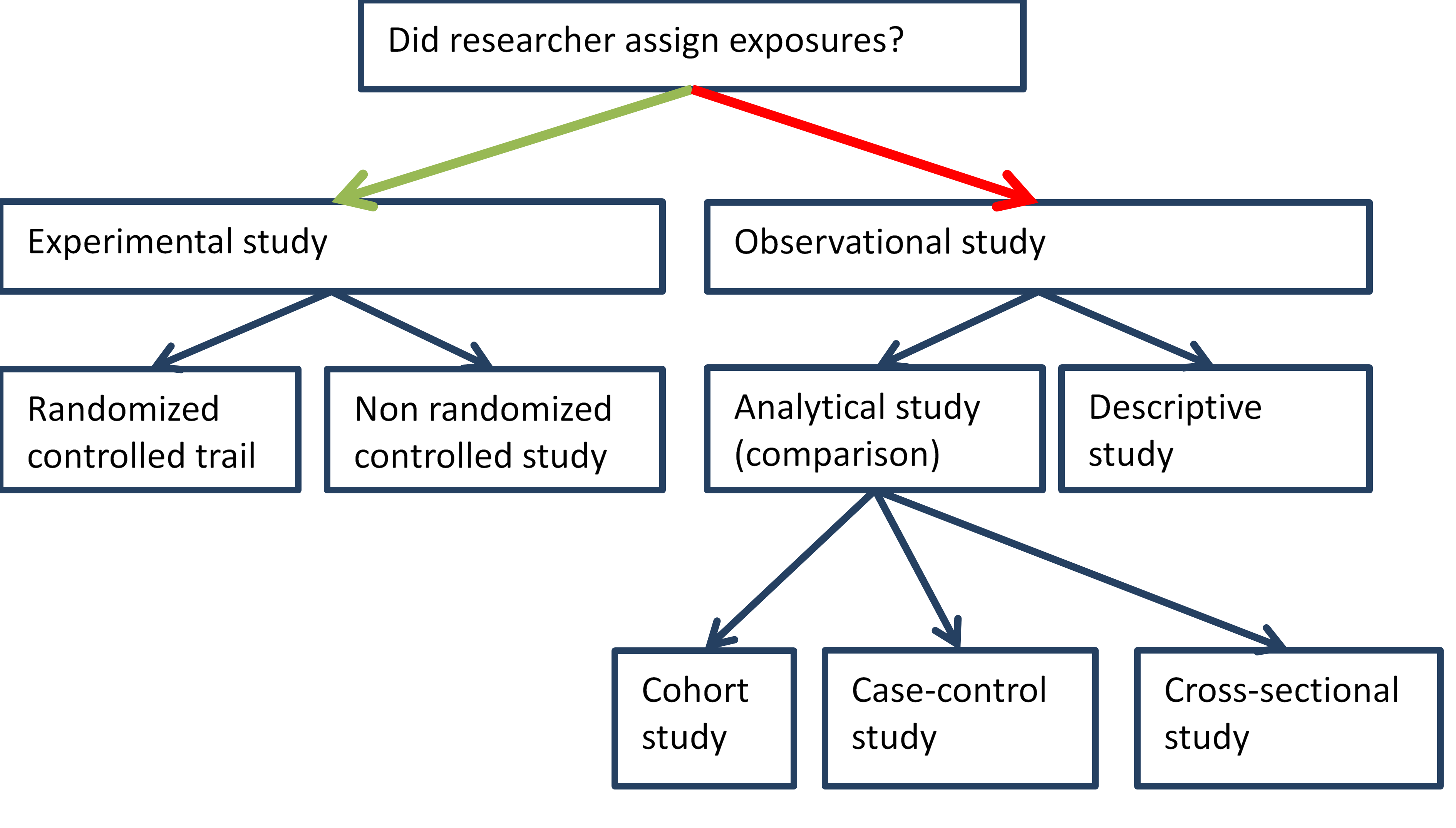
2.1 Спостережні дослідження
2.1.1. Дослідження поперечного перерізу
У дослідженні поперечного перерізу визначальний і результат вимірюються одночасно. Наприклад, рівень пестицидів у сечі (детермінант) та рівні гормонів у сироватці крові (результат) збираються в один момент часу. Конструкція швидка і дешева, оскільки всі виміри відбуваються одночасно. Недоліком є те, що конструкція не дозволяє зробити висновок про причинно-наслідковий зв'язок, тобто чи визначник передує результату, це може бути навпаки або викликано іншим фактором (відсутність критерію Хілла щодо причинності тимчасовості, Вставка 1). Таким чином, ця конструкція дослідження в основному генерує гіпотези.
2.1.2 Кейс-контрольне дослідження
У кейс-контрольному дослідженні вибірка відбирається виходячи з результату, в той час як детермінант вимірюється в минулому. На відміну від дослідження поперечного перерізу, ця конструкція може включати вимірювання в декількох точках часу, отже, це поздовжнє дослідження. По-перше, люди з хворобою (випадки) набираються, а потім відповідні контролі (люди, не постраждалі від захворювання), які можна порівняти, наприклад, за віком, статтю та географічним регіоном, беруть участь у дослідженні. Важливим є те, що контрольні органи мають такий же ризик розвитку захворювання, як і випадки. Детермінант збирається ретроспективно, тобто учасників запитують про експозицію в минулому.
Ретроспективний характер дизайну створює ризик для відкликання упередженості, коли людей запитують про події, що відбулися в минулому, вони можуть не запам'ятати їх правильно. Згадати зміщення - це форма інформаційного зміщення, коли похибка вимірювання призводить до неправильної класифікації. Упередженість визначається як систематичне відхилення результатів або висновків від істини (Міжнародна епідеміологічна асоціація, 2014). Слід бути обережними, щоб робити висновки про причинно-наслідковий зв'язок з конструкцією дослідження кейс-контролю. Відповідно до критерію тимчасовості Хілла (див. Вставка 1), експозиція передує результату, але оскільки експозиція збирається ретроспективно, докази можуть бути занадто слабкими, щоб зробити висновки про причинно-наслідковий зв'язок. Переваги полягають у тому, що конструкція підходить для досліджень захворювань з низькою частотою (у проспективному когортному дослідженні це призведе до низької кількості випадків), а також для досліджень захворювань з тривалим періодом затримки, тобто час, що вплив детермінанту може призвести до захворювання (у проспективному когортному дослідженні знадобиться багато років для спостереження за учасниками, поки хвороба не розвинеться).
Приклад кейс-контрольного дослідження в екологічній епідеміології
Hoffman et al. (2017) досліджували папілярний рак щитовидної залози (PTC) та вплив вогнезахисних хімічних речовин (FRS) у внутрішньому середовищі. FRS - це хімічні речовини, які додаються до побутових продуктів, щоб обмежити поширення вогню, але можуть вилуговувати домашній пил, де мешканці можуть піддаватися забрудненому домашньому пилу. ФРС пов'язані із захворюваннями щитовидної залози та раком щитовидної залози У цьому дослідженні кейс-контролю були набрані випадки PTC та відповідні випадки (результат), а вплив FR (детермінант) оцінювався шляхом вимірювання FRS в домашньому пилу учасників. Дослідження показало, що учасники з більш високим впливом ФР (концентрації бромдифенилового ефіру-209 вище медіанного рівня) мали на 2,3 більше шансів (див. Розділ Кількісна оцінка захворювань та асоціацій) на наявність ПТК, порівняно з учасниками з меншим впливом ФР (бромдифениловий ефір- 209 концентрацій нижче медіанного рівня).
2.1.3 Когортне дослідження
Когортне дослідження, інший тип поздовжнього дослідження, включає групу осіб, за якими слідують у часі в майбутньому (перспективні) або які будуть запитані про минуле (ретроспектива). У проспективному когортному дослідженні детермінант вимірюється на початку дослідження і обчислюється частота захворювання через певний часовий проміжок, подальше спостереження. Дизайн дослідження потрібно починати з людей, які знаходяться в групі ризику захворювання, але ще не уражені хворобою. Тому перспективний дизайн дослідження дозволяє зробити висновок, що може бути причинно-наслідковий зв'язок, оскільки результат здоров'я слідує визначнику в часі (критерій темпоральності Хілла). Однак втручання інших факторів все ще можливе, див. Пункт 3 про плутанину та модифікацію ефекту. Можна подивитися більш ніж на 1 результат здоров'я, але конструкція менш підходить для захворювань з низькою захворюваністю або з тривалим періодом затримки, тому що тоді вам або потрібна велика досліджувана популяція, щоб мати достатню кількість випадків, або потрібно стежити за учасниками протягом тривалого часу, щоб міряйте випадки. Основною проблемою цього дизайну дослідження є виснаження (втрата подальших дій), це означає, якою мірою учасники випадають під час навчального курсу. Ухил відбору може виникати, коли певний тип учасників випадає частіше, а дослідження проводяться з відбором цільової популяції. Ухил відбору може також відбуватися на початку дослідження, коли деякі члени цільової групи мають меншу ймовірність включення до досліджуваної популяції порівняно з іншими членами, і тому вибірка не є репрезентативною для цільової популяції.
Приклад перспективного когортного дослідження
De Cock et al. (2016) представляють перспективне когортне дослідження, що досліджує вплив хімічних речовин на раннє життя та наслідки для здоров'я в подальшому житті, Linking EDC у харчуванні матері до здоров'я дитини (дослідження LINC). Для цього під час вагітності було набрано понад 300 вагітних жінок. Пренатальний вплив хімічних речовин вимірювався, серед іншого, в пуповинній крові та грудному молоці, і діти стежили з часом, вимірюючи, серед іншого, стан росту та ваги. Наприклад, пренатальний вплив дихлордифенил-дихлоретилену (DDE), метаболіту пестициду дихлордифенил-трихлоретану (ДДТ), оцінювали шляхом вимірювання ДДЕ в пуповинній крові, зібраної при пологах. Протягом першого року проводився моніторинг індексу маси тіла (ІМТ), заснованого на вазі і зрості. Рівні ДДЕ в пуповинній крові були розділені на 4 рівні групи, звані квартилями. Хлопчики з найнижчими концентраціями DDE (перший квартиль) мали вищу криву зростання ІМТ у перший рік порівняно з хлопчиками з найвищими концентраціями DDE (четвертий квартиль) (De Cock et al., 2016).
2.1.4 Дослідження вкладеного кейс-контролю
Коли кейс-контрольне дослідження проводиться в рамках когортного дослідження, воно називається вкладеним кейс-контрольним дослідженням. Виділено випадки в когортному дослідженні, а відповідні нерегістрі вибираються як елементи управління. Цей тип дизайну дослідження корисний у разі низької кількості випадків у проспективному когортному дослідженні.
Приклад дослідження вкладеного кейс-контролю
Engel et al. (2018) досліджували синдром дефіциту уваги та гіперактивності (СДУГ) у дітей стосовно пренатального впливу фталатів. Фталати додають в різні споживчі товари для розм'якшення пластмас. Вплив відбувається під час прийому всередину, вдихання або всмоктування шкіри, а джерелами є, наприклад, пластикова упаковка продуктів харчування, летючі побутові товари та засоби особистої гігієни (Benjamin et al., 2017). Engel et al. (2018) провели дослідження вкладеного кейс-контролю в норвезькій когорті матері та дитини (MoBA). До складу когорти увійшли 112 762 пари мати-дитина, з яких лише мала кількість випадків з клінічним діагнозом СДУГ. Всього 297 випадків були випадковим чином відібрані з реєстрацій клінічно діагнозів СДУГ. Крім того, 553 елементи управління без СДУГ були випадковим чином вибрані з когорти. Метаболіти фталатів вимірювали в сечі матері, зібраної в середині вагітності, а концентрації поділялися на 5 рівних груп, званих квінтилами. Діти матерів у найвищому квінтилі суми метаболітів фталат-біс (2-етилгексил) фталату (DEHP) мали 2,99 (95% ДІ: 1,47-5,49) більше шансів (див. Розділ Кількісна оцінка захворювань та асоціацій) діагнозу СДУГ порівняно з найнижчим квінтилем.
2.2 Експериментальні дослідження
2.2.1 (Не) Рандомізовані контрольовані випробування
Рандомізоване контрольоване дослідження (RCT) - це експериментальне дослідження, в якому учасники випадковим чином призначаються до групи втручання або контрольної групи. Група втручання отримує втручання або лікування, контрольна група нічого не отримує, звичайний догляд або плацебо. Клінічні випробування, які перевіряють ефективність ліків, є прикладом РКТ. Якщо призначення учасників в групи не рандомізоване, конструкція називається нерандомізованим контрольованим дослідженням. Остання конструкція забезпечує меншу міцність доказів.
Коли групи людей замість окремих осіб рандомізовані, дизайн дослідження називається кластер-рандомізоване контрольоване дослідження. Це, наприклад, випадок, коли класи з дітьми в школі випадковим чином віднесені до групи втручання та контролю. Варіації використовуються для перемикання груп між інтервенційною та контрольною групою. Наприклад, конструкція кросовера робить можливим, що люди є як групою втручання, так і контрольною групою на різних етапах дослідження. Щоб не обмежувати переваги втручання контрольній групі, дизайн списку очікування робить втручання доступним для контрольної групи після періоду дослідження.
Приклад експериментального дослідження
Прикладом експериментального дизайну дослідження в рамках екологічних досліджень є дослідження Bae and Hong (2015). У рандомізованому кросовері учасники повинні були пити напої або з банки, що містить BPA, або скляну пляшку без BPA. Крім рівня BPA в сечі, артеріальний тиск вимірювали після впливу. Дизайн кросовера включав 3 періоди, коли вживали лише консервовані напої, як консервовані, так і скляні пляшки, або лише напої у скляних пляшках. Концентрація BPA була збільшена на 1600% після вживання консервованих напоїв порівняно з питтям зі скляних пляшок.
3. Плутаність і модифікація ефекту
Плутанина виникає, коли третій фактор впливає як на результат, так і на детермінант (див. Рис. Наприклад, кількість викурених сигарет позитивно пов'язане з поширеністю раку стравоходу. Однак кількість викурених сигарет також позитивно пов'язане з кількістю стандартних келихів споживання алкоголю. Крім того, споживання алкоголю є фактором ризику раку стравоходу. Тому споживання алкоголю є співзасновником у відносині куріння та раку стравоходу. У статистичному аналізі можна виправити плутанини, наприклад, використовуючи стратифікацію (результати представлені для різних груп окремо).
Модифікація ефекту відбувається, коли зв'язок між експозицією/детермінантом і результатом відрізняється для певних груп (рис. 3). Наприклад, ризик раку легенів через вплив азбесту приблизно в десять разів вище для курців, ніж для некурящих. Рішенням для боротьби з модифікацією ефекту є також стратифікація.
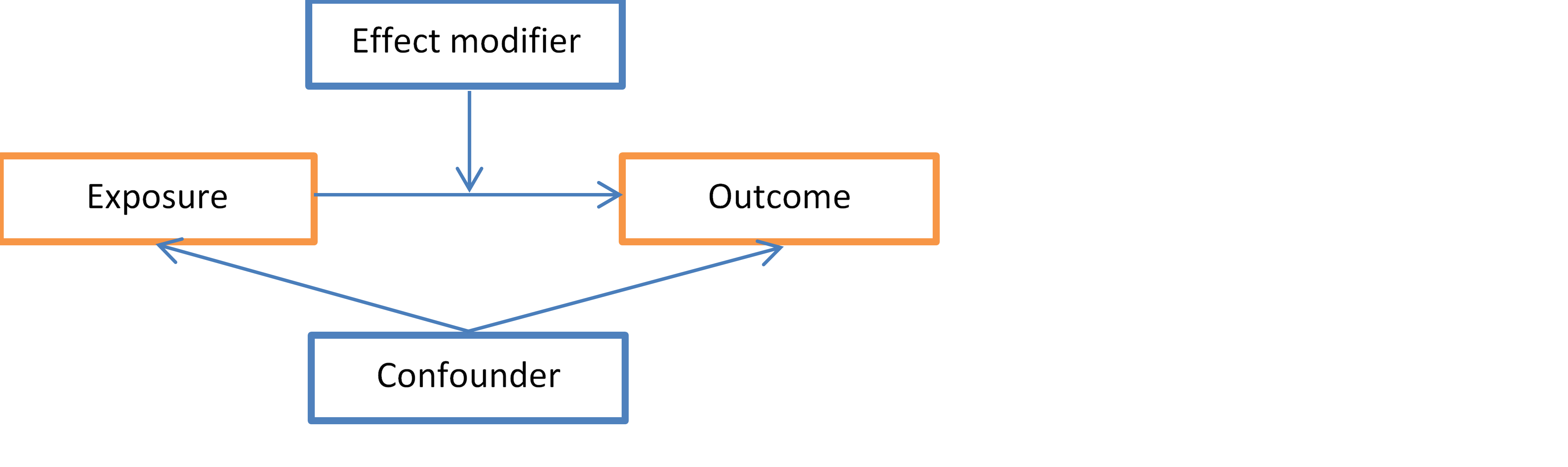
|
Вставка 1: Критерії Хілла для причинно-наслідкового зв'язку При епідеміологічних дослідженнях часто не вдається визначити причинно-наслідковий зв'язок. Ось чому епідеміологічні дослідження часто використовують набір критеріїв, критеріїв причинно-наслідкового зв'язку Хілла, за словами сера Остіна Бредфорда Хілла, які потрібно враховувати, перш ніж висновки про причинно-наслідковий зв'язок будуть виправдані (Hill, 1965).
|
Посилання
Бае С., Хонг Ю.К. Вплив бісфенолу а від вживання консервованих напоїв підвищує артеріальний тиск: Рандомізоване дослідження кросовера. Гіпертонія 65, 313-319. https://doi.org/10.1161/HYPERTENSIONAHA.114.04261
Бенджамін С., Масаї Е., Камімура Н., Такахасі, К., Андерсон, Р.К., Фейсал, П.А. (2017). Фталати впливають на здоров'я людини: епідеміологічні докази та правдоподібний механізм дії. J Журнал небезпечних матеріалів 340, 360-383. https://doi.org/10.1016/j.jhazmat.2017.06.036
Де Кок, М., Де Бур, М.Р., Ламорі, М., Леглер, Дж., Ван Де Бор, М. Пренатальний вплив ендокринних порушують хімічні речовини та вага при народженні - перспективне когортне дослідження. Журнал екологічної науки та здоров'я - Частина A Токсичні/небезпечні речовини та інженерія навколишнього середовища 51, 178-185. https://doi.org/10.1080/10934529.2015.1087753
Де Кок, М., Кваак, І., Сугенг, Е.Дж., Леглер, Дж., Ван Де Бор, М. (2016). Зв'язування EDC в материнському харчуванні з здоров'ям дитини (дослідження LINC) - Протокол для перспективної когорти для вивчення раннього життя впливу хімічних речовин навколишнього середовища та здоров'я дитини. BMC громадського здоров'я 16:147. https://doi.org/10.1186/s12889-016-2820-8
Енгель, С.М., Віллангер, Г.Д., Нетері, Р.К., Томсен, К., Сахі, А.К., Драйвер, С.С.М.,... Aase, H. (2018). Пренатальні фталати, функція щитовидної залози матері та ризик розладу гіперактивності дефіциту уваги у норвезькій когорті матері та дитини. Перспективи екологічного здоров'я. https://doi.org/10.1289/EHP2358
Хілл, А.Б. Навколишнє середовище та хвороби: асоціація чи причинно-наслідковий зв'язок? Журнал Королівського товариства медицини 58, 295-300. https://doi.org/10.1177/003591576505800503
Гофман, К., Лоренцо, А., Батт, К.М., Хаммель, С.К., Хендерсон, Б.Б., Роман, С.А.,... Соса, Ю.А. (2017). Вплив вогнезахисних хімічних речовин та виникнення та тяжкість папілярного раку щитовидної залози: дослідження кейс-контролю. Міжнародне довкілля 107, 235-242. https://doi.org/10.1016/j.envint.2017.06.021
Міжнародна епідеміологічна асоціація. Словник епідеміології. Преса Оксфордського університету. https://doi.org/10.1093/ije/15.2.277
Останній, Д.М. Словник епідеміології. 4-е видання, Оксфорд, Преса Оксфордського університету.
Дослідник А досліджує зв'язок між парабенами та раком молочної залози. Вона включає 200 жінок з раком молочної залози і 200 жінок без і запитує всіх жінок про використання засобів особистої гігієни, які містять парабени протягом останніх 10 років за допомогою анкети. Що таке дизайн дослідження, який використовується?
Кейс-контрольне дослідження
Дослідження поперечного перерізу
Перспективне когортне дослідження
Рандомізоване контрольоване дослідження
Дослідник Б має думку про переваги та недоліки дизайну дослідження, який був обраний. Яке з перерахованих нижче переваг даної конструкції є правильним?
Існує низький шанс відгадки-зміщення.
Конструкція здатна довести причинно-наслідковий зв'язок між викриттям і результатом.
Конструкція враховує тривалий період затримки при раку молочної залози.
Відносний ризик (RR) може бути використаний в цій конструкції.
Дослідник B бере участь у проспективному когортному дослідженні, що досліджує вплив свинцю та СДУГ у дітей. Пренатальний вплив свинцю вимірюється в пуповинній крові, зібраної при пологах. У 7 років були підраховані симптоми СДУГ. Вони виявили, що більш високі концентрації свинцю пов'язані з більшою кількістю симптомів СДУГ як для хлопчиків, так і для дівчаток. Хлопчики мали більше симптомів СДУГ, ніж у дівчаток, і вищий рівень свинцю. Що це за фактор статі?
Детермінант
співзасновник
Модифікатор ефекту
Результат
4.3.10. Екологічна епідеміологія - ІІ. Кількісна оцінка захворювань та асоціацій
Автори: Єва Сугенг та Лілі Фредрікс
Рецензенти: Любіца Мурінова та Раймонд Нєсінк
Цілі навчання
Ви повинні вміти
- описати заходи захворювання.
- обчислювати та інтерпретувати розміри ефектів, що відповідають дизайну епідеміологічного дослідження.
- описувати і інтерпретувати рівень значущості.
- описувати стратифікацію і інтерпретувати стратифіковані дані.
1. заходи захворювання
Поширеність - це частка населення з результатом у певний момент часу (наприклад, в даний час 40% населення страждає хворобою Y) і може бути розрахована в перехресних дослідженнях.
Захворюваність стосується лише нових випадків, а сукупна захворюваність - це частка нових випадків у населення протягом певного періоду часу (наприклад, 60% нових випадків грипу на рік). (кумулятивну) захворюваність можна розрахувати лише в проектах перспективних досліджень, оскільки населення повинно бути під загрозою розвитку захворювання, і тому учасники не повинні бути уражені хворобою на початку дослідження.
Популяційний атрибутивний ризик (PAR) - це міра для вираження збільшення захворювань у популяції через вплив. Він розраховується за такою формулою:
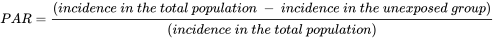
2. розміри ефектів
2.1 У разі дихотомічних результатів (хвороба, так проти ні)
Коефіцієнт ризику або відносний ризик (RR) - це відношення захворюваності в групі, що піддається впливу, до захворюваності в неопроміненій групі (табл. 1):
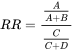
RR може використовуватися лише в перспективних конструкціях, оскільки він складається з ймовірностей результату в групі ризику. RR дорівнює 1, якщо немає ризику, 1, <1 if there is a decreased risk, and > якщо є підвищений ризик. Наприклад, дослідники знаходять RR 0,8 в гіпотетичному проспективному когортному дослідженні щодо регіону, в якому живуть діти (сільські та міські) та розвиток астми (результат). Це означає, що діти, які проживають у сільській місцевості, мають на 0,8 менший ризик розвитку астми порівняно з дітьми, які проживають у міських районах.
Різниця ризиків (РД) - це різниця між ризиками в двох групах (табл. 1):
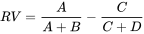
Коефіцієнт коефіцієнта (OR) - відношення коефіцієнтів на результат у виставленій групі до коефіцієнтів результату в неекспонованій групі (Таблиця 1).
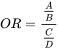
OR може бути використаний в будь-якому дизайні дослідження, але найбільш часто використовується в кейс-контрольних дослідженнях. (Таблиця 1) АБО дорівнює 1, якщо немає різниці в коефіцієнтах, > 1, якщо є більш високі коефіцієнти, і <1, якщо коефіцієнт менший. Наприклад, дослідники знаходять АБО 2.5 в гіпотетичному контрольному дослідженні щодо раку мезотеліоми та професійного впливу азбесту в минулому. Пацієнти з мезотеліомою рак мали 2.5 вищі шанси бути професійними в минулому піддавалися азбесту в порівнянні зі здоровим контролем.
OR також може використовуватися з точки зору шансів на хворобу замість впливу, тоді формули (Таблиця 1):
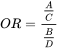
Наприклад, дослідники знаходять коефіцієнт шансів 0,9 в поперечному дослідженні, що досліджує рак мезотеліоми у будівельників, що працюють з азбестом, порівнюючи використання захисного одягу та масок. Будівельники, які використовували захисний одяг та маски, мали 0.9 шансів на рак мезотеліоми в порівнянні з будівельниками, які не використовували захисний одяг та маски.
Таблиця 1: концептуальна таблиця, яку слід використовувати для розрахунку RR, RD та OR
|
Захворювання/результат + |
Захворювання/результат - |
|
|
Експозиція/детермінант + |
A |
Б |
|
Експозиція/детермінант - |
C |
D |
2.2 У разі безперервних результатів (коли є шкала, за якою можна виміряти захворювання, наприклад, артеріальний тиск)
Середня різниця - це різниця між середнім значенням в експонованій групі від неекспонованої групи. Це також застосовується до експериментальних конструкцій з подальшим контролем для оцінки збільшення або зменшення результату після втручання: середнє значення на базовій лінії проти середнього значення після втручання. Це можна стандартизувати за допомогою наступних формул:
Стандартне відхилення (SD) - це міра розкиду набору значень. На практиці СД слід оцінювати або з SD контрольної групи, або з «загального» значення обох груп. Найвідомішим показником розміру ефекту є Cohens 'd'. Стандартизована середня різниця може мати як негативне, так і позитивне значення (між -2,0 і +2,0). При позитивному значенні показаний сприятливий ефект від втручання, при негативному - ефект контрпродуктивний. Загалом, розмір ефекту, наприклад, 0,8 означає великий ефект.
3. Статистична значимість і довірчий інтервал
Вимірювання ефекту, такі як відносний ризик, коефіцієнт шансів та середня різниця, повідомляються разом із статистичною значимістю та/або довірчим інтервалом. Статистична значущість використовується для збереження або відхилення нульової гіпотези. Дослідження починається з припущення нульової гіпотези, ми припускаємо, що немає різниці між змінними або групами, наприклад RR = 1 або різниця в середніх значеннях дорівнює 0. Тоді статистичний тест дає нам ймовірність отримання спостережуваного результату (наприклад, OR=2.3, або середня різниця = 1.5), коли насправді нульова гіпотеза істинна. Якщо ймовірність менше 5%, ми робимо висновок, що спостереження вірне і можемо відхилити нульову гіпотезу. Імовірність 5% відповідає p-значенню 0,05. Зазвичай використовується відсічення p-значення p<0,05, що означає, що p-значення менше 0,05 вважаються статистично значущими.
Довірчий інтервал 95%. Довірчий інтервал 95% - це діапазон значень, в межах якого ви можете бути на 95% впевнені, що справжнє середнє значення населення або міра асоціації лежить. Наприклад, в гіпотетичному дослідженні поперечного перерізу щодо куріння (так чи ні) та раку легенів було виявлено АБО 2,5, з 95% ДІ від 1,1 до 3,5. Це означає, що ми можемо з 95% впевненістю сказати, що справжнє АБО лежить між 1.1 і 3.5. Це вважається статистично значущим, оскільки 1, що означає відсутність різниці в коефіцієнтах, не лежить в межах 95% CI. Якщо дослідники також вивчали рак стравоходу по відношенню до куріння і виявили АБО 1,9 з 95% КІ 0,6-2,6, це не вважається статистично значущим, оскільки 95% КІ включає 1.
4. стратифікація
Коли дві досліджувані популяції мають різний розподіл, наприклад, віку та статі, часто важко порівняти частоту захворювань серед них. Один із способів боротьби з цим полягає в аналізі зв'язків між впливом та результатом у шарах (групах). Це називається стратифікацією. Приклад: гіпотетичне дослідження для дослідження відмінностей у здоров'ї (результат, вимірюваний кількістю симптомів, таких як задишка під час ходьби) між двома групами похилого віку, міського похилого віку (n = 682) та сільського похилого віку (n = 143) (детермінант). Різниці між міським та сільським літнім віком не виявлено, проте різниця у кількості жінок та чоловіків в обох групах була різниця. Тому результати симптомів для міського та сільського похилого віку розшаровані за статтю (табл. 2). Тоді виявилося, що чоловіки міського похилого віку мають більше симптомів, ніж чоловіки сільського похилого віку (p=0,01). Різниця не є значною для жінок (p=0,07). Відмінності у здоров'ї людей похилого віку, які проживають у міському регіоні, різні для чоловіків та жінок, отже стать є модифікатором ефекту нашої асоціації інтересів.
Таблиця 2. Кількість симптомів (виражених у відсотках) для міського та сільського похилого віку, стратифікованих за статтю. Істотні відмінності жирним шрифтом.
|
кількість симптомів |
Жінкам |
Чоловікам |
||
|
Міський |
Сільська |
Міський |
Сільська |
|
|
Жоден |
16.0 |
30.4 |
16.2 |
43.5 |
|
Один |
26.4 |
30.4 |
45.2 |
47.8 |
|
Два або більше |
57.6 |
39.1 |
37.8 |
8.7 |
|
П |
125 |
23 |
74 |
23 |
|
p-значення |
0,07 |
0,01 |
||
Дослідник Б досліджує зв'язок між парабенами та раком молочної залози за допомогою конструкції поперечного перерізу. Вона включає 500 жінок віком від 55 до 65 років і запитує їх про використання засобів особистої гігієни, які містять парабени, за допомогою анкети, що розділяє групу на частих користувачів (N = 267) та нечастих користувачів (N = 233). Крім того, вона запитує, чи є у жінок діагноз раку молочної залози, і з'ясовує, що у 41 жінки рак молочної залози, з цих жінок 30 часто використовують ПХФ. Який правильний результат цього дослідження?
Коефіцієнт коефіцієнта становить 3,6.
Ризик, що віднесений до населення, становить 0,4.
Захворюваність на рак молочної залози у цій популяції становить 8,2%
Поширеність раку молочної залози у цієї популяції становить 8,2%.
За допомогою статистичного аналізу для отримання АБО дослідник А знаходить такі числа: OR=2.6, 95CI: 0,9-3,5, p=0.07. Що таке тлумачення?
Часті користувачі PCP мають значно вищі шанси на рак молочної залози.
Часті користувачі PCP мають вищі шанси на рак молочної залози, але не значно.
Часті користувачі ПХФ мають більший ризик раку молочної залози, але не значно
Часті користувачі PCP мають значно більший ризик раку молочної залози
Дослідники досліджують втручання для зменшення впливу фталатів. Група втручання отримує поради щодо зменшення фталатів у продуктах харчування, засобах особистої гігієни та летких побутових продуктах. Контрольна група не отримує втручання. До і після періоду втручання зразки сечі від учасників збирають і аналізують на фталатні метаболіти. Що невірно?
Дослідники можуть зробити висновок про причинно-наслідковий зв'язок, оскільки експозиція протікає результатом.
Дослідники можуть кількісно оцінити розмір різниці між інтервенцією та контрольною групою за допомогою стратифікації.
Дослідники можуть показати, чи зменшує втручання (або збільшує) вплив з різницею ризику.
Те, що немає різниці між втручанням і контрольною групою, називається нульовою гіпотезою.
4.3.11. Молекулярна епідеміологія - Біомоніторинг людини
Автор: Марія Ламорі
Рецензенти: Мішель Плюскін та Адріан Коваці
Цілі навчання:
Ви повинні вміти
- пояснити мету біомоніторингу людини
- розуміти, що внутрішня доза може надходити з різних шляхів впливу
- описати різні етапи аналітичних методів та уточнити конкретні вимоги щодо відбору проб, зберігання, чутливості, пропускної здатності та точності
- уточнити роль метаболізму в розподілі проб в організмі людини і вказати деякі матриці зразків
- пояснити роль етики в дослідженнях біомоніторингу людини
Ключові слова: хімічний аналіз, зразки людини, експозиція, етика, когорта
Біомоніторинг людини
Біомоніторинг людини (ГБМ) передбачає оцінку впливу на людину природних і синтетичних хімічних речовин шляхом кількісного аналізу цих сполук, їх метаболітів або продуктів реакції в зразках людського походження. Зразки, що використовуються в HBM, можуть включати кров, сечу, обличчя, слину, грудне молоко та піт або інші тканини, такі як волосся, нігті та зуби.
Концентрації, визначені в зразках людини, є відображенням впливу індивіда аналізованих сполук, які також називають внутрішньою дозою. Дані ГБМ збираються для отримання уявлення про вплив населення хімічними речовинами, часто з метою інтеграції їх з даними про здоров'я для оцінки впливу на здоров'я в епідеміологічних дослідженнях. Нерідко розглядаються конкретні вікові групи, такі як новонароджені, малюки, діти, підлітки, дорослі і люди похилого віку. Біомоніторинг людини є усталеним методом оцінки професійного та екологічного впливу.
У кількох країнах дослідження HBM проводяться вже десятиліттями, такі як Німецьке дослідження навколишнього середовища (GERES) та Національне обстеження здоров'я та харчування (NHANES) у США. Програми HBM іноді можуть проводитися під егідою Всесвітньої організації охорони здоров'я (ВООЗ). Іншими прикладами є Канадське опитування щодо заходів охорони здоров'я, Фламандське дослідження навколишнього середовища та охорони здоров'я та Японське дослідження навколишнього середовища та дітей, останнє спеціально зосереджено на маленьких дітей. Діти вважаються більш схильними до ризику несприятливих наслідків для здоров'я від раннього впливу хімічних забруднювачів через їх швидке зростання та розвиток та їх обмежену метаболічну здатність детоксикувати шкідливі хімічні речовини.
Таблиця 1. Джерела інформації для програм біомоніторингу людини (HBM)
|
Програма |
Інтернет посилання |
|
Німецьке дослідження навколишнього середовища (GerES) |
www.umweltbundesamt.de/uk/topics/здоров'я/оцінка-екологічно-пов'язані ризики для здоров'я/німецько-екологічне обстеження-geres |
|
Національне обстеження здоров'я та харчування (NHANES) |
|
|
ХТО |
www.euro.who.int/uk/data-and-provice/навколишнє середовище та здоров'я-інформаційна система-enhi/діяльність/людина-біомонітор-опитування |
|
Канадське опитування щодо заходів охорони здоров'я (CHMS) |
|
|
Навколишнє середовище та вивчення дітей Японії (JECS) |
Дослідження, орієнтовані на вплив впливу хімічних речовин на здоров'я, проводяться з використанням когорт: груп людей, які зараховані на певне дослідження і добровільно беруть участь в дослідницькій програмі. Зазвичай, крім здачі, наприклад, зразків крові або сечі, збираються заходи щодо охорони здоров'я, такі як артеріальний тиск, маса тіла, рівень гормонів тощо, але також дані про дієту, освіту, соціальний фон, економічний стан та спосіб життя, останні за допомогою анкет. Поперечне дослідження спрямоване на отримання даних про вплив і здоров'я всієї (волонтерської) групи в певний момент, тоді як в поздовжньому дослідженні подальші дослідження проводяться з певною частотою (тобто кожні кілька років) з метою відстеження та оцінки змін експозиції, описати час тенденції, а також вивчення здоров'я та способу життя в довгостроковій перспективі (див. Розділ екологічної епідеміології). Щоб отримати достатню статистичну потужність для отримання значущих взаємозв'язків між впливом та можливими (здоров'ям) ефектами, кількість учасників досліджень HBM часто дуже велика, тобто становить 100 000 учасників.
Оскільки багато (іноді конфіденційних) даних збирається від багатьох людей, етика є важливим аспектом будь-якого дослідження HBM. Перш ніж почати певне дослідження за участю HBM, Комітет з затвердження медичної етики повинен затвердити його. Заявки на отримання схвалення вимагають вичерпної документації i) протоколу дослідження (що саме досліджується), ii) заява щодо захисту конфіденційності та зібраних даних осіб, доступу дослідників до даних та безпечного зберігання всієї інформації та iii ) інформаційний лист для волонтерів з поясненням мети та процедур, що використовуються в дослідженні, та їх прав (наприклад, відкликати), щоб вони могли дати згоду на включення до дослідження.
Хімічна абсорбція, розподіл, обмін речовин і виведення
Оскільки хімічні речовини часто піддаються метаболічній трансформації (див. Розділ про метаболізм та захист ксенобіотиків) після потрапляння в організм через прийом всередину, шкірне всмоктування та вдихання, важливо не тільки зосередитись на батьківській сполуці (= сполуці, якій людина піддавалася), але і включають метаболіти. Дієта, соціально-економічний статус, професія, спосіб життя та навколишнє середовище сприяють впливу на людину, тоді як вік, стать, стан здоров'я та вага людини визначають ефект впливу. Дані HBM забезпечують агрегацію всіх різних маршрутів, через які людина була виставлена. Однак для поглибленого дослідження джерел впливу хімічний аналіз, наприклад, дієти (включаючи питну воду), внутрішнього та зовнішнього середовища все ще необхідний. Ще одним важливим джерелом хімічних речовин, яким люди піддаються у повсякденному житті, є споживчі товари, такі як електроніка, меблі, текстиль тощо, які можуть містити антипірени, засоби від плям, барвники та барвники, консерванти, серед інших.
Розподіл хімічної речовини в організмі сильно залежить від його фізико-хімічних властивостей, таких як ліпофільні/гідрофільність та стійкість, а також перетворення фази I та фази II (див. Розділ про метаболізм та захист ксенобіотиків) відіграють визначальну роль, див. Рис. 1. Для ліпофільних сполук (наприклад, розділ на СОЗ) зберігання відбувається в жировій тканині, тоді як помірно ліпофільні до гідрофільні сполуки виводяться після метаболічної трансформації або в незміненому вигляді. Виходячи з цих міркувань, можна зробити правильний вибір для забору відповідної матриці, тобто деякі хімічні речовини найкраще вимірювати в сечі, тоді як для інших кров може бути краще підходить.
Для проектування кампанії відбору проб слід враховувати властивості сполук, що підлягають аналізу. У разі летючості слід використовувати герметичні контейнери для відбору проб, тоді як для світлочутливих складів є скляний посуд бурштинового кольору.
В ідеалі після збору зразки повинні зберігатися в правильних умовах якомога швидше, щоб уникнути деградації, спричиненої термічною нестабільністю або біодеградацією, спричиненою залишковою активністю ферментів у зразку (наприклад, у зразках крові або грудного молока). Маркування та зберігання великої кількості зразків, які зазвичай включаються в дослідження ГБМ, є важливими частинами кампанії відбору проб (див. Відео: https://www.youtube.com/watch?v=FQjKKvAhhjM).
Хімічний аналіз зразків людини для оцінки впливу
Зазвичай для визначення концентрацій сполук, яким піддаються люди, і відповідних метаболітів, що утворюються в організмі людини, застосовуються такі аналітичні методи, як рідинна і газова хроматографія (LC і GC відповідно), з'єднані з мас-спектрометрією (МС). Хроматографія використовується для поділу сполук, в той час як МС використовується для виявлення сполук. Перед аналізом за допомогою LC- або GC-MS зразок попередньо обробляється (наприклад, частинки видаляються) і витягується, тобто сполуки, що підлягають аналізу, концентруються в невеликому обсязі, тоді як складові матриці зразка, які можуть перешкоджати аналізу (наприклад, ліпіди, білки) видаляються, в результаті чого екстракт який готовий до введення на хроматографічну систему.
На малюнку 2 наведено схематичне зображення всіх етапів аналітичної процедури.
Аналітичні методи кількісного визначення концентрацій хімічних речовин з метою оцінки впливу на людину повинні бути якісними через специфіку досліджень ГБМ. З'єднання, що підлягають аналізу, зазвичай присутні в дуже низьких концентраціях (тобто в порядку пг/л для пуповинної крові), а обсяги вибірки невеликі. Для деяких матриць малі обсяги вибірки диктуються тим, що доступність зразків не є необмеженою, наприклад, для крові. Іншим фактором, який регулює обмежений обсяг зразка, є витрати, пов'язані з вимогою виділеного тривалого простору для зберігання в умовах -20 ⁰C або навіть -80 ⁰C для забезпечення цілісності та стабільності зразка.
Сполуки, на яких часто зосереджуються дослідження HBM, - це ті, яким ми піддаємося в повсякденному житті. Це означає, що аналітична процедура повинна мати можливість боротися із забрудненням зразка сполуками, що підлягають аналізу, через наявність сполук у нашому оточенні. Більш високе фонове забруднення призводить до зниження здатності виявляти низькі концентрації, тим самим негативно впливаючи на якість досліджень. Прикладами сполук, які часто контролювалися в сечі людини, є фталати, такі як діетилгексилфталат або коротко DEHP. DEHP - хімічна речовина, яка використовується в багатьох споживчих товарах, і тому забруднення зразків DEHP з навколишнього середовища сильно впливає на аналітичні вимірювання. Один із способів обійти це - зосередитись на метаболітах DEHP після метаболізму I або II фази: це гарантує, що хімічна речовина пройшла людський організм і зазнала метаболічної трансформації, і його виявлення не відбувається через забруднення з фону, що призводить до більш надійної метрики експозиції. Коли аналітичний метод призначений для кількісного аналізу метаболітів, слід включити ферментативну стадію декон'югації метаболітів II фази (див. Розділ про метаболізм та захист ксенобіотиків).
Оскільки отримані дані, тобто концентрації сполук у зразках людини, використовуються для визначення таких параметрів, як середній/середній рівень експозиції, частота виявлення конкретних сполук та найвищий/найнижчий рівень експозиції, точність вимірювань повинна бути високою. Крім того, аналітичні методи, що використовуються для ГБМ, повинні бути здатні до високої пропускної здатності, тобто час, необхідний для аналізу, повинен бути низьким, через велику кількість зразків, які зазвичай аналізуються, в порядку від ста до декількох тисяч зразків, залежно від дослідження.
Підсумовуючи, дані HBM підтримують оцінку часових тенденцій та просторових закономірностей впливу на людину, проливають світло на субпопуляції, які піддаються ризику, і дають уявлення про ефективність заходів щодо зменшення або навіть запобігання несприятливих наслідків для здоров'я внаслідок хімічного впливу.
Довідкова інформація:
Інформація про проект HBM4EU: www.hbm4eu.eu; відео: https://www.youtube.com/watch?v=DmC1v6EAeAM&feature=youtu.be.
Намалюйте схему типової аналітичної процедури кількісного визначення концентрації сполуки в певній пробі і назвіть різні етапи.
Які цілі біомоніторингу людини?
Чому корисно зосереджувати HBM на метаболітах хімічних речовин, а не на оригінальній хімічній речовині, що стосується, наприклад, фталатів?
Згадайте 5 факторів, пов'язаних з хімічним аналізом в ГБМ, і поясніть їх важливість
Схвалення етики від Комітету з затвердження медичної етики є обов'язковим для проведення дослідження HBM. Вкажіть, який тип інформації повинен бути включений в досьє, щоб отримати схвалення.
4.3.11. Молекулярна епідеміологія - II. Експосоми та внутрішні молекулярні маркери
(чернетка)
Автори: Карен Врієнс та Мішель Плюскін
Рецензенти: Френк Ван Беллегхем,
Цілі навчання
Ви повинні вміти
- пояснити поняття експосоми, включаючи її різні експозиції
- зрозуміти застосування моделі зустрічі в середині в молекулярно-епідеміологічних дослідженнях
- опишіть, як різні молекулярні маркери, такі як експресія генів, епігенетика та метаболоміка, можуть представляти чутливість до певного впливу навколишнього середовища
Експосома
Ідея експозиції була описана Крістофером Уайлдом у 2005 році як міра всіх життєвих впливів людини, включаючи процес того, як ці впливи пов'язані зі здоров'ям. Важливою метою експосоми є пояснення того, як негенетичні впливу сприяють виникненню або розвитку важливого хронічного захворювання. Це поняття являє собою сукупність експозицій з трьох широких областей, тобто внутрішньої, специфічної зовнішньої та загальної зовнішньої (рис. 1) (Wild, 2012). Внутрішня експосома включає такі процеси, як метаболізм, ендогенні циркулюючі гормони, морфологія тіла, фізична активність, мікробіота кишечника, запалення та старіння. Специфічні зовнішні впливи включають різноманітні агенти, наприклад, радіацію, інфекції, хімічні забруднювачі та забруднюючі речовини, дієту, фактори способу життя (наприклад, тютюн, алкоголь) та медичні втручання. Більш широкі соціальні, економічні та психологічні впливи на особистості складають загальну зовнішню експозицію, включаючи наступні фактори, але не обмежуючись соціальним капіталом, освітою, фінансовим станом, психологічним стресом, місько-сільським середовищем, кліматом тощо 1.
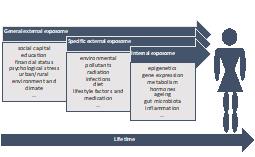
Концепція експосоми чітко ілюструє складність навколишнього середовища, якому люди піддаються сьогодні, і як це може вплинути на здоров'я людини. Існує потреба у внутрішніх біомаркерах експозиції (див. Розділ Біомоніторинг людини), а також біомаркерів ефекту, щоб розплутати складну взаємодію між кількома експозиціями, що виникають потенційно одночасно і в різних концентраціях протягом усього життя. Досягнення в галузі біомедичних наук та молекулярної біології, тим самим збираючи цілісну інформацію про епігенетику, транскриптом (див. Розділ про експресію генів), метаболому (див. Розділ про Метаболоміка) тощо знаходяться на передньому краї для виявлення біомаркерів експозиції, а також ефекту.
Внутрішні молекулярні маркери експосоми
Знайомтеся в середині моделі
Щоб визначити вплив на здоров'я від впливу навколишнього середовища, маркери, які можуть виявити ранні зміни до виникнення захворювання, є важливими і можуть бути впроваджені в профілактичній медицині. Ці типи маркерів можна розглядати як проміжні біомаркери ефекту, і їх відкриття спирається на масштабні дослідження на різних рівнях біології (транскриптоміка, геноміка, метаболоміка). Термін «оміка» відноситься до кількісного вимірювання глобальних наборів молекул у біологічних зразках з використанням методів високої пропускної здатності (тобто автоматизованих експериментів, що дозволяють повторення великих масштабів) 7, у поєднанні з передовими біостатистичними та біоінформатичними інструментами 8. Враховуючи доступність даних з високопродуктивних омічних платформ, а також надійні вимірювання зовнішніх впливів, використання оміки посилює пошук маркерів, які відіграють певну роль у біологічному шляху, що пов'язує вплив з ризиком захворювання.
Концепція зустрічі в середині (MITM) була запропонована як спосіб вирішення проблеми виявлення причинно-наслідкових зв'язків, що пов'язують вплив та результат захворювання (рис. 2). Перший крок такого підходу полягає у дослідженні зв'язку між експозицією та біомаркерами експозиції. Наступний етап полягає у вивченні взаємозв'язку між (біомаркерами) експозиції та проміжними біомаркерами оміки ранніх ефектів; по-третє, оцінюється зв'язок між результатом захворювання та проміжними біомаркерами оміки. MITM передбачає, що причинний характер асоціації посилюється, якщо вона виявляється у всіх трьох етапах. Молекулярні маркери, які вказують на сприйнятливість до певних впливів навколишнього середовища, починають розкриватися і можуть допомогти в цілеспрямованих стратегіях профілактики. Тому такий підхід сильно залежить від нових розробок в молекулярній епідеміології, в яких молекулярна біологія зливається в епідеміологічні дослідження. Нижче детально розглядаються різні рівні молекулярної біології, що вивчаються в даний час для виявлення маркерів впливу та ефекту.
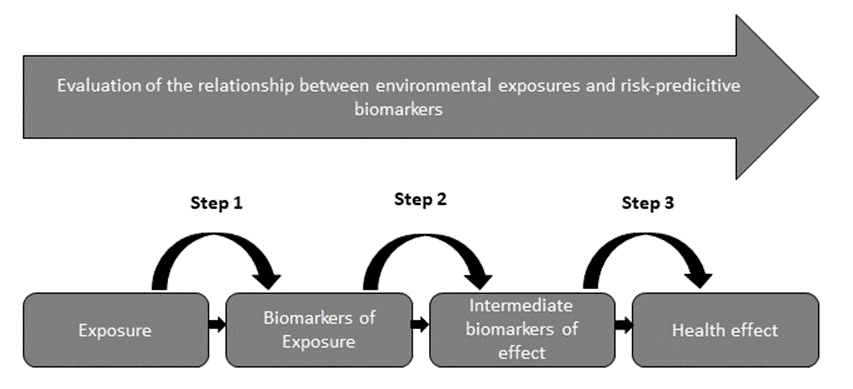
Рівні
Проміжні біомаркери можуть бути ідентифіковані як вимірювані показники певних біологічних станів на різних рівнях клітинного апарату, а також варіюватися за часом реагування, тривалістю, місцем і механізмом дії. Залежно від досліджуваної експозиції можуть бути кращими різні молекулярні маркери.
Експресія генів
Зміни на рівні мРНК можуть бути вивчені після кандидатського підходу, при якому мРНК з біологічною роллю, підозрюваною на участь у молекулярній відповіді на певний тип впливу (наприклад, запальні мРНК у випадку впливу тютюнового диму) вибираються апріорі та вимірюються за допомогою кількісна технологія ПЛР або альтернативно на рівні всього генома за допомогою мікромасиву аналізу або технології секвенування наступного покоління. 10 Зміни на рівні транскриптома вивчаються шляхом аналізу сукупності молекул РНК, присутніх у клітинному типі або зразку.
Обидва типи досліджень довели свою корисність в молекулярній епідеміології. Близько десяти років тому було опубліковано перше дослідження, яке повідомляє про профілі експресії генів-кандидатів, які були пов'язані з впливом різних канцерогенів 11. Приблизно в той же час були опубліковані перші дослідження транскриптоміки, включаючи транскриптомічні профілі для населення, що піддається діоксину 12, у зв'язку з впливом дизельних вихлопних газів, 13 та порівняння курців проти некурящих як у крові 14, так і в дихальних шляхах клітини епітелію 15. Зовсім недавно увага була зосереджена на пренатальних експозиціях у зв'язку з транскриптомічними сигнатурами, оскільки це вписується в сферу дії концепції експосоми. Таким чином, транскриптомні профілі були описані у зв'язку з впливом материнського куріння, оціненого в тканині плаценти 16, а також експозицією твердих частинок у зразках пуповинної крові 17.
Епігенетика
Епігенетика пов'язана з усіма спадковими змінами, які не впливають безпосередньо на саму послідовність ДНК. Найбільш широко вивченим епігенетичним механізмом в області екологічної епідеміології на сьогоднішній день є метилювання ДНК. Метилювання ДНК відноситься до процесу, при якому метил-групи додаються до послідовності ДНК. Таким чином, ці зміни метилювання можуть змінити експресію сегмента ДНК, не змінюючи його послідовності. Метилювання ДНК може бути вивчено за допомогою підходу до генів-кандидатів, використовуючи дизайн на основі травлення або, що частіше використовується, конверсію бісульфіту з подальшим піросеквенуванням, метилюванням специфічної ПЛР або масивом бісеру. Бісульфітна обробка ДНК опосередковує дезамінацію цитозину в урацил, і ці перетворені залишки будуть зчитуватися як тимін, як визначається ПЦР-ампліфікація та секвенування. Однак залишки 5 мК стійкі до цього перетворення і залишатимуться читаними як цитозин (рис. 3).
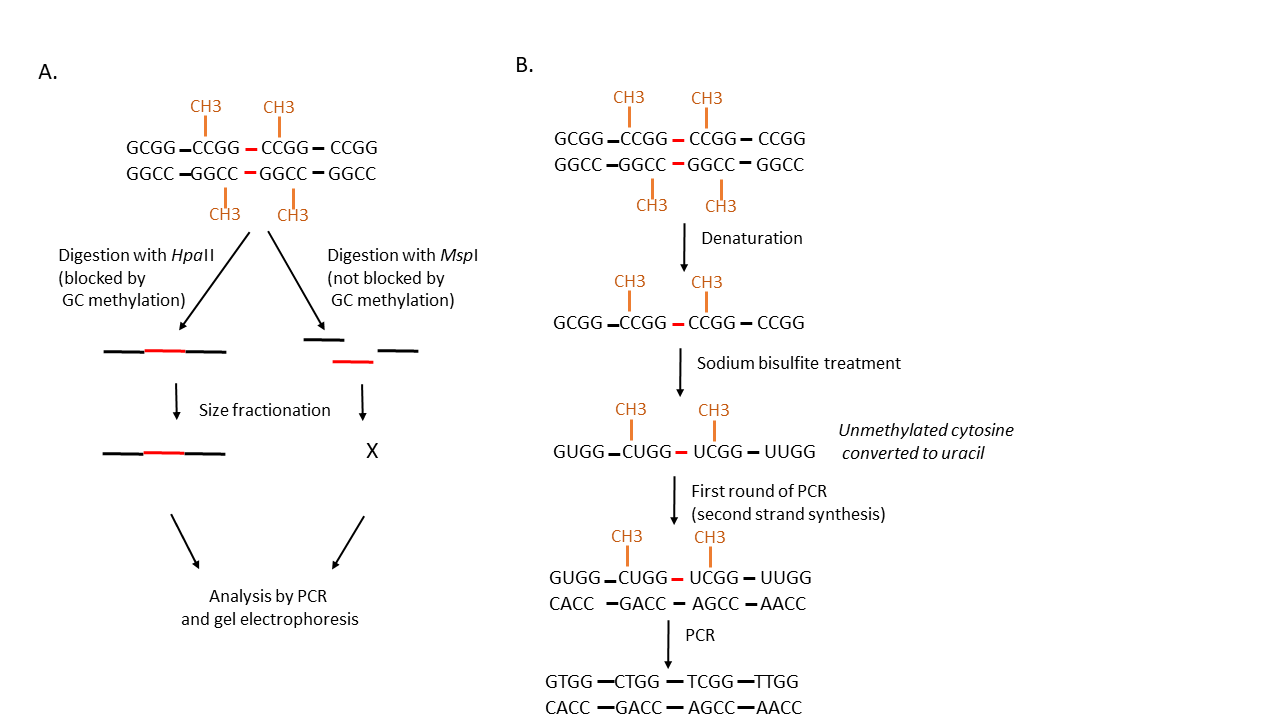
Якщо бажаний нецільовий підхід, можна дотримуватися кількох стратегій для отримання даних метилювання цілого генома, включаючи секвенування. Технології епігенотипування, такі як людський метилювання BeadChips 18, генерують метиляційний стан «псевдо-SNP» шляхом перетворення бісульфітів; отже, переклад відмінностей у схемах метилювання ДНК у відмінності послідовності, які можна проаналізувати за допомогою кількісного генотипування методи 19.
Цікавою характеристикою метилювання ДНК є те, що воно може мати трансгенераційні ефекти (тобто ефекти, які діють протягом декількох поколінь). Це було вперше показано в дослідженні населення, яке було пренатально піддано голоду під час голландської голодної зими в 1944-1945 роках. Ці люди мали менше метилювання ДНК імпринтованого гена кодування інсуліноподібного фактора росту 2 (IGF2) вимірюється 6 десятиліть пізніше в порівнянні з їх неекспонованих одностатевих братів і сестер. Асоціація була специфічною для периконцептуального впливу (тобто впливу в період від зачаття до ранньої вагітності), що підтверджує, що дуже ранній розвиток ссавців є вирішальним періодом для встановлення та підтримки епігенетичних знаків 20.
Посттрансляційні модифікації (тобто стосуються біохімічної модифікації білків після біосинтезу білка) останнім часом привернули більше уваги, оскільки вони, як відомо, індуковані окислювальним стресом 21 (див. Розділи про Оксидативний стрес) та специфічними медіаторами запалення 22. Крім їх функції в структурі хроматину в еукаріотичних клітині, було показано, що гістони мають токсичну та прозапальну активність при їх вивільненні у позаклітинний простір 23. Велика увага приділяється асоціаціям між впливом металів та модифікаціями гістонів, 24 хоча нещодавно було опубліковано перше людське дослідження щодо зв'язку між впливом твердих частинок та модифікацією гістону H3 25.
Експресія мікроРНК (мікроРНК є малими некодуючими РНК довжиною 22nt, які беруть участь у регуляції експресії генів на посттранскрипційному рівні шляхом деградації їх цільових мРНК та/або інгібування їх трансляції) {Ambros et al,2004} {Ambros, 2004 #324} {Ambros, 2004 #324} також було показано служать цінним маркером впливу, як кандидатний, так і нецільовий підходи призвели до виявлення моделей експресії miRNA, які пов'язані з впливом куріння 26, твердих частинок 27 та хімічних речовин, таких як поліхлоровані біфеніли (ПХБ) 28 .
Метаболоміка
Метаболоміка була запропонована як цінний підхід до вирішення проблем експосоми. Метаболоміка, дослідження метаболізму на рівні всього тіла, передбачає оцінку всього репертуару малих молекул продуктів метаболізму, присутніх у біологічній пробі. На відміну від генів, транскриптів і білків, метаболіти не закодовані в геномі. Вони також хімічно різноманітні, що складаються з вуглеводів, амінокислот, ліпідів, нуклеотидів та іншого. Очікується, що люди будуть містити кілька тисяч метаболітів, включаючи ті, які вони виробляють самі, а також поживні речовини та забруднюючі речовини з навколишнього середовища та речовини, що виробляються мікробами в кишечнику. Вивчення метаболоміки збільшує знання про взаємодію між експресією генів та білка та середовищем 29. Метаболоміка може бути біомаркером впливу навколишнього середовища, оскільки дозволяє повністю охарактеризувати біохімічні зміни, що відбуваються під час метаболізму ксенобіотиків (див. Розділ про метаболізм та захист ксенобіотиків). Останні технологічні розробки дозволили зменшити обсяг вибірки, необхідний для аналізу повного метаболому, що дозволяє оцінити загальносистемні метаболічні зміни, що відбуваються в результаті впливу або в поєднанні з результатом здоров'я 30. Що стосується всіх обговорюваних біомаркерів, то доступні як цільові метаболоміки, в яких конкретні метаболіти вимірюються, щоб охарактеризувати цікавить шлях, а також нецільові метаболомні підходи. Серед методологій «оміки» метаболоміка опитує рівні відносно меншої кількості ознак, оскільки існує близько 2900 відомих метаболітів людини проти ~ 30 000 генів. Тому він має сильну статистичну силу порівняно з дослідженнями в масштабах транскриптома та геному 31. Таким чином, метаболоміка є потенційно чутливим методом виявлення біохімічних впливів зовнішніх стресорів. Незважаючи на те, що розвивається область «екологічної метаболоміки» прагне використовувати метаболомічні методології для характеристики впливу впливу навколишнього середовища на функцію та здоров'я організму, взаємозв'язок між більшістю хімічних речовин та їх впливом на метаболом людини ще не вивчена.
Виклики
Обмеження молекулярно-епідеміологічних досліджень включають труднощі отримання зразків для дослідження, необхідність великих досліджуваних популяцій для виявлення значних зв'язків між експозицією і біомаркером, необхідність комплексних статистичних методів аналізу даних. Щоб обійти проблему збору зразків, багато зусиль було зосереджено на усуненні потреби у зразках крові або сироватки шляхом використання зразків слини, щечних клітин або вирізків нігтів для зчитування молекулярних маркерів. Хоча ці зразки можуть бути легко зібрані неінвазивним способом, слід подбати про те, щоб довести, що ці зразки дійсно точно відображають реакцію організму на вплив, а не місцевий ефект. Для метилювання ДНК було показано, що це сильно залежить від досліджуваного локусу. Для певних сайтів CpG кореляція рівнів метилювання набагато вища, ніж для інших сайтів 32. Для тих сайтів, які погано корелюють між тканинами, крім того, було продемонстровано, що рівень метилювання ДНК може відрізнятися в їх асоціаціях з клінічними результатами 33, тому необхідно дотримуватися обережності при розробці епідеміологічних досліджень для подолання цих проблем.
Опишіть 3 складові експосоми
Поясніть, як за допомогою зустрічаються в середній моделі біомаркерів можна ідентифікувати
Наведіть 3 приклади молекулярних (біо) маркерів впливу навколишнього середовища.
4.3.12. Експресія генів
Автор: Ніко М. ван Страален
Рецензенти: Дік Рулофс, Дейв Сперджен
Цілі навчання:
Ви повинні вміти
- надати огляд різних підходів «оміки» (геноміка, транскриптоміка, протеоміка та метаболоміка), що застосовуються в екологічній токсикології.
- опишіть практичність транскриптоміки, як генерується та аналізується профіль транскрипції.
- вказують на переваги та недоліки використання широкогеномної експресії генів у екологічній токсикології.
- розробити ідею про те, як транскриптоміка може бути інтегрована в оцінку ризику хімічних речовин.
Ключові слова: геноміка, транскриптоміка, протеоміка, метаболоміка, оцінка ризику
Синопсис
Низькодозове вплив токсикантів викликає біохімічні зміни в організмі, які спрямовані на підтримку гомеостазу внутрішнього середовища та запобігання пошкодженню. Одним із аспектів цих змін є велика кількість стенограм ферментів біотрансформації, ферментів захисту від окислювального стресу, білків теплового шоку та багатьох білків, пов'язаних із реакцією клітинного стресу. Такі захисні механізми часто є високоіндукованими, тобто їх діяльність сильно регулюється у відповідь на токсикант. Відомо також, що більшість стресових реакцій специфічні для типу токсиканту. Цей принцип може бути зворотний: якщо спостерігається порушена реакція на стрес, це означає, що організм піддається впливу певного стресового фактора; характер стресового фактора може бути навіть виведений з профілю транскрипції. З цієї причини мікромасиви, секвенування РНК або інші методи аналізу транскриптом застосовувалися в самих різних контекстах, як в лабораторних експериментах, так і в польових обстеженнях. Ці дослідження показують, що транскриптоміка має високі показники (у порядку зменшення) (1) швидкості, (2) специфічності та (3) чутливості. Хоча обіцянки застосування геноміки в екологічній токсикології високі, більшість застосувань знаходяться в дослідженнях режиму дії, а не в оцінці ризику.
Вступ
Жоден організм не є беззахисним від токсикантів навколишнього середовища. Навіть при експозиції нижче фенотипічно видимих рівнів відсутності ефекту безліч фізіологічних та біохімічних захисних механізмів вже активні і сприяють гомеостазу організму. Ці регуляторні механізми часто передбачають регуляцію захисних механізмів, таких як захист від окислювального стресу, біотрансформація (ксенобіотичний метаболізм), реакції теплового шоку, індукція металозв'язуючих білків, відповідь на гіпоксію, відновлення пошкодження ДНК тощо. метаболізм і функції, пов'язані з ростом і розмноженням. На додаток до цих цілеспрямованих регуляторних механізмів націлювання, зазвичай існує багато вторинних ефектів та дисфункціональних змін, що виникають внаслідок пошкодження. Всебічний огляд всіх цих коригувань можна отримати з аналізу транскриптома.
У цьому модулі ми розглянемо різні підходи, прийняті в «оміці», з акцентом на транскриптоміку. «Омікс» - це контейнерний термін, що включає п'ять різних видів діяльності. У таблиці 1 наведено перелік цих підходів та їх можливий внесок у екологічну токсикологію. Геноміка та транскриптоміка займаються секвенуванням ДНК та мРНК, протеоміка спирається на мас-спектрометрію, тоді як метаболоміка включає різні методи поділу та виявлення, залежно від класу проаналізованих сполук. Різні підходи набирають силу при спільному застосуванні. Наприклад, аналіз протеоміки набагато більш проникливий, якщо його можна пов'язати з анотованою послідовністю геному, а дослідження метаболізму можуть отримати значний прибуток від профілів транскрипції, які включають ферменти, відповідальні за метаболічні реакції. Системна біологія має на меті інтегрувати різні підходи за допомогою математичних моделей. Однак справедливо сказати, що кореляція між відповідями на різних рівнях часто досить бідна. Upregulation стенограми не завжди означає більше білка, більше білка може генеруватися без транскрипційної upregulation і концентрація метаболіту не завжди корелює з перерегулюванням ферментів, які передбачається виробляти його. У цьому модулі ми зупинимося лише на транскриптоміці. Метаболоміка розглядається в окремому розділі.
Таблиця 1. Огляд різних підходів «оміки»
|
Термін |
Опис |
Актуальність для екологічної токсикології |
|
геноміка |
Секвенування та асамблея геному, порівняння геномів, філогенетика, еволюційний аналіз |
Пояснення видових та родових відмінностей у сприйнятливості від структури мішеней та метаболічного потенціалу, взаємозв'язку між токсикологією, еволюцією та екологією |
|
транскриптоміка |
Аналіз транскриптом (мРНК), профілювання експресії генів |
цільова та метаболічна експресія, що вказує активність, аналіз режимів дії, діагностика речовинспецифічних ефектів, інструмент раннього попередження для оцінки ризику |
|
Протеоміка |
Аналіз білкового комплементу клітини або тканини |
Системний обмін речовин і детоксикація, діагностика фізіологічного статусу, довгострокових або постійних ефектів |
|
Метаболоміка |
Аналіз всіх метаболітів з певного класу, аналіз шляху |
Функціональне зчитування фізіологічного стану клітини або тканини |
|
Системна біологія |
Інтеграція різних «омічних» підходів, мережевий аналіз, моделювання |
Розуміння когерентних реакцій, екстраполяція на фенотипові реакції всього тіла |
Аналіз транскриптоміки
Метою транскриптоміки в екологічній токсикології є отримання повного огляду всіх змін у кількості мРНК в клітині або тканині як функція впливу хімічних речовин навколишнього середовища. Зазвичай це робиться в такій послідовності кроків:
- Вплив організмів токсикантом навколишнього середовища, включаючи діапазон концентрацій, часових точок тощо, залежно від цілей експерименту.
- Виділення загальної РНК від осіб або вибірка об'єднаних особин. Кількість біологічних реплікацій визначається на цьому етапі кількістю незалежних виділень РНК, а не технічною реплікацією далі в процедурі.
- Зворотна транскрипція. МРНК транскрибуються в кДНК за допомогою ферменту зворотної транскриптази, який ініціюється в хвості PolYA мРНК. Оскільки рибосомальної РНК не вистачає полі (А) хвоста, вони (в принципі) не транскрибуються в кДНК. Далі слід вибір розміру, а іноді маркування CDNA штрих-кодами для полегшення послідовності.
- Секвенування пулу кДНК та збірки транскриптом. Збірка переважно використовує еталонний геном для видів. Якщо еталонний геном відсутній, транскриптом збирається de novo, що вимагає більшої глибини секвенування і зазвичай закінчується багатьма неповними стенограмами. Різноманітні корекції застосовуються для вирівнювання ефектів загального виходу РНК, розміру бібліотеки, глибини секвенування, довжини гена тощо.
- Аналіз експресії генів та оцінка регуляції складки. Це робиться, в принципі, шляхом підрахунку нормованої кількості транскриптів на ген для кожного гена в геномі, для кожного з різних умов, яким піддавався організм. Відповідь на ген виражається як регуляція складки, шляхом експресії стенограми щодо стандартного або контрольного стану. Випробування проводяться для відокремлення значних змін від шуму.
- Анотація та оцінка шляхів та функцій під впливом впливу. Розробляється інтегративна картина, беручи всі докази разом, функціональних змін в організмі.
У недавньому минулому крок 4 робився гібридизацією мікромасивів, а не прямим секвенуванням. У цій методиці два пули кДНК (наприклад, контроль та лікування) гібридизуються до великої кількості зондів, закріплених на невеликій скляній пластині. Зонди призначені для представлення повного генного комплементу організму. Позитивні сигнали гібридизації приймаються як доказ для нерегульованої експресії генів. Гібридизація мікромасивів виникла в 1995-2005 роках, але в даний час в значній мірі обігнали надшвидкі та високопродуктивні методи секвенування наступного покоління, однак, завдяки економічній ефективності, відносній простоті аналізу біоінформатики та стандартизації оцінюваних генів він все ще часто використовується.
Ми ілюструємо принципи аналізу транскриптоміки та вид аналізу даних, який слід за ним, на прикладі з роботи Bundy et al. (2008). Ці автори піддали дощових черв'яків (Lumbricus rubellus) ґрунтам, експериментально зміненим міддю, досить токсичним елементом для дощових черв'яків. Індукований міддю транскриптом досліджувався за допомогою спеціально виготовленої мікроматриці, а метаболічні профілі були встановлені за допомогою ЯМР (ядерно-магнітного резонансу) спектроскопії. З 8 209 зондів на мікромасиві 329 показали значну зміну експресії під впливом міді. Дані були побудовані на діаграмі «теплової карти» (рисунки 1A та 1B), забезпечуючи швидкий огляд регульованих та знижених генів. Профілі виразів також аналізувалися в зменшеній розмірності за допомогою аналізу головних компонентів (PCA). Це показало, що профілі значно змінювалися з лікуванням. Особливо найвищі і передостанні найвищі експозиції генерували профіль, сильно відрізняється від контрольного (див. Рис. 1С). Гени можуть бути розподілені на чотири кластери, (1) гени, регульовані міддю протягом усіх експозицій (рис. 1D), (2) гени, знижені міддю (див. Рис. 1E), (3) гени, регульовані низькими експозиціями, але не впливають на більш високі експозиції (див. Рис. 1F), і (4) гени, регульовані низькою експозицією, але нижчерегульовані за більш високими концентраціями (див. Рис. 1G). Аналіз ідентичності генів у поєднанні з аналізом метаболітів припустив, що зміни були обумовлені впливом міді на мітохондріальне дихання, зменшуючи кількість енергії, що генерується окислювальним фосфорилюванням. Цей механізм лежав в основі зниження росту тіла, що спостерігається на фенотипічному рівні.
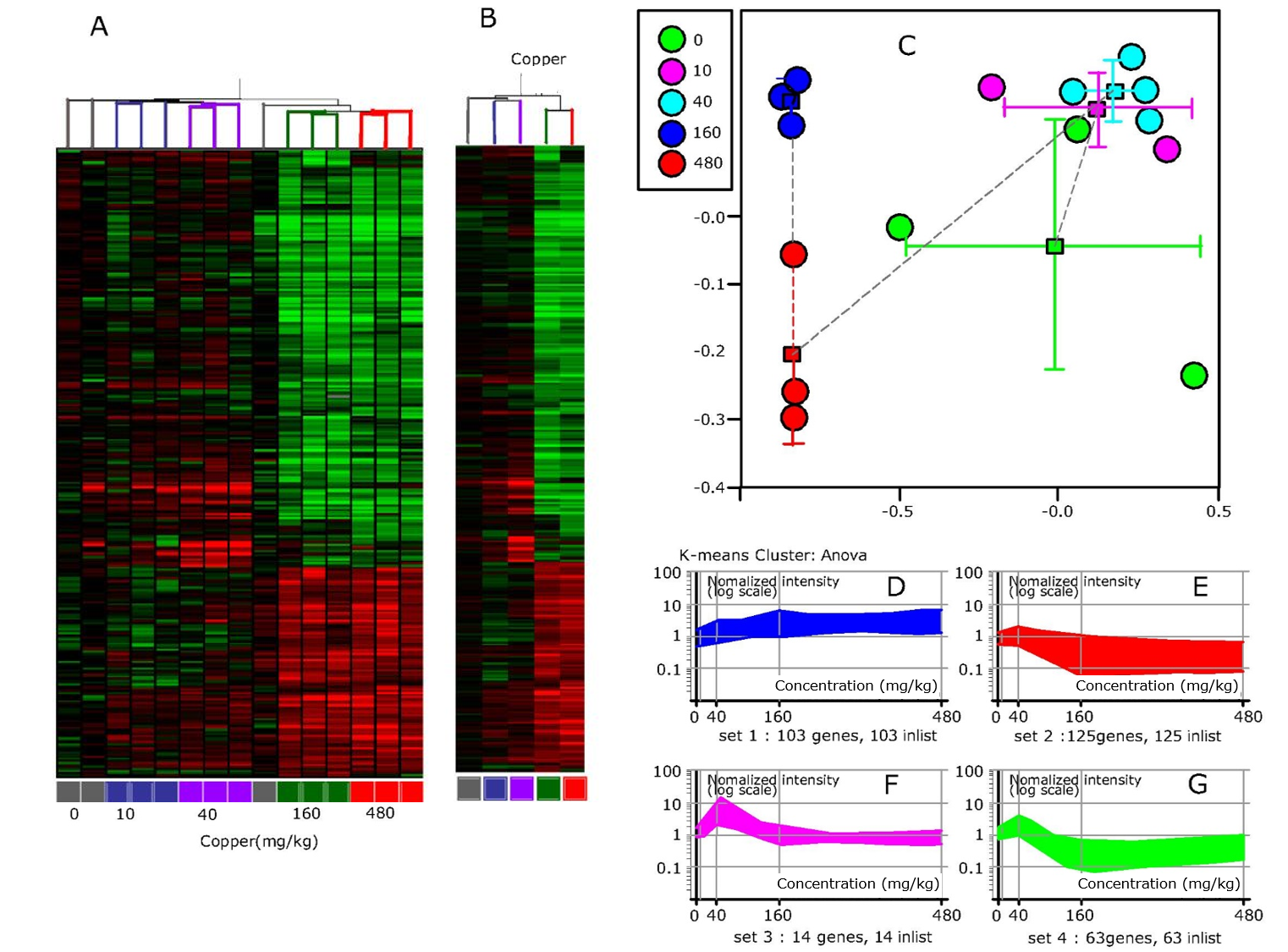
Оміка в оцінці ризиків
Як омікс-технології, особливо транскриптоміка, можуть сприяти оцінці ризику хімічних речовин? Висунуто три можливі переваги:
- Аналіз експресії генів відбувається швидко. Регуляція генів відбувається за часовою шкалою годин, і результати можуть бути отримані протягом декількох днів. Це дуже вигідно відрізняється від традиційного тестування токсичності (Дафнія, 48 годин, Фольсомія, 28 днів).
- Експресія генів специфічна. Оскільки профіль транскрипції включає сотні до тисяч кінцевих точок (генів), інформаційний вміст потенційно дуже великий. Порівнюючи новий профіль, створений невідомою сполукою, з навченим набором даних, з'єднання зазвичай можна ідентифікувати досить точно.
- Експресія генів чутлива. Оскільки регуляція генів є однією з перших біохімічних реакцій в організмі, очікується, що вона реагує на більш низькі дози, при яких параметри всього тіла, такі як виживання, ріст і розмноження, ще не реагують.
Серед цих переваг друга (специфіка) показала себе найбільш послідовною і, можливо, приносить найбільшу перевагу. Це можна проілюструвати дослідженням Dom et al. (2012), в якому були створені профілі експресії генів для Daphnia magna, що піддаються впливу різних спиртів та хлорованих анілінів (рис. 2).
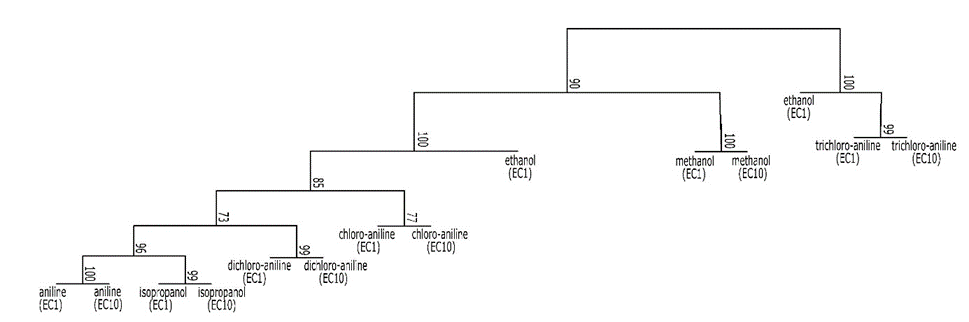
Профілі реплікатів, що піддаються впливу однієї і тієї ж сполуки, завжди були згруповані разом, за винятком одного випадку (етанолу), показуючи, що експресія генів досить специфічна для сполуки. Можна змінити цей аргумент: з профілю експресії гена можна вивести сполуку, що викликає його. Крім того, наведений приклад показав, що перше розділення в кластерному аналізі було між експозиціями, які впливали і не впливали на запаси енергії та зростання. Таким чином, профілі експресії генів вказують не тільки на сполуку, але і на тип очікуваних ефектів.
Твердження про швидкісність також виявилося правдивим, однак, перевага швидкодії не завжди підтверджується. Це може бути проблемою, коли швидкі рішення мають вирішальне значення (оцінка вантажівки, завантаженої підозрілим забрудненим ґрунтом, рішення про те, чи скидати певний потік відходів у озеро так чи ні), але для регулярних процедур оцінки ризиків це виявилося меншою перевагою, ніж іноді очікувалося. Нарешті, більша чутливість експресії генів у сенсі нижчих концентрацій ефекту, ніж класичні кінцеві точки, є потенційною перевагою, але виявляється менш вражаючою на практиці. Однак є чіткі приклади, в яких було показано, що експозиції нижче рівня фенотипічного ефекту індукують реакції експресії генів, вказуючи на те, що організм зміг компенсувати будь-які негативні ефекти, коригуючи свою біохімію.
Інша стратегія щодо використання експресії генів при оцінці ризику полягає не в тому, щоб зосередитися на транскриптомах у всьому геномі, а на вибраних генах біомаркерів. У цій стратегії генні вирази спрямовані на те, щоб показати (1) послідовну залежність від дози, (2) відповіді на широкий спектр забруднюючих речовин та (3) кореляції з біологічними пошкодженнями. Наприклад, De Boer et al. (2015) проаналізував композитний набір даних, включаючи експерименти з шістьма важкими металами, шістьма хлоранінами, тетрахлорбензолом, фенантреном, диклофенаком та ізотіоцианатом, всі раніше використовувалися в стандартизованих експериментах з земляним коллемболаном, Folsomia candida. Протягом усіх методів лікування було зроблено вибір з 61 гену, які реагували у всіх випадках і відповідали трьом переліченим вище критеріям. Деякі з цих маркерних генів показали дуже хорошу та відтворювану реакцію, пов'язану з дозою, на забруднення ґрунту. Два біомаркери показані на малюнку 3. Цей експеримент, призначений для діагностики польового ґрунту зі складним невідомим забрудненням, наочно продемонстрував наявність органічних токсикантів, що індукують Cyp.
Звичайно, є і недоліки, пов'язані з транскриптомікою в екологічній токсикології, наприклад:
- Аналіз експресії генів вимагає наукомісткої інфраструктури, включаючи високий рівень експертизи для деяких аналізів біоінформатики. Також необхідні адекватні молекулярні лабораторні засоби; деякі методи досить дорогі.
- Аналіз експресії генів є найбільш плідним, коли використовуються види, які підкріплені адекватними геномними ресурсами, особливо добре анотованою збіркою геному, хоча це стає менш проблемою зі збільшенням доступності геномних ресурсів.
- Взаємозв'язок між експресією генів та екологічно важливими змінними, такими як ріст та відтворення тварини, не завжди зрозуміла.
Висновки
Аналіз експресії генів займає визначену нішу в екологічній токсикології приблизно з 2005 року. Це поле, яке високо керується технологіями, і демонструє безперервні зміни протягом останніх років. Це може суттєво сприяти оцінці ризику в контексті досліджень способу дії та як джерело визначених біомаркерних методів. Нарешті, дані транскриптоміки дуже підходять для подачі інформації щодо ключових подій, важливих біохімічних змін, які причинно пов'язані з рівнем фенотипу, щоб сформувати шлях несприятливого результату. Ми посилаємося на розділ про Шляхи несприятливих результатів для подальшого читання.
Посилання
Банді, Дж. Г., Сідху, Дж. К., Рана, Ф., Сперджен, Д.Дж., Свендсен, С., Рен, Дж. Ф., Штюрзенбаум, С.Р., Морган, А.Дж., Кілль, П. (2008). Підхід «Системна токсикологія» визначає узгоджені метаболічні реакції на мідь у наземного немодельного безхребетного, дощового черв'яка Lumbricus rubellus. BMC Біологія 6, 25.
Де Бур, Т.Е., Янссен, Т.К.С., Леглер, Дж., Ван Страален, Н.М., Рулофс, Д. Комбінований аналіз транскриптоміки для класифікації несприятливих ефектів як потенційної кінцевої точки скринінгу на основі ефекту. Екологічна наука і технологія 49, 14274-14281.
Дом, Н., Вергаувен, Л., Ванденбрук, Т., Янсен, М., Блуст, Р., Кнапен, Д. Оцінка фізіологічних та молекулярних ефектів проти схем дії на основі фізико-хімії: Daphnia magna, що піддається впливу наркотиків та полярних наркотиків. Екологічна наука і технологія 46, 10-18.
Гібсон Г., Муза С.В. Буквар науки про геном. Sinauer Associates Inc., Сандерленд.
Гібсон, Г. Екологічний внесок у профілі експресії генів. Відгуки природи Генетика 9, 575-581.
Рулофс, Д., Де Бур, М., Агаменноне, В., Бушье, П., Леглер, Дж., Ван Страален, Н. Функціональна екологічна геноміка ґрунту муніципального звалища. Межі в генетиці 3, 85.
Ван Страален Н.М., Федер М.Є. Екологічна та еволюційна функціональна геноміка - як вона може сприяти оцінці ризику хімічних речовин? Екологічні науки і технології 46, 3-9.
Ван Страален, Н.М., Рулофс Д. Технологія геноміки для оцінки забруднення ґрунтів . Журнал біології 7, 19.
Визначте: (1) геноміку, (2) транскриптоміку (3) протеоміку та (4) метаболоміку та вкажіть, який із цих підходів є найбільш корисним при оцінці ризику хімічних речовин.
Вкажіть три переваги та принаймні один недолік використання широкогеномної експресії генів як інструменту оцінки екологічного ризику.
4.3.13. Метаболоміка
Автор: Пім Є.Г. Леонард
Рецензенти: Ніко ван Страален, Дрю Екман
Цілі навчання:
Ви повинні вміти:
- розуміє основи метаболоміки і як можна використовувати метаболоміку.
- опишіть основні принципи метаболомічного аналізу, а також те, як формується та аналізується метаболічний профіль.
- опишіть відмінності між цільовою та нецільовою метаболомікою та те, як кожен використовується в екологічній токсикології.
- розробити ідею про те, як метаболоміка може бути інтегрована в оцінки небезпеки та ризику хімічних речовин.
Ключові слова: Метаболоміка, метаболоміка, екологічна метаболоміка, області застосування метаболоміки, цільова та нецільова метаболоміка, метаболомічний аналіз та документообіг
Вступ
Метаболоміка - це систематичне дослідження малих органічних молекул (<1000 Da), які є проміжними продуктами і продуктами, що утворюються в клітині і біофлюїдах внаслідок обмінних процесів. Велика різноманітність малих молекул є результатом взаємодії між генами, білками та метаболітами. Основними типами досліджуваних малих органічних молекул є ендогенні метаболіти (тобто ті, що відбуваються природним шляхом в клітині), такі як цукру, амінокислоти, нейромедіатори, гормони, вітаміни та жирні кислоти. Загальна кількість ендогенних метаболітів в організмі все ще вивчається, але оцінюється в тисячах. Однак ця кількість значно варіюється між видами та типами клітин. Наприклад, клітини мозку містять відносно високий рівень нейромедіаторів та ліпідів, проте рівні між різними типами тканин мозку можуть значною мірою відрізнятися. Метаболіти працюють в мережі, наприклад, цикл лимонної кислоти, шляхом перетворення молекул ферментами. Час обороту метаболітів регулюється присутніми ферментами та кількістю присутніх метаболітів.
Область метаболоміки є відносно новою порівняно з геномікою, причому перший проект метаболома людини доступний у 2007 році. Однак поле швидко зростало з того часу завдяки своїй визнаній здатності відображати молекулярні зміни, найбільш тісно пов'язані з фенотипом організму. Дійсно, порівняно з іншими «омічними підходами» (наприклад, транскриптомікою), метаболіти є нижчими результатами дії генів та білків і, як такі, забезпечують прямий зв'язок з фенотипом (рис. 1). Метаболічний статус організму безпосередньо пов'язаний з його функцією (наприклад, енергетичним, окислювальним, ендокринним та репродуктивним статусом) та фенотипом, і, отже, унікально підходить для пов'язання хімічного стресу зі станом здоров'я організмів. Більше того, транскриптоміка та протеоміка, ідентифікація метаболітів не вимагає існування послідовностей генів, що робить його особливо корисним для тих видів, у яких відсутній секвенований геном.
Визначення
Повний набір малих молекул у біологічній системі (наприклад, клітини, рідини організму, тканини, організм) називається метаболомом (Таблиця 1). Термін метаболоміка був введений Олівером та співавтом (1998), який описав його «як повний набір метаболітів/низькомолекулярних сполук, які залежать від контексту, змінюючись залежно від фізіології, розвитку або патологічного стану клітини, тканини, органу або організму». Ця цитата підкреслює спостереження, що рівні метаболітів можуть змінюватися через внутрішні, а також зовнішні фактори, включаючи стрес, спричинений впливом забруднюючих речовин навколишнього середовища. Це призвело до виникнення та зростання галузі екологічної метаболоміки, яка базується на застосуванні метаболоміки, до біологічних систем, які піддаються впливу забруднюючих речовин навколишнього середовища та інших відповідних стресорів (наприклад, температури). Окрім ендогенних метаболітів, деякі метаболомні дослідження також вимірюють зміни біотрансформації забруднюючих речовин навколишнього середовища, харчових добавок або лікарських засобів у клітині, збір яких отримав назву ксенометаболома.
Таблиця 1: Визначення метаболоміки.
|
Термін |
Визначення |
Актуальність для екологічної токсикології |
|
Метаболоміка |
Аналіз малих органічних молекул (<1000 Da) в біологічних системах (наприклад, клітина, тканина, організм) |
Функціональне зчитування фізіологічного стану клітини або тканини і безпосередньо пов'язаного з фенотипом |
|
Метаболом |
Вимірювання c повного набору малих молекул в біологічній системі |
Виявлення уражених метаболічних шляхів внаслідок впливу забруднюючих речовин |
|
Екологічна метаболоміка |
Метаболомічний аналіз в біологічних системах, які піддаються впливу екологічного стресу, таких як вплив забруднюючих речовин навколишнього середовища |
Метаболоміка, орієнтована на вплив забруднюючих речовин навколишнього середовища, для вивчення, наприклад, механізму токсичності або пошуку біомаркера впливу або ефекту. |
|
Ксенометаболом |
Метаболіти, що утворюються в результаті біотрансформації забруднюючих речовин навколишнього середовища, харчових добавок або лікарських засобів |
Розуміння метаболізму цільового забруднювача |
|
Цільова метаболоміка |
Аналіз попередньо обраного набору метаболітів в біологічній системі |
Зосередьтеся на впливі забруднюючих речовин навколишнього середовища на конкретні метаболічні шляхи |
|
Нецільова метаболоміка |
Аналіз усіх виявлених (тобто не попередньо вибраних) метаболітів у біологічній системі |
Аналіз метаболічних шляхів на основі виявлення впливу забруднюючих речовин навколишнього середовища |
Екологічний аналіз метаболоміки
Розробка та успішне застосування метаболоміки значною мірою спирається на i) наявні в даний час аналітичні методи, що вимірюють метаболіти в клітині, тканині та організмах, ii) ідентифікацію хімічних структур метаболітів та iii) характеристику метаболічної мінливості всередині клітини, тканини та організми.
Метою аналізу метаболоміки в екологічній токсикології може бути:
- зосередитися на зміні в достатку специфічних метаболітів в біологічній системі
після впливу забруднюючих речовин навколишнього середовища: цілеспрямована метаболоміка
- забезпечити «повний» огляд змін у достатку всіх виявлених метаболітів у біологічній системі після впливу забруднюючих речовин навколишнього середовища: нецільова метаболоміка
У цільовій метаболоміці кількісно аналізується обмежена кількість попередньо відібраних метаболітів (як правило, 1-100) (наприклад, nmol дофамін/г тканини). Наприклад, метаболіти в біосинтетичному шляху нейромедіатора можуть бути спрямовані на оцінку впливу пестицидів. Націлювання на конкретні метаболіти таким чином зазвичай дозволяє виявляти їх у низьких концентраціях з високою точністю. І навпаки, в нецільової метаболоміки метою є виявлення якомога більшої кількості метаболітів, незалежно від їх ідентичності, щоб оцінити якомога більшу частину метаболому. Найбільшою проблемою для нецільової метаболоміки є ідентифікація (анотація) хімічних структур виявлених метаболітів. В даний час не існує єдиного аналітичного методу, здатного виявити всі метаболіти в пробі, і тому для виявлення метаболома використовується комбінація різних аналітичних методик. Потрібні різні методики завдяки широкому спектру фізико-хімічних властивостей метаболітів. Різноманітність хімічних структур метаболітів показано на малюнку 2. Метаболіти можуть бути згруповані в класи, такі як жирні кислоти (класи наведені в дужках на малюнку 2), а в межах класу можна знайти різні метаболіти.
Загальний робочий процес екологічного метаболомічного аналізу використовує наступні етапи:
- організму або клітин до забруднювача навколишнього середовища. Також повинна бути включена неекспонована контрольна група. Експозиції часто включають використання різних концентрацій, часових точок тощо, залежно від цілей дослідження.
- Збір зразків відповідного біологічного матеріалу (наприклад, клітини, тканини, організму). Важливо, щоб збір проводився якомога швидше, щоб вгамувати будь-який подальший обмін речовин. Зазвичай використовуються крижані холодні розчинники.
- метаболітів з клітини, тканини або організмів шляхом двоступеневої екстракції з використанням комбінації полярних (наприклад, вода/метанол) і аполярних (наприклад, хлороформ) екстракційних розчинників.
- полярної та аполярної фракцій за допомогою рідинної хроматографії (LC) або газової хроматографії (ГК) у поєднанні з мас-спектрометрією (МС), або методом ядерно-магнітно-резонансної (ЯМР) спектроскопії. Використовуваний аналітичний інструмент (и) залежатиме від розглянутих метаболітів і від того, чи потрібен цільовий або нецільовий підхід.
- Виявлення метаболітів (цільовий або нецільовий аналіз).
- Цільова метаболоміка - визначається специфічний набір попередньо відібраних метаболітів і їх концентрації визначаються з використанням автентичних стандартів.
- Нецільова метаболоміка - список всіх виявлених метаболітів, що вимірюються за допомогою МС або ЯМР відповіді, і збираються їх інтенсивності. Потім використовуються різні методи для визначення ідентичності тих метаболітів, які змінюються внаслідок впливу (див. Крок 7 нижче).
- Статистичний аналіз з використанням одноваріантної та багатовимірної статистики для обчислення різниці між експозицією та контрольними групами. Визначено зміну складки (збільшення або зниження рівня метаболітів) між експозицією та контрольною групою.
- Для нецільової метаболоміки ідентифіковано лише хімічну структуру статистично значущих метаболітів. Ідентифікація хімічної структури метаболіту може базуватися на молекулярній масі, ізотопних малюнках, елементних композиціях, мас-спектрометрії фрагментації і т.д. бібліотеки мас-спектрометрії використовуються для ідентифікації для відповідності вищезазначеним параметрам у зразках з дані в бібліотеках.
- Обробка даних: Ідентифікація метаболічних шляхів під впливом хімічного впливу. Інтегративна картина молекулярно-функціонального рівня організму внаслідок хімічного впливу. Зрозумійте взаємозв'язок між хімічним впливом, змінами молекулярного шляху та спостережуваною токсичністю. Або для виявлення потенційних біомаркерів впливу або ефекту.
|
Box: Аналітичні інструменти для метаболомічного аналізу Найбільш часто використовуваними аналітичними інструментами для вимірювання метаболітів є мас-спектрометрія (МС) і ядерно-магнітно-резонансна (ЯМР) спектроскопія. MS - аналітичний інструмент, який генерує іони молекул, а потім вимірює їх співвідношення маси до заряду. Ця інформація може бути використана для створення «молекулярного відбитку пальця» для кожної молекули, і на основі цього відбитків пальців можуть бути ідентифіковані метаболіти. Хроматографія зазвичай використовується для відділення різних метаболітів суміші, знайденої в зразку, перш ніж він потрапляє в мас-спектрометр. У метаболоміці використовуються дві основні методи хроматографії: рідинна хроматографія та газова хроматографія. Завдяки високій чутливості МС здатна одночасно вимірювати велику кількість різних метаболітів. Більше того, у поєднанні з таким методом поділу, як хроматографія, МС може виявляти та ідентифікувати тисячі метаболітів. Мас-спектрометрія набагато чутливіша, ніж ЯМР, і вона може виявити великий спектр різних типів метаболітів з різними фізико-хімічними властивостями. ЯМР менш чутливий і тому може виявити меншу кількість метаболітів (зазвичай 50-200). Перевагами ЯМР є мінімальна кількість обробки зразків, відтворюваність вимірювань (завдяки високій точності), а також легше кількісно оцінити рівні метаболітів. Крім того, ЯМР - це неруйнівний метод, такий, що зразок часто може бути використаний для подальшого аналізу після отримання даних. |
Застосування екологічної метаболоміки
Метаболоміка широко використовується у відкритті наркотиків та медичних науках. Зовсім недавно метаболоміка включається в екологічні дослідження, що розвивається область досліджень під назвою екологічна метаболоміка. Екологічна метаболоміка використовується в основному в п'яти областях застосування (таблиця 2). Мабуть, найбільш часто використовуваним додатком є вивчення механізму токсичності/способу дії (MoA) забруднюючих речовин. Однак багато досліджень виявили вибрані метаболіти, які показують перспективність для використання в якості біомаркерів впливу або ефекту. В результаті своєї сили у виявленні відбитків пальців відповіді, метаболоміка також знаходить застосування в області регуляторної токсикології, особливо для читання через дослідження. Ця програма особливо корисна для швидкого скринінгу забруднюючих речовин на токсичність. Метаболоміка також може бути використана в дослідженнях доза-відповідь (еталонне дозування) для отримання точки відправлення (POD). Це особливо цікаво при нормативній оцінці хімічного ризику.
В даний час область системної токсикології досліджується шляхом об'єднання даних з різних областей оміки (наприклад, транскриптоміка, протеоміка, метаболоміка), щоб покращити наше розуміння взаємозв'язку між різними оміками, хімічним впливом та токсичністю, а також для кращого розуміння механізму токсичності/ МОА.
Таблиця 2: Області застосування метаболоміки в екологічній токсикології.
|
Область застосування |
Опис |
|
Механізм токсичність/ Режим дії (MoA) |
Використовуючи метаболоміку, щоб зрозуміти на молекулярному рівні шляхи, на які впливає вплив забруднюючих речовин навколишнього середовища. Відкриття способу дії хімічних речовин. У шляху несприятливого результату (AOP) Метаболоміка виявлення використовується для ідентифікації ключових подій (KE), шляхом зв'язування хімічного впливу на молекулярному рівні з функціональними кінцевими точками (наприклад, відтворення, поведінка). |
|
Відкриття біомаркерів |
Ідентифікація метаболітів, які можуть бути використані як зручні (тобто легкі і недорогі для вимірювання) показники впливу або ефекту. |
|
Читання поперек |
У регуляторній токсикології метаболоміка використовується в дослідженнях, що читають, щоб надати інформацію про схожість реакцій між хімічними речовинами. Такий підхід корисний для виявлення більш екологічно токсичних хімічних речовин. |
|
Пункт відправлення |
Метаболоміка може бути використана в дослідженнях доза-відповідь (еталонне дозування) для отримання точки відправлення (POD). Це особливо цікаво при нормативній оцінці хімічного ризику. Ця програма в даний час ще не використовується. |
|
Системи токсикології |
Комбінований підхід різних оміків (наприклад, транскриптоміка, протеоміка, метаболоміка) для поліпшення нашого розуміння взаємозв'язку між різними оміками та хімічним впливом, а також для кращого розуміння механізму токсичності/MoA. |
Як ілюстрація механізму застосування токсичності/способу дії, Bundy et al. (2008) використовували метаболоміку на основі ЯМР для дослідження дощових черв'яків (Lumbricus rubellus), що піддаються впливу різних концентрацій міді в ґрунті (0, 10, 40, 160, 480 мг міді/кг ґрунту). Вони виконували як транскриптомічні, так і метаболомічні дослідження. Були проаналізовані як полярні (цукру, амінокислоти тощо), так і аполярні (ліпіди) метаболіти та визначено зміни складок відносно контрольної групи. Наприклад, відмінності в складці зміни ліпідних метаболітів (наприклад, жирних кислот, триацилгліцерину) як функції концентрації міді показані як «теплова карта» на малюнку 3А. Очевидно, що група найвищих доз (480 мг/кг) має дуже різну схему метаболітів ліпідів, ніж інші групи. Дані полярних метаболітів були проаналізовані за допомогою аналізу основних компонентів (PCA), багатовимірного статистичного інструменту, який зменшує кількість вимірів даних. Графік оцінки PCA, показаний на малюнку 3B, показує, що найбільші відмінності в профілі метаболітів існують між: групами контролю та низькою дозою (10 мг КУ/кг), групами 40 мг КУ/кг та групами 160 мг КУ/кг та групою найвищої дози (480 мг КУ/кг) (рис. 3B). Ці поділи свідчать про те, що структури метаболітів у цих групах були різними внаслідок різних впливів міді. Деякі з метаболітів були вгору-, а деякі були регульовані вниз через вплив міді (два приклади наведені на малюнках 3c і 3D). Дані метаболітів також поєднувалися з даними експресії генів у застосуванні системної токсикології. Цей комбінований аналіз показав, що вплив міді призвело до порушення енергетичного обміну, особливо щодо впливу на мітохондрії та окислювального фосфорилювання. Bundy et al. пов'язували цей вплив на енергетичний обмін зі зниженою швидкістю росту дощових черв'яків. Це дослідження ефективно показало, що метаболоміка може бути використана для розуміння шляхів метаболітів, на які впливає вплив міді і тісно пов'язані з фенотипічними змінами (тобто зниженою швидкістю росту). Дані транскриптом, зібрані одночасно, були в хорошій відповідності з шаблонами метаболому, підтримуючи Bundy et al. ' S гіпотеза про те, що одночасне вимірювання транскриптоми і метаболома може бути використано для перевірки висновків обох підходів, і, в свою чергу, значення «системної токсикології».
Проблеми в метаболоміці
В даний час існує кілька проблем у галузі метаболоміки. З біологічної точки зору метаболізм є динамічним процесом і тому дуже чутливим до часу. Взяття зразків у різні моменти часу під час розвитку організму або протягом хімічного впливу може призвести до досить різних схем метаболітів. Обробка та зберігання зразків також можуть бути складними, оскільки деякі метаболіти дуже нестабільні під час збору зразків та обробки зразків. З аналітичної точки зору метаболіти мають широкий спектр фізико-хімічних властивостей і зустрічаються в сильно різних концентраціях, таких, що захоплення найширшої частини метаболома вимагає аналізу з більш ніж однією аналітичною технікою. Однак найбільшою проблемою, можливо, є ідентифікація хімічної структури невідомих метаболітів. Навіть за допомогою найсучасніших аналітичних методів можна впевнено ідентифікувати лише частину невідомих метаболітів.
Висновки
Метаболоміка є відносно новою сферою в токсикології, але швидко розширює наше розуміння біохімічних шляхів, на які впливає вплив забруднюючих речовин навколишнього середовища, і, в свою чергу, механізми їх дії. Зв'язка змінених молекулярних шляхів через вплив забруднюючих речовин фенотипічними змінами організмів є областю великого інтересу. Постійний прогрес у найсучасніших аналітичних інструментах для виявлення та ідентифікації метаболітів продовжить цю тенденцію та розширить корисність екологічної метаболоміки для визначення пріоритетності забруднюючих речовин. Однак для широкого застосування метаболоміки в регуляторній токсикології залишається ряд проблем. На щастя, останнім часом зростання міжнародного інтересу до вирішення цих проблем триває і робить великі успіхи в різних сферах застосування.
Посилання
Банді, Дж. Г., Сідху, Дж. К., Рана, Ф., Сперджен, Дж., Свендсен, С., Рен, Дж. Ф., Стурзенбаум, С.Р., Морган, А.Дж., Кілль, П. (2008). Підхід «Системна токсикологія» визначає скоординовані метаболічні реакції на мідь у наземного немодельного безхребетного, дощового черв'яка Lumbricus rubellus. BMC Біологія, 6 (25), 1-21.
Банді, Дж. Г., Метью П. Дейві, М.П., Віант, М.Р. (2009). Метаболоміка навколишнього середовища: критичний огляд та перспективи майбутнього. Метаболоміка, 5, 3-21.
Джонсон, К.Х., Іванішевич, Дж., Сюздак, Г. Метаболоміка: поза біомаркерами та механізмами. Огляди природи, Молекулярна та клітинна біологія 17, 451-459.
Який тип молекул вимірюється за допомогою метаболоміки?
Протеїни
Малі молекули
гени
Полімери
Які типові області застосування екологічної метаболоміки?
Наведіть чотири основні елементи робочого процесу метаболоміки, і опишіть два більш детально?