16.4: Білки- полімери амінокислот
- Page ID
- 20722
- Визначте різні амінокислоти.
- Опишіть, як з амінокислот утворюються білки короткого ланцюга (поліпептиди).
Білки можуть бути визначені як сполуки високої молярної маси, що складаються в значній мірі або повністю з ланцюгів амінокислот. Їх маси коливаються від декількох тисяч до декількох мільйонів дальтонів (Да). Крім атомів вуглецю, водню і кисню, всі білки містять атоми азоту і сірки, а багато також містять атоми фосфору і сліди інших елементів. Білки виконують різноманітні ролі в живих організмах і часто класифікуються за цими біологічними ролями. М'язова тканина в значній мірі білкова, як і шкіра і волосся. Білки присутні в крові, в мозку і навіть в зубній емалі. Кожен тип клітин в нашому організмі виробляє свої спеціалізовані білки, а також білки, загальні для всіх або більшості клітин. Ми починаємо наше вивчення білків з розгляду властивостей і реакцій амінокислот, після чого йде обговорення того, як амінокислоти ковалентно зв'язуються з утворенням пептидів і білків. Закінчуємо главу обговоренням ферментів - білків, які діють як каталізатори в організмі.
Білки у всіх живих видів, від бактерій до людини, побудовані з одного набору з 20 амінокислот, так званих тому, що кожен містить аміногрупу, приєднану до карбонової кислоти. Амінокислоти в білках - це α-амінокислоти, а значить, аміногрупа приєднується до α-вуглецю карбонової кислоти. Людина може синтезувати лише близько половини необхідних амінокислот; решта повинна бути отримана з раціону і відомі як незамінні амінокислоти. Однак дві додаткові амінокислоти були виявлені в обмеженій кількості в білках: Селеноцистеїн був відкритий в 1986 році, а піролізин був відкритий в 2002 році.
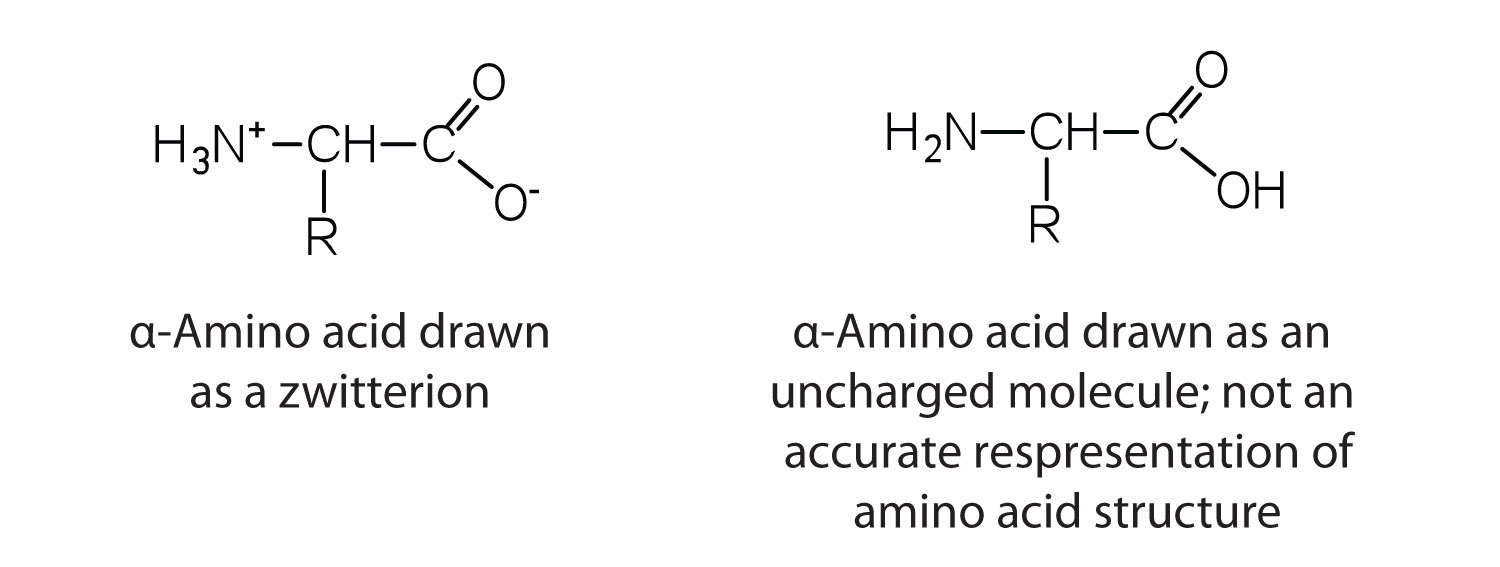
Амінокислоти являють собою безбарвні, нелеткі, кристалічні тверді речовини, що плавляться і розкладаються при температурі вище 200° С, ці температури плавлення більше схожі на температури неорганічних солей, ніж амінів або органічних кислот, і вказують на те, що структури амінокислот у твердому стані і в нейтральному рішення найкраще представити як мають як негативно заряджену групу, так і позитивно заряджену групу. Такий вид відомий як цвіттеріон.
Класифікація
Крім аміноі і карбоксильних груп, амінокислоти мають бічний ланцюг або групу R, прикріплену до α-вуглецю. Кожна амінокислота має унікальні характеристики, що виникають внаслідок розміру, форми, розчинності та іонізаційних властивостей її групи R. В результаті бічні ланцюги амінокислот надають глибокий вплив на структуру і біологічну активність білків. Хоча амінокислоти можна класифікувати різними способами, одним із поширених підходів є класифікація їх відповідно до того, чи функціональна група на бічному ланцюзі при нейтральному рН неполярна, полярна, але незаряджена, негативно заряджена або позитивно заряджена. Структури і назви 20 амінокислот, їх одно- і трилітерні скорочення, а також деякі їх відмінні риси наведені в табл\(\PageIndex{1}\).
| Загальна назва | Абревіатура | Структурна формула (при рН 6) | Молярна маса | Відмінна риса |
|---|---|---|---|---|
| Амінокислоти з неполярною групою R | ||||
| гліцин | глі (G) | 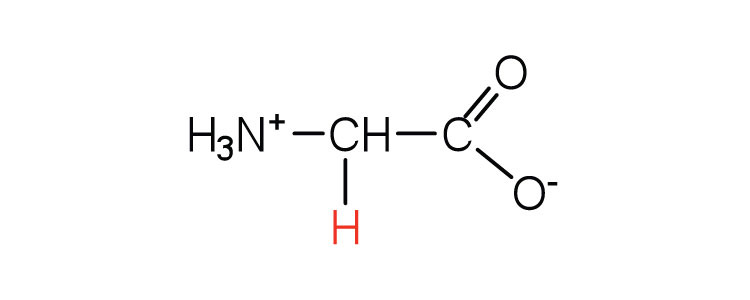 |
75 | єдина амінокислота не вистачає хірального вуглецю |
| аланін | ала (А) | 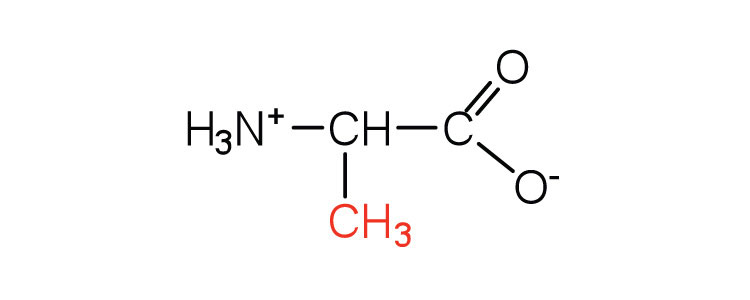 |
89 | — |
| валін | вал (V) | 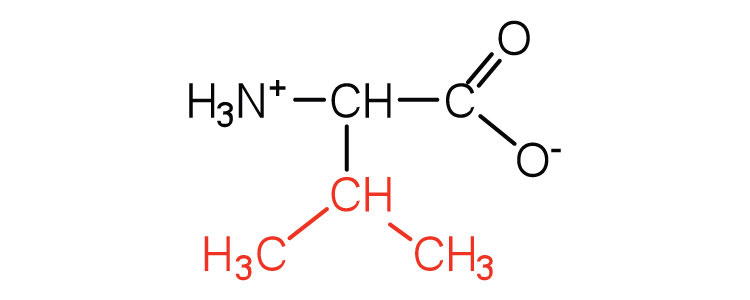 |
117 | амінокислота з розгалуженим ланцюгом |
| лейцин | лей (L) | 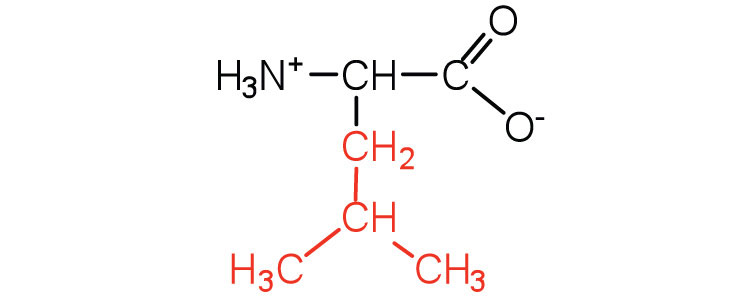 |
131 | амінокислота з розгалуженим ланцюгом |
| ізолейцин | файл (I) | 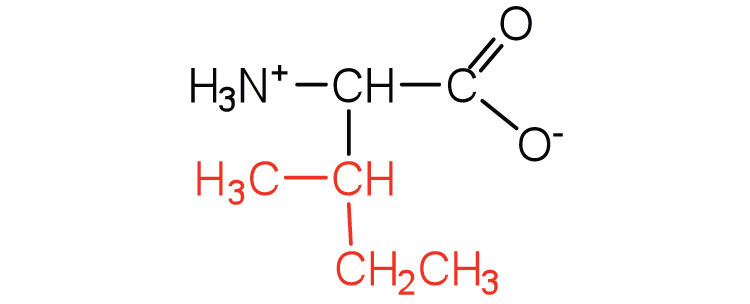 |
131 | незамінна амінокислота, оскільки більшість тварин не можуть синтезувати амінокислоти з розгалуженим ланцюгом |
| фенілаланін | фе (F) | 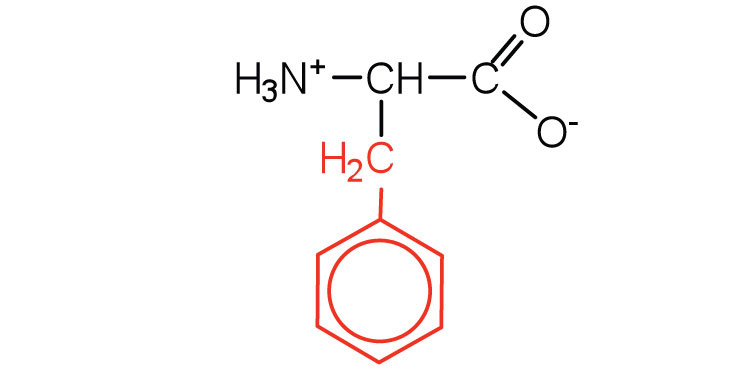 |
165 | також класифікується як ароматична амінокислота |
| триптофан | трп (Вт) | 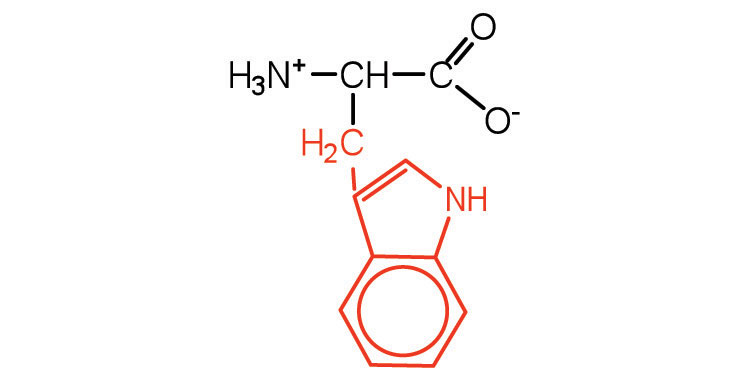 |
204 | також класифікується як ароматична амінокислота |
| метіонін | мет (М) | 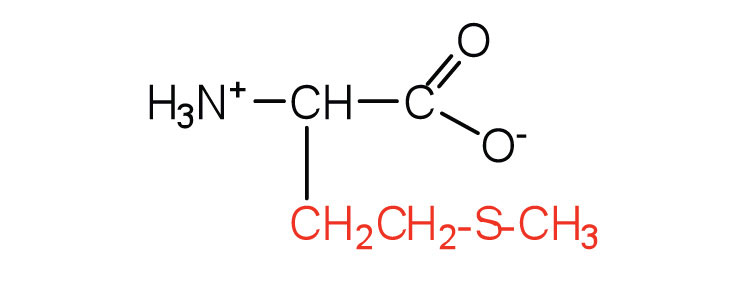 |
149 | функції бічного ланцюга як донор метильної групи |
| пролін | про (P) | 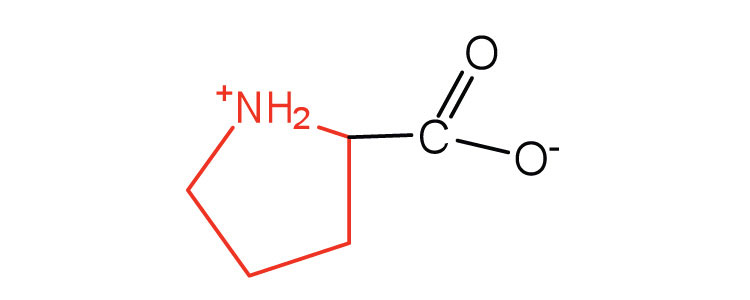 |
115 | містить вторинну амінну групу; іменується α-імінокислотою |
| Амінокислоти з полярною, але нейтральною групою R | ||||
| серин | сер (S) | 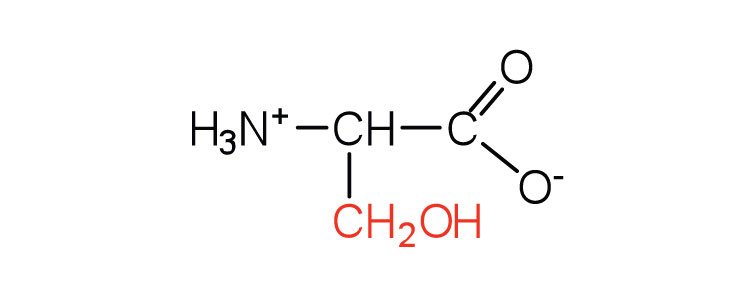 |
105 | виявлено на активному місці багатьох ферментів |
| треонін | тр (Т) | 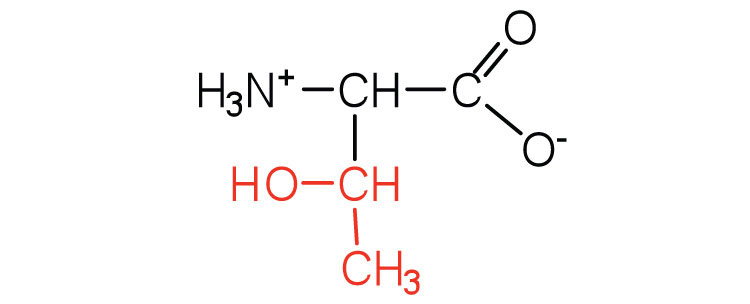 |
119 | названий за його схожість з цукровою треозою |
| цистеїн | cys (C) | 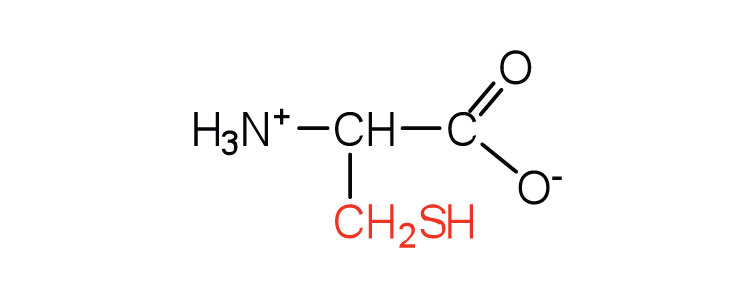 |
121 | окислення двох молекул цистеїну дає цистин |
| тирозину | тир (Y) | 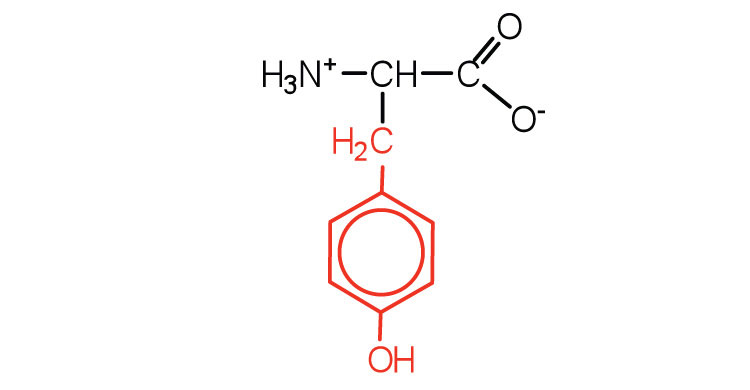 |
181 | також класифікується як ароматична амінокислота |
| аспарагін | asn (N) | 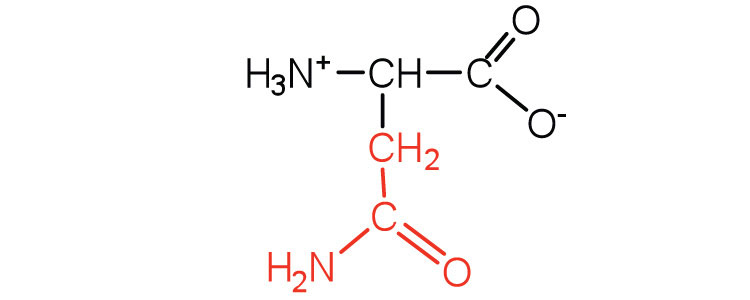 |
132 | амід аспарагінової кислоти |
| глютамін | глн (Q) | 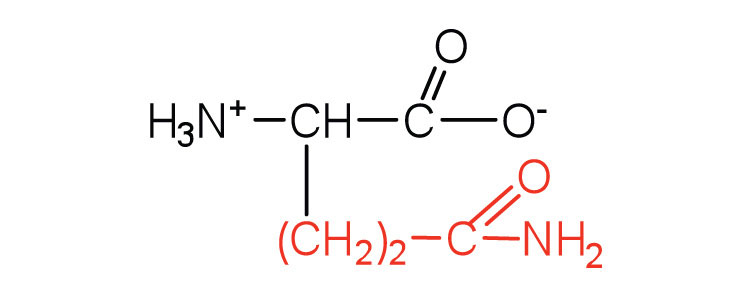 |
146 | амід глутамінової кислоти |
| Амінокислоти з негативно зарядженою групою R | ||||
| аспарагінова кислота | жерех (D) | 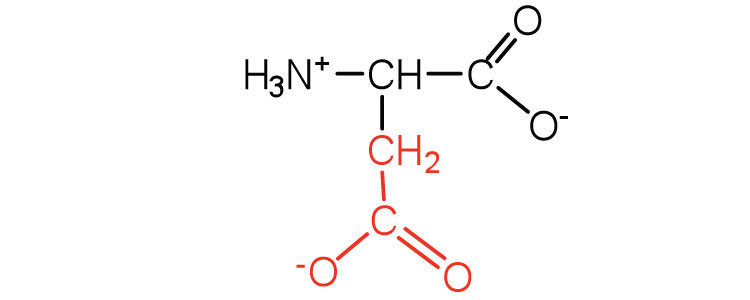 |
132 | карбоксильні групи іонізуються при фізіологічному рН; також відомий як аспартат |
| глутамінова кислота | клей (E) | 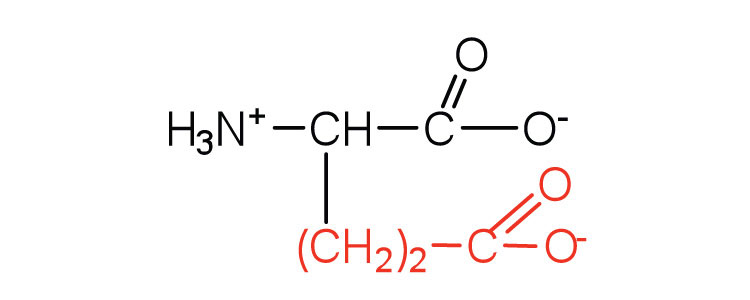 |
146 | карбоксильні групи іонізуються при фізіологічному рН; також відомий як глутамат |
| Амінокислоти з позитивно зарядженою групою R | ||||
| гістидин | Це (H) | 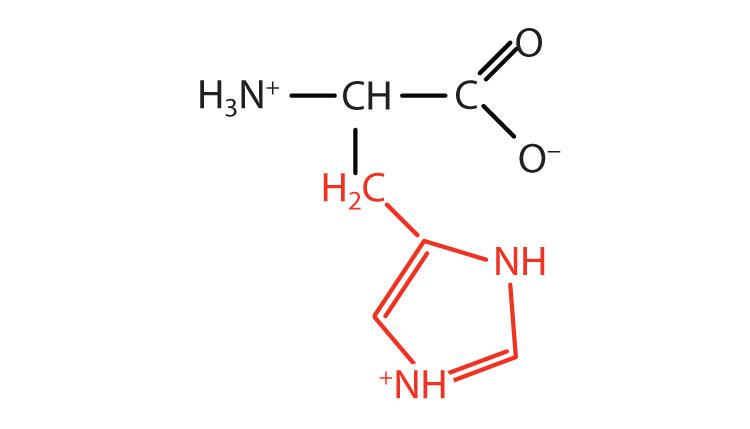 |
155 | єдина амінокислота, група R якої має pK a (6,0) поблизу фізіологічного рН |
| лізин | світло (K) | 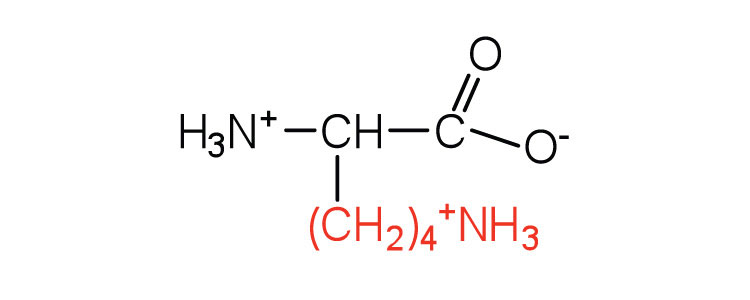 |
147 | — |
| аргінін | арг (R) | 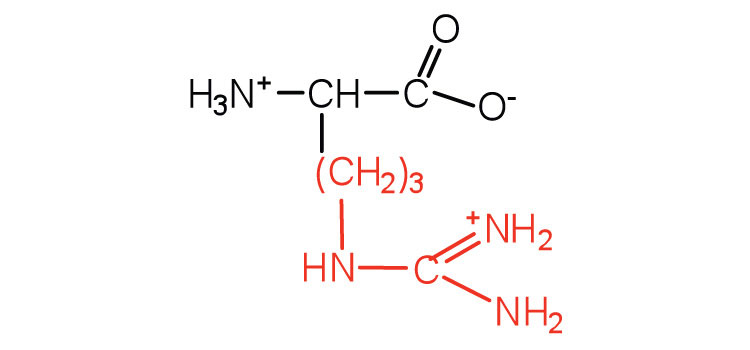 |
175 | майже така ж міцна основа, як гідроксид натрію |
Першою амінокислотою, яку потрібно було виділити, був аспарагін в 1806 році. Його отримували з білка, знайденого в спаржевому соку (звідси і назва). Гліцин, основна амінокислота, що міститься в желатині, був названий за його солодкий смак (грецьке glykys, що означає «солодкий»). У деяких випадках амінокислота, що міститься в білку, насправді є похідним однієї із загальних 20 амінокислот (однією з таких похідних є гідроксипролін). Модифікація відбувається після того, як амінокислота була зібрана в білок.
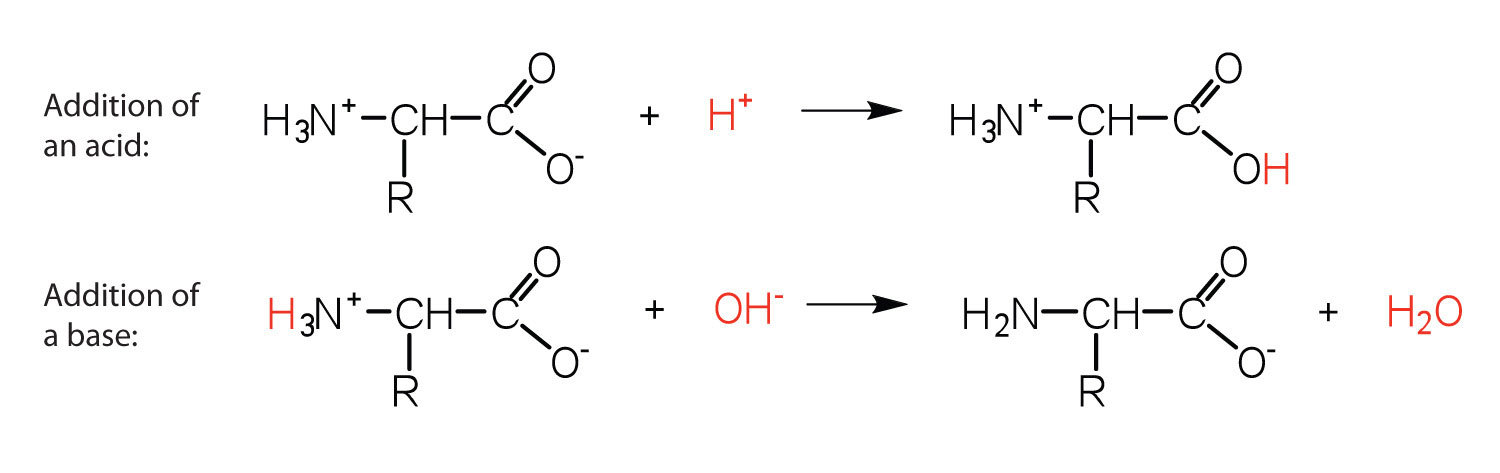
Цвіттеріони
Структура амінокислоти дозволяє їй виступати і кислотою, і основою. Амінокислота має цю здатність, тому що при певному значенні рН (різний для кожної амінокислоти) майже всі молекули амінокислот існують як zwitterions. Якщо кислоту додати в розчин, що містить цвіттеріон, карбоксилатна група захоплює іон водню (Н +), і амінокислота стає позитивно зарядженою. Якщо додати основу, іонне видалення іона Н + з аміногрупи цвіттеріона виробляє негативно заряджену амінокислоту. В обох обставин амінокислота діє для підтримки рН системи - тобто для видалення доданої кислоти (H +) або основи (OH -) з розчину.
Пептидний зв'язок: пептиди та білки
Дві або більше амінокислот можуть з'єднуватися між собою в ланцюги, звані пептидами. Раніше ми обговорювали реакцію між аміаком і карбоновою кислотою з утворенням аміду. При подібній реакції аміногрупа на одній молекулі амінокислоти вступає в реакцію з карбоксильною групою на інший, виділяючи молекулу води і утворюючи амідний зв'язок, як показано на малюнку.\(\PageIndex{1}\)
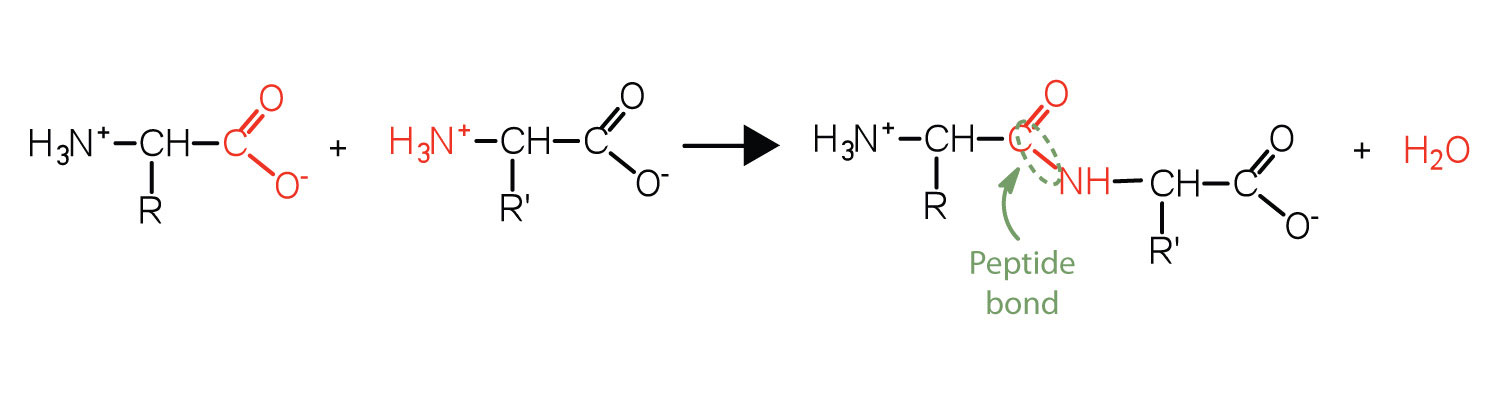
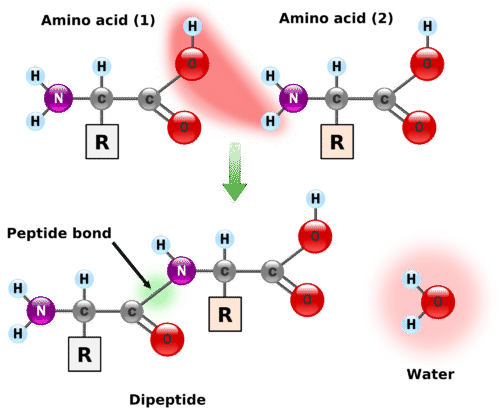
Амідний зв'язок, що з'єднує дві амінокислотні одиниці, називається пептидним зв'язком. Зверніть увагу, що молекула продукту все ще має реактивну аміногрупу зліва і реактивну карбоксильну групу праворуч. Вони можуть реагувати з додатковими амінокислотами, щоб подовжити пептид. Процес може тривати до тих пір, поки не приєднаються тисячі одиниць, в результаті чого утворюються великі білки.
Ланцюг, що складається всього з двох амінокислотних одиниць, називається дипептидом; ланцюг, що складається з трьох, - трипептид. За умовністю пептидні і білкові структури зображуються з амінокислотою, аміногрупа якої вільна (N-кінцевий кінець) зліва і амінокислотою з вільною карбоксильною групою (C-кінцевий кінець) праворуч.
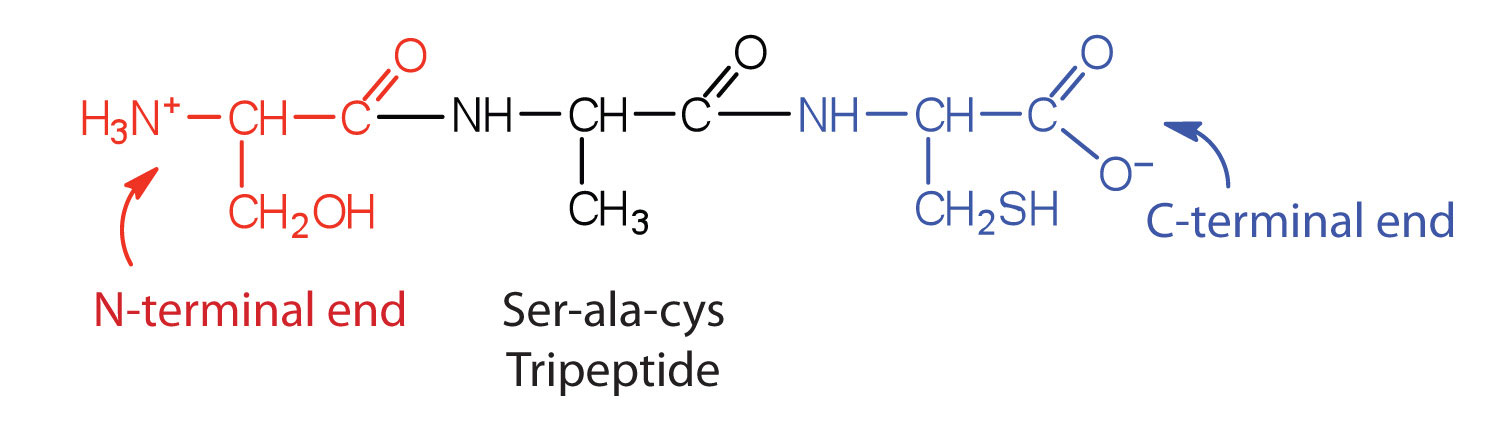
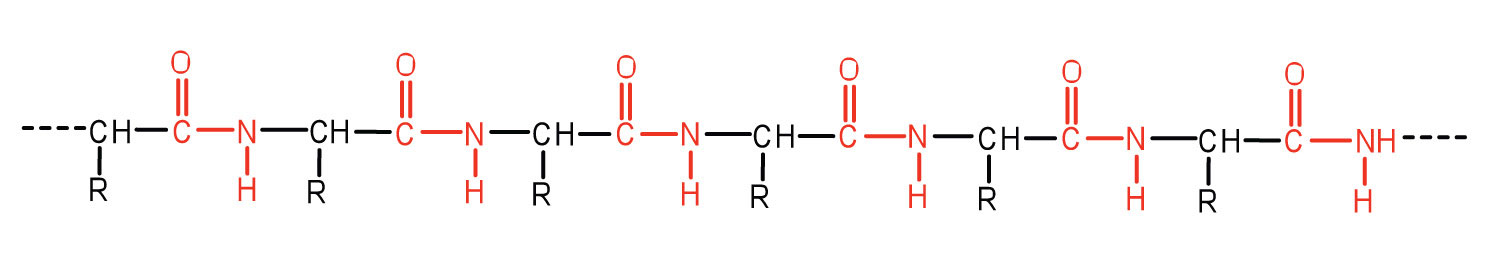
Загальний термін пептид відноситься до амінокислотного ланцюга невизначеної довжини. Однак ланцюги приблизно з 50 амінокислот і більше зазвичай називають білками або поліпептидами. У своїй фізіологічно активній формі білок може складатися з однієї або декількох поліпептидних ланцюгів.
Пептидні клітини в нашому організмі мають хитромудрий механізм виготовлення білків. Людям доводиться використовувати інші методи, щоб синтезувати ті ж самі білки в лабораторії. Хімія синтезу пептидів ускладнена. Обидві активні групи на амінокислоту можуть реагувати, і послідовність амінокислот повинна бути специфічною для того, щоб білок функціонував. Роберт Мерріфілд розробив перший синтетичний підхід для виготовлення білків в лабораторії, ручний підхід, який був тривалим і виснажливим (і, він отримав Нобелівську премію з хімії в 1984 році за свою роботу). Однак сьогодні автоматизовані системи можуть викрутити пептид за дуже короткий проміжок часу.
Послідовність амінокислот
Особлива послідовність амінокислот в більш довгій ланцюжку називається амінокислотної послідовністю. За умовністю послідовність амінокислот вказана в такому порядку, що вільна амінна група знаходиться на лівому кінці молекули, а вільна карбоксильна група - на правому кінці молекули.
Наприклад, припустимо, що послідовність амінокислот гліцину, триптофану та аланіну утворюється з групою вільних амінів у складі гліцину та вільної карбоксильної групи у складі аланіну. Послідовність амінокислот може бути легко написана за допомогою абревіатур Gly-Trp-Ala. Це інша послідовність від Ала-Trp-Gly, оскільки вільні амінні та карбоксильні групи будуть знаходитися на різних амінокислотах у цьому випадку.
Щоб пептиди та білки були фізіологічно активними, недостатньо, щоб вони включали певну кількість специфічних амінокислот. Порядок, або послідовність, в якій з'єднуються амінокислоти, також має вирішальне значення. Брадикінін - це дев'ятиамінокислотний пептид (рис.\(\PageIndex{2}\)), що виробляється в крові, який має наступну амінокислотну послідовність:
Арг-про-глі-phe-сер-про-PH-ARG
Цей пептид знижує артеріальний тиск, стимулює гладку м'язову тканину, підвищує проникність капілярів, викликає біль. Коли порядок амінокислот в брадикініні змінюється,
Арг-phe-про-сер-PH-глі-про-арг
пептид, отриманий в результаті цього синтезу, не показує жодної активності брадикініну.
Подібно до того, як мільйони різних слів пишуться нашим 26-буквенним англійським алфавітом, мільйони різних білків виготовляються з 20 поширеними амінокислотами. Однак так само, як англійський алфавіт може бути використаний для написання тарабарства, амінокислоти можуть бути зібрані в неправильній послідовності для отримання нефункціональних білків. Хоча правильна послідовність зазвичай має першорядне значення, вона не завжди абсолютно потрібна. Так само, як іноді можна зрозуміти неправильно написані англійські слова, білок з невеликим відсотком «неправильних» амінокислот може продовжувати функціонувати. Однак він рідко функціонує так само, як і білок, що має правильну послідовність. Існують також випадки, коли, здавалося б, незначні помилки послідовності мають згубні наслідки. Наприклад, у деяких людей кожна молекула гемоглобіну (білка в крові, який транспортує кисень) має єдину неправильну амінокислотну одиницю з приблизно 300 (один валін замінює глутамінову кислоту). Ця «незначна» помилка відповідає за серповидноклітинну анемію, успадкований стан, який зазвичай є фатальним.
Намалюйте поліпептид Asp-Val-Ser.
Рішення
1. Визначте структури кожної з трьох заданих амінокислот і намалюйте їх у тому ж порядку, що наведено в назві.
2. Залишивши порядок колишнім, з'єднайте амінокислоти один з одним, утворюючи пептидні зв'язки. Зауважимо, що порядок, вказаний в назві, є таким же чином, як амінокислоти з'єднуються в молекулі. Першим з перерахованих завжди є\(\ce{N}\) -кінцевий поліпептид.
Перерахуйте всі можливі поліпептиди, які можуть утворюватися з цистеїну (Cys), лейцину (Leu) та аргініну (Arg).
Рішення
Хоча існує всього три амінокислоти, порядок їх зв'язку змінює ідентичність, властивості та функцію отриманого поліпептиду. З цих трьох амінокислот утворюються шість можливих поліпептидів.
Цис-Лей-Арг
Цис-Арг-Лей
Лей-Кіс-Арг
Леу-Арг-Сіс
Арг-Cys-Лей
Арг-Лей-Сіс
Намалюйте структуру для кожного пептиду.
- глі-валь
- валь-гли
Відповіді
а.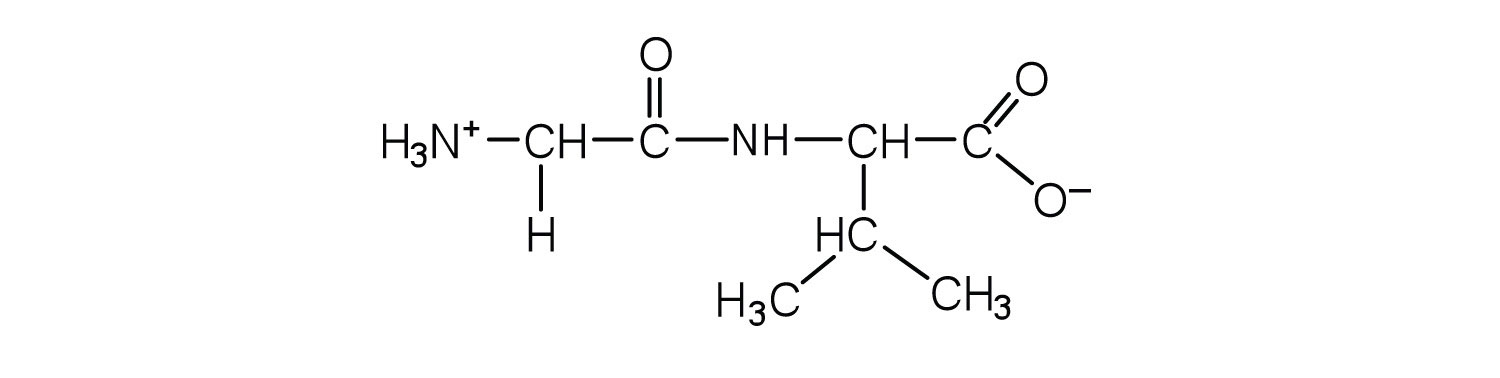
б.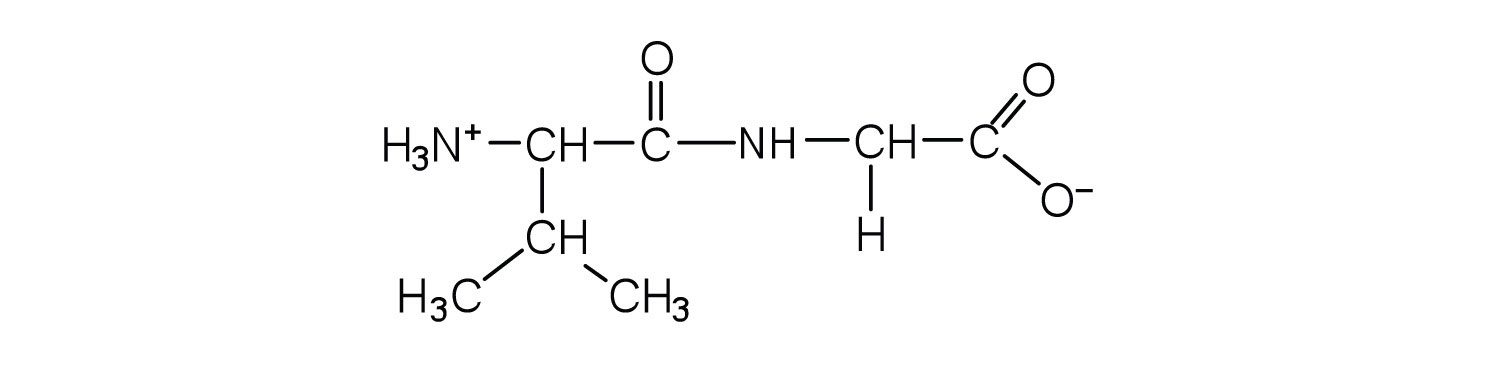
Резюме
- Аміногрупа однієї амінокислоти може реагувати з карбоксильною групою на іншу амінокислоту, утворюючи пептидний зв'язок, який пов'язує дві амінокислоти разом.
- Додаткові амінокислоти можуть бути додані шляхом утворення добавок пептидних (амідних) зв'язків.
- Ланцюг, що складається всього з двох амінокислотних одиниць, називається дипептидом; ланцюг, що складається з трьох, - трипептид.
- Ланцюжки близько 50 амінокислот і більше зазвичай називають білками або поліпептидами.
- Послідовність амінокислот у пептиді або білку записується з N-кінцевою амінокислотою спочатку і C-кінцевою амінокислотою в кінці (запис зліва направо).
- Порядок, або послідовність, в якій амінокислоти з'єднані, також має вирішальне значення для того, щоб пептид або білок були фізіологічно активними.
Автори та атрибуція
- Libretext: The Basics of GOB Chemistry (Ball et al.)
- Template:ContribCK12
- Template:ContribSoult
- Template:ContribAgnewM


