16.5: Будова і функції білків
- Опишіть чотири рівні структури білка.
- Визначте типи привабливих взаємодій, які утримують білки в їх найбільш стабільній тривимірній структурі
- Поясніть роль ферменту в організмі.
Кожен з тисяч природних білків має свій характерний амінокислотний склад і послідовність, що призводить до унікальної тривимірної форми. Починаючи з 1950-х років, вчені визначили послідовності амінокислот і тривимірну конформацію численних білків і таким чином отримали важливі підказки про те, як кожен білок виконує свою специфічну функцію в організмі.
Білки - це сполуки високої молярної маси, що складаються в значній мірі або повністю з ланцюгів амінокислот. Через їх велику складність молекули білка не можна класифікувати на основі специфічної структурної подібності, оскільки вуглеводи та ліпіди класифікуються. Дві основні структурні класифікації білків засновані на набагато більш загальних якостях: чи є білок (1) волокнистоподібним і нерозчинним або (2) кулястим і розчинним. Деякі білки, такі як ті, що складають волосся, шкіру, м'язи та сполучну тканину, схожі на волокна. Ці волокнисті білки нерозчинні у воді і зазвичай виконують структурну, сполучну та захисну функції. Прикладами волокнистих білків є кератини, колагени, міозини та еластини. Волосся і зовнішній шар шкіри складаються з кератину. Сполучні тканини містять колаген. Міозини є м'язовими білками і здатні скорочуватися і розширюватися. Еластини знаходяться в зв'язках і еластичній тканині стінок артерій.
Кулькові білки, інший основний клас, розчинні у водних середовищах. У цих білках ланцюги складаються так, що молекула в цілому приблизно куляста. Знайомі приклади включають яєчний альбумін з яєчних білків і сироватковий альбумін в крові. Сироватковий альбумін відіграє головну роль у транспортуванні жирних кислот і підтримці належного балансу осмотичного тиску в організмі. Гемоглобін і міоглобін, які важливі для зв'язування кисню, також є кулястими білками.
Рівні структури білка
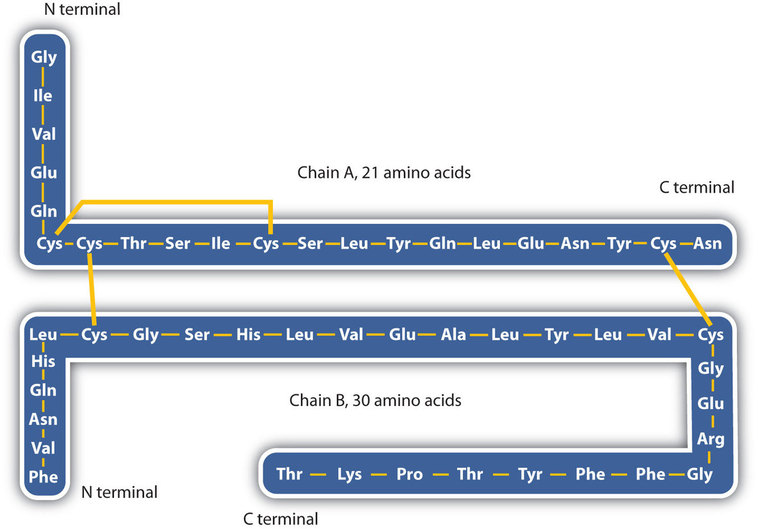
Структура білків, як правило, описується як має чотири організаційні рівні. Перший з них - це первинна структура, яка є кількістю і послідовністю амінокислот в поліпептидному ланцюгу або ланцюгах білка, починаючи з вільної аміногрупи і підтримуваних пептидними зв'язками, що з'єднують кожну амінокислоту з наступною. Первинна структура інсуліну, що складається з 51 амінокислоти, показана на рис16.5.1.
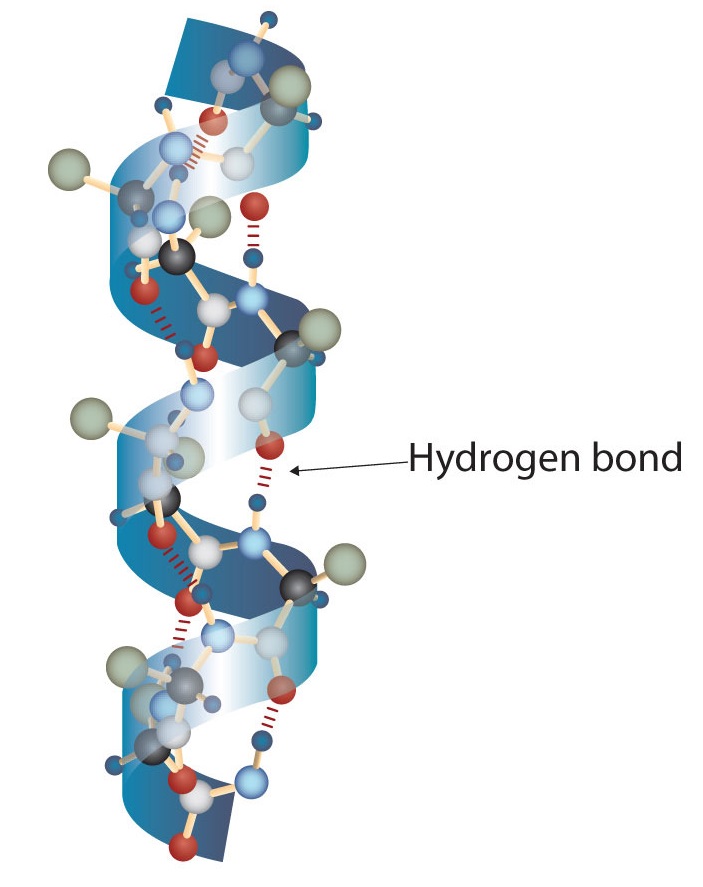
Молекула білка - це не випадковий клубок поліпептидних ланцюгів. Натомість ланцюги розташовані в унікальних, але специфічних конформаціях. Термін вторинна структура відноситься до фіксованого розташування поліпептидного хребта. На підставі рентгенівських досліджень Лінус Полінг і Роберт Корі постулювали, що певні білки або порції білків скручуються в спіраль або спіраль. Ця спіраль стабілізується внутрішньоланцюговим водневим зв'язком між атомом карбонільного кисню однієї амінокислоти і амідним атомом водню чотирма амінокислотами вгору по ланцюгу (розташований на наступному витку спіралі) і відома як правостороння α-спіраль. Дані рентгенівського випромінювання вказують на те, що ця спіраль робить один оборот на кожні 3,6 амінокислоти, і бічні ланцюги цих амінокислот проектують назовні від згорнутого хребта (рис.16.5.2). α-кератини, що містяться у волоссі та шерсті, є виключно α-спіральними в конформації. Деякі білки, такі як гамма-глобулін, хімотрипсин і цитохром с, мають мало або взагалі не мають спіральної структури. Інші, такі як гемоглобін і міоглобін, є спіральними в певних регіонах, але не в інших.
Іншим поширеним типом вторинної структури, званої β-плісированою конформацією листа, є листоподібне розташування, в якому дві або більше розширених поліпептидних ланцюгів (або окремих областей на одному ланцюзі) вирівнюються поруч. Вирівняні сегменти можуть працювати як паралельно, так і антипаралельно - тобто N-клеми можуть стикатися в одному напрямку на сусідніх ланцюгах або в різних напрямках - і з'єднані міжланцюговим водневим зв'язком (рис.16.5.3). β-плісировані лист особливо важливий в структурних білків, таких як фіброин шовку. Він також спостерігається в порціях багатьох ферментів, таких як карбоксипептидаза А та лізоцим.

Третинна структура відноситься до унікальної тривимірної форми білка в цілому, яка виникає в результаті згортання і згинання білкового хребта. Третинна структура тісно пов'язана з правильним біохімічним функціонуванням білка. 16.5.4На малюнку показано зображення тривимірної структури інсуліну.

Чотири основні типи привабливих взаємодій визначають форму і стабільність третинної структури білків.
Ви вивчали кілька з них раніше.
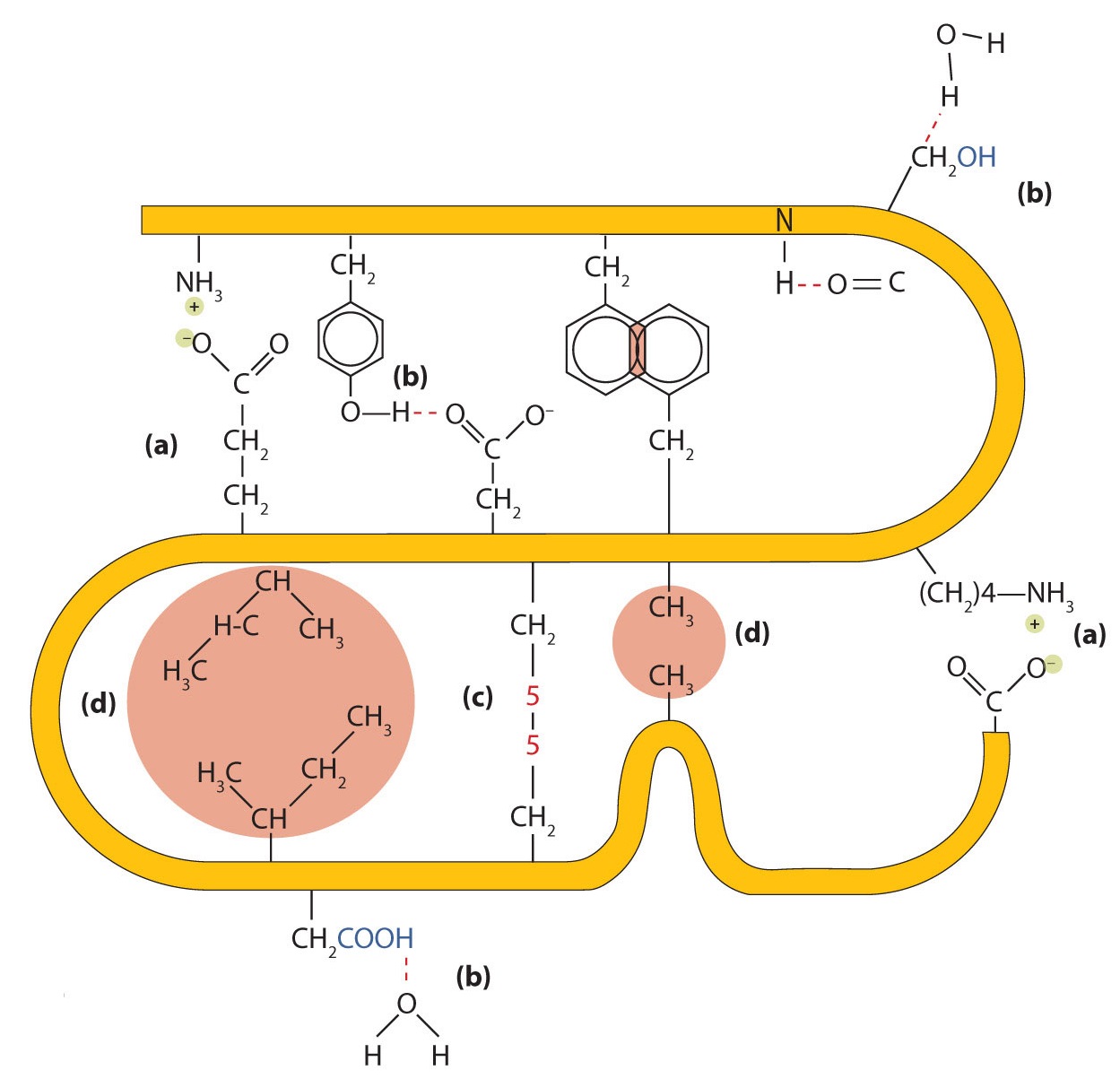
- Іонне склеювання. Іонні зв'язки виникають внаслідок електростатичних атракціонів між позитивно і негативно зарядженими бічними ланцюгами амінокислот. Наприклад, взаємне тяжіння між іоном карбоксилату аспарагінової кислоти та іоном амонію лізину допомагає підтримувати певну складчасту площу білка (частина (а) малюнка16.5.5).
- Водневе зв'язування. Водневий зв'язок утворюється між високоелектронегативним атомом кисню або атомом азоту та атомом водню, приєднаним до іншого атома кисню або атомом азоту, таким як ті, що знаходяться в бічних ланцюгах полярних амінокислот. Водневе зв'язування (а також іонні атракціони) надзвичайно важливо як у внутрішньо-, так і в міжмолекулярних взаємодіях білків (частина (b) рисунка16.5.5).
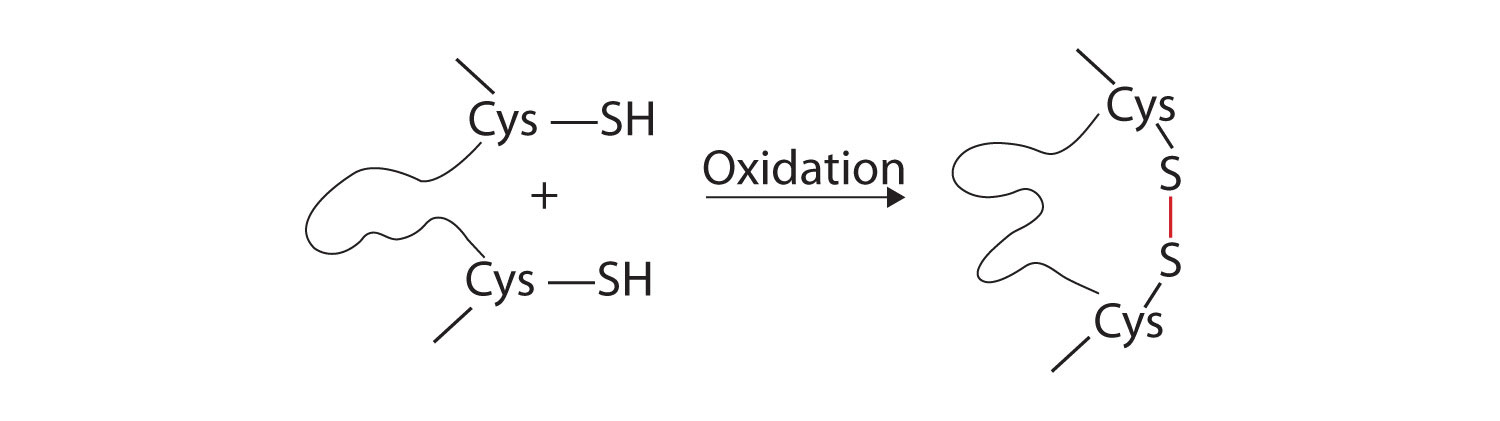
- Дисульфідні зв'язки. Дві одиниці амінокислоти цистеїну можуть бути зведені близько один до одного, коли молекула білка складається. Подальше окислення і зчеплення атомів сірки в високореактивних сульфгідрильних (SH) групах призводить до утворення цистину (частина (с) рис.16.5.5). Внутрішньоланцюгові дисульфідні зв'язки знаходяться в багатьох білках, включаючи інсулін (жовті батончики на малюнку16.5.1) і надають сильну стабілізуючу дію на третинну структуру.
- Сили дисперсії. Сили дисперсії виникають, коли нормально неполярний атом стає на мить полярним через нерівномірний розподіл електронів, що призводить до миттєвого диполя, який індукує зсув електронів в сусідньому неполярному атомі. Сили дисперсії слабкі, але можуть бути важливими, коли інші типи взаємодій або відсутні, або мінімальні (частина (d) малюнка16.5.5). Це стосується фіброїну, основного білка в шовку, в якому висока частка амінокислот в білку мають неполярні бічні ланцюги. Термін гідрофобна взаємодія часто використовується як синонім сил дисперсії. Гідрофобні взаємодії виникають через те, що молекули води беруть участь у зв'язку водню з іншими молекулами води (або групами в білках, здатних до водневого зв'язку). Оскільки неполярні групи не можуть займатися водневим зв'язком, білок складається таким чином, що ці групи закопуються у внутрішню частину білкової структури, мінімізуючи їх контакт з водою.
Коли білок містить більше одного поліпептидного ланцюга, кожен ланцюг називається субодиницею. Розташування множинних субодиниць являє собою четвертий рівень структури, четвертинну структуру білка. Гемоглобін, з чотирма поліпептидними ланцюгами або субодиницями, є найбільш часто наведеним прикладом білка, що має четвертинну структуру (рис.16.5.6). Четвертинна структура білка виробляється і стабілізується тими ж видами взаємодій, які виробляють і підтримують третинну структуру. Схематичне зображення чотирьох рівнів структури білка знаходиться на рис16.5.7.
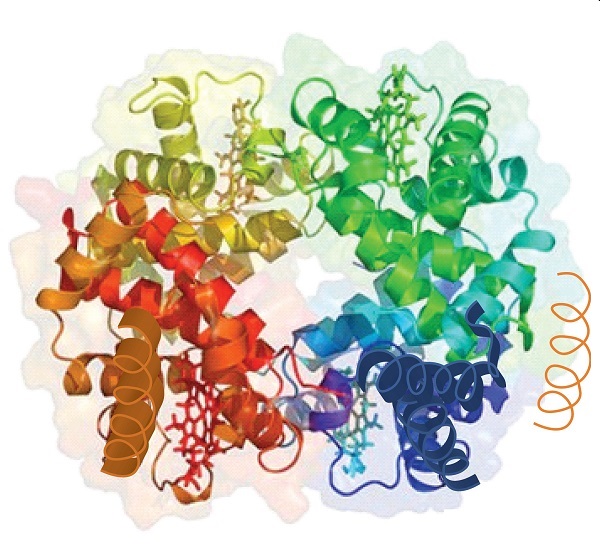
Джерело: Зображення з PDB RCSB PDB (www.pdb.org) PDB ID 1I3D (R.D. Kidd, H.M. Baker, A.J. Mathews, T. Brittain, E.N. Baker (2001) Олігомеризація та зв'язування лігандів в гомотетрамерному гемоглобіні: дві кристалічні структури гемоглобіну Барта з високою роздільною здатністю (гамма (4)), маркер альфа-таласемії. Протеїнові науки 1739—1749).

Первинна структура складається з конкретної амінокислотної послідовності. Отримана пептидна ланцюг може скручуватися в α-спіраль, яка є одним з видів вторинної структури. Цей гвинтовий сегмент включений в третинну структуру складчастої поліпептидного ланцюга. Єдиний поліпептидний ланцюг - це субодиниця, яка становить четвертинну структуру білка, такого як гемоглобін, який має чотири поліпептидні ланцюга.
Глобулярні і волокнисті білки
Після того, як білки утворюються і розвинуть всі рівні своєї структури, їх можна класифікувати як волокнисті або кулясті. Ці класифікації надають основну форму всієї молекули білка. У той час як багато білків є кулястими білками (див. Малюнок нижче), білки кератину є волокнистими (див. Малюнок нижче) і складають волосся, нігті та зовнішній шар шкіри.


Ферменти: Вишукані прецизійні машини
Перший фермент, який потрібно виділити, був відкритий в 1926 році американським хіміком Джеймсом Самнером, який кристалізував білок. Ферментом була уреаза, яка каталізує гідролітичний розпад сечовини, компонента сечі, на аміак і вуглекислий газ.
H2NCON2(aq)+H2O(l)urease→2NH3(g)+CO2(g)
Його відкриття спочатку було висміяно, тому що ніхто не вірив, що ферменти будуть вести себе так само, як і інші хімічні речовини. Самнер врешті-решт виявився правильним і отримав Нобелівську премію з хімії в 1946 році.
Ферменти і біохімічні реакції
Більшість хімічних реакцій всередині організмів були б неможливі в умовах клітин. Наприклад, температура тіла більшості організмів занадто низька, щоб реакції відбувалися досить швидко, щоб здійснювати життєві процеси. Реагенти також можуть бути присутніми в таких низьких концентраціях, що навряд чи вони зустрінуться і зіткнуться. Тому швидкість більшості біохімічних реакцій повинна бути збільшена каталізатором. Каталізатор - це хімічна речовина, що прискорює хімічні реакції. В організмах каталізатори називаються ферментами. По суті, ферменти є біологічними каталізаторами.
Як і інші каталізатори, ферменти не є реагентами в реакціях, які вони контролюють. Вони допомагають реагентам взаємодіяти, але не витрачаються в реакціях. Натомість вони можуть використовуватися знову і знову. На відміну від інших каталізаторів, ферменти, як правило, дуже специфічні для конкретних хімічних реакцій. Вони, як правило, каталізують лише один або кілька типів реакцій.
Ферменти надзвичайно ефективні в прискоренні реакцій. Вони можуть каталізувати до декількох мільйонів реакцій в секунду. В результаті різниця в швидкостях біохімічних реакцій з ферментами і без них може бути величезною. Типова біохімічна реакція може зайняти години або навіть дні, щоб відбутися в нормальних клітинних умовах без ферменту, але менше секунди з ферментом.
На малюнку16.5.10 діаграми типова ферментативна реакція. Субстрат - це молекула або молекули, на які діє фермент. У реакції, що каталізується уреазою, сечовина є субстратом.

Першим кроком реакції є те, що субстрат зв'язується з певною частиною молекули ферменту, відомої як активний сайт. Зв'язування субстрату продиктовано формою кожної молекули. Бічні ланцюги на ферменті взаємодіють з субстратом певним чином, в результаті чого утворюються і розриваються зв'язки. Активна ділянка - це місце на ферменті, де субстрат зв'язується. Фермент складається таким чином, що він зазвичай має одну активну ділянку, зазвичай кишеню або щілину, утворену складним малюнком білка. Оскільки активна ділянка ферменту має таку унікальну форму, тільки один конкретний субстрат здатний зв'язуватися з цим ферментом. Іншими словами, кожен фермент каталізує тільки одну хімічну реакцію тільки з одним субстратом. Як тільки ферментно-субстратний комплекс утворюється, відбувається реакція і субстрат перетворюється в продукти. Нарешті, молекула продукту або молекули звільняються з активної ділянки. Зверніть увагу, що фермент не зазнає впливу реакції і тепер здатний каталізувати реакцію іншої молекули субстрату.
Для багатьох ферментів активний сайт дотримується моделі блокування та ключа (рис.16.5.11A ), де субстрат точно вписується в активну ділянку. Фермент і субстрат повинні ідеально поєднуватися, тому фермент функціонує лише як каталізатор для однієї реакції. Інші ферменти мають індуковану модель прилягання (рис.16.5.11B ). У моделі індукованої посадки активний сайт може вносити незначні корективи для розміщення підкладки. Це призводить до утворення ферменту, який здатний взаємодіяти з невеликою групою подібних субстратів. Подивіться на форму активної ділянки в порівнянні з формою субстрату в B на малюнку нижче. Активна ділянка підлаштовується під розміщення субстрату.

Інгібітори
Інгібітор - це молекула, яка перешкоджає функції ферменту, або уповільнюючи, або зупиняючи хімічну реакцію. Інгібітори можуть працювати різними способами, але один з найпоширеніших проілюстрований на малюнку нижче.

Конкурентний інгібітор конкурентно зв'язується на активному місці і блокує субстрат від зв'язування. Оскільки ніякої реакції з інгібітором не відбувається, фермент не дозволяє каталізувати реакцію.
Неконкурентний інгібітор не зв'язується на активній ділянці. Він прикріплюється в алостеричному місці, який є якимось іншим ділянкою на ферменті, і змінює форму білка. Аллостеричний сайт - це будь-яка ділянка на ферменті, яка не є активною ділянкою. Приєднання неконкурентного інгібітора до аллостеричного сайту призводить до зрушення тривимірної структури, що змінює форму активної ділянки, так що субстрат більше не буде належним чином вписуватися в активну ділянку (див. Малюнок нижче).

Кофактори та коферменти
Деякі ферменти вимагають наявності іншого субстрату в якості молекули «помічника», щоб нормально функціонувати. У цій ролі виступають кофактори і коферменти. Кофакторами є неорганічні види, а коферменти - невеликі органічні молекули. Багато вітамінів, таких як вітаміни групи В, є коферментами. Деякі іони металів, які функціонують як кофактори для різних ферментів, включають цинк, магній, калій та залізо.
Каталітична активність ферментів
Ферменти, як правило, знижують енергію активації, зменшуючи енергію, необхідну для того, щоб реагенти зібралися та реагували. Одним із способів дії ферментів є об'єднання реагентів (субстратів), щоб їм не довелося витрачати енергію, що рухається, поки вони не зіткнуться випадковим чином. Ферменти зв'язують обидві молекули реагентів (субстрати), щільно і конкретно, в місці на активній ділянці ферменту. Ферменти також можуть приносити молекули до активної ділянки, щоб розбити їх. Наприклад, сахароза є ферментом для розщеплення сахарози, яка потрапляє в активну ділянку ферменту і сприяє послабленню взаємодії між фруктозою і глюкозою, що входять до складу сахарози. Сахараза специфічна для розщеплення сахарози, як і більшість ферментів. Активна ділянка специфічна для реагентів біохімічної реакції, яку фермент каталізує. Подібно до частин головоломки, що підходять один до одного, активний сайт може зв'язувати лише певні субстрати. Діяльність ферментів також залежить від температури, концентрації та рН оточуючих.
Концентрація
Як і в більшості реакцій, концентрація реагенту (ів) впливає на швидкість реакції. Це справедливо і в концентрації ферментів. Коли концентрація субстрату або ферменту низька, швидкість реакції буде повільнішою, ніж там, де є більш високі концентрації. Два види повинні взаємодіяти для реакції, і більш високі концентрації одного або обох призведуть до більш ефективної взаємодії між ними.
Однак продовження збільшення концентрації субстрату не завжди збільшить швидкість реакції. Це пов'язано з тим, що в якийсь момент всі ферменти будуть зайняті і недоступні для зв'язування з іншою молекулою субстрату, поки субстрат не утворює молекулу продукту і не звільниться від ферменту.
рН
Деякі ферменти найкраще працюють при кислотних рН, тоді як інші найкраще працюють в нейтральних середовищах. Наприклад, травні ферменти, що виділяються в кислому середовищі (низький рН) шлунка, допомагають розщеплювати білки на більш дрібні молекули. Основним травним ферментом в шлунку є пепсин, який найкраще працює при рН близько 1,5. Ці ферменти не працювали б оптимально при інших рН. Трипсин - ще один фермент в травній системі, який розбиває білкові ланцюги в їжі на більш дрібні частинки. Трипсин працює в тонкому кишечнику, який не є кислим середовищем. Оптимальний рН трипсину становить близько 8.
Різні реакції і різні ферменти дозволять досягти своєї максимальної швидкості при певних значеннях рН. Як показано на малюнку нижче, фермент досягає максимальної швидкості реакції при рН 4. Зверніть увагу, що реакція триватиме при нижчих і вищих значеннях рН, оскільки фермент все ще буде функціонувати при інших значеннях рН, але не буде настільки ефективним. При дуже високих або дуже низьких значеннях рН відбудеться денатурація, оскільки фермент - це просто білок з певною функцією.

Температура
Як і у випадку з рН, реакції також мають ідеальну температуру, де фермент функціонує найбільш ефективно. Він все одно буде функціонувати при більш високих і нижчих температурах, але швидкість буде менше. Для багатьох біологічних реакцій ідеальною температурою є фізіологічні умови, навколо37oC яких знаходиться нормальна температура тіла. Багато ферменти втрачають функцію при більш низьких і високих температурах. При більш високих температурах форма ферменту погіршується. Тільки коли температура приходить в норму, фермент повертає свою форму і нормальну активність, якщо температура не була настільки високою, що спричинила незворотні пошкодження.

Застосування ферментів
Ферменти використовуються в та інших промислових застосуваннях, коли потрібні надзвичайно специфічні каталізатори (табл.16.5.1). Ферменти в цілому обмежені в кількості реакцій, які вони еволюціонували для каталізації, а також через відсутність стабільності при високих температурах і при них. Як наслідок, є активною областю досліджень і передбачає спроби створення нових ферментів з новими властивостями, або за допомогою раціонального дизайну, або еволюції in vitro. Ці зусилля почали бути успішними, і кілька ферментів зараз розроблені «з нуля» для каталізації реакцій, які не відбуваються в природі.
| Заявка | Використовувані ферменти | Використовує |
|---|---|---|
| Біопаливна промисловість | целюлази | Розщеплюйте целюлозу на цукри, які можна ферментувати для отримання целюлозного етанолу. |
| лігнінази | Попередня обробка біомаси для виробництва біопалива. | |
| Біологічний миючий засіб | Протеази, амілази, ліпази | Видаліть білки, крохмаль, жир або масляні плями з білизни та посуду. |
| Маннанаси | Видаліть харчові плями від звичайної харчової добавки гуарова камедь. | |
| Пивоварна промисловість | Амілаза, глюканази, протеази | Розщеплюють полісахариди і білки в солоді. |
| Бета-глюкоканази | Поліпшити характеристики фільтрації сусла та пива. | |
| Амілоглюкоздаза і пуллуланази | Зробіть низькокалорійне пиво і відрегулюйте бродильність. | |
| Ацетолакатат декарбоксилаза (ALDC) | Підвищити ефективність бродіння за рахунок зменшення утворення діацетилу. | |
| кулінарне використання | Папаїн | Тендерізуйте м'ясо для приготування. |
| Молочна промисловість | Ренін | Гідролізувати білок при виготовленні сиру. |
| Ліпази | Виробляють сир камамбер і блакитний сир, такий як Рокфор. | |
| Харчова промисловість | Амілази | Виробляють цукру з крохмалю, наприклад, при виготовленні кукурудзяного сиропу з високим вмістом фруктози. |
| Протеази | Знизити рівень білка борошна, як в бісквітному виробництві. | |
| Трипсин | Виготовляємо гіпоалергенне дитяче харчування. | |
| Целюлази, пектинази | Уточнити фруктові соки. | |
| Молекулярна біологія | Нуклеази, ДНК-лігази та полімерази | Використовуйте рестрикційне травлення та полімеразну ланцюгову реакцію для створення рекомбінантної ДНК. |
| Паперова промисловість | Ксіланази, геміцелюлази та пероксидази лігніну | Видаліть лігнін з крафт-целюлози. |
| Особиста гігієна | Протеази | Видаліть білки на контактних лінзах, щоб запобігти інфекціям. |
| Крохмальна промисловість | Амілази | Перетворити крохмаль в глюкозу і різні сиропи. |
Резюме
- Білки можна розділити на дві категорії: волокнисті, які, як правило, нерозчинні у воді, і кулясті, які більш розчинні у воді. Білок може мати до чотирьох рівнів структури.
- Первинна структура складається з конкретної амінокислотної послідовності.
- Отриманий пептидний ланцюг може утворювати α-спіраль або β-плісировані лист (або місцеві структури, не так легко класифікуються), який відомий як вторинна структура. Ці сегменти вторинної структури включені в третинну структуру складчастої поліпептидного ланцюга.
- Четвертинна структура описує розташування субодиниць в білку, який містить більше однієї субодиниці. Чотири основні типи привабливих взаємодій визначають форму і стабільність складеного білка: іонний зв'язок, водневий зв'язок, дисульфідні зв'язки та сили дисперсії.
- Фермент - це органічний каталізатор, що виробляється живою клітиною. Ферменти є настільки потужними каталізаторами, що реакції, які вони сприяють, відбуваються швидко при температурі тіла.
- Молекула або молекули, на які діє фермент, називаються її субстратами.
- Фермент має активну ділянку, де його субстрат або субстрати зв'язуються, утворюючи ферментно-субстратний комплекс.
- Оригінальна модель блокування та ключа зв'язування ферменту та субстрату зображувала жорсткий фермент незмінної конфігурації, що зв'язується з відповідним субстратом. Новіша модель індукованої посадки описує активну ділянку ферменту як зміну його конформації після зв'язування з субстратом.
- Ферменти мають численні застосування в харчовій та молочній промисловості, біопаливній промисловості, паперовій промисловості тощо.
Дописувачі та атрибуція
- Libretext: The Basics of GOB Chemistry (Ball et al.)
- Template:ContribCK12
- Template:ContribSoult
- Wikipedia
- Template:ContribAgnewM
