8.2: Окислювачі та відновники
- Page ID
- 20526
- Визначте окислювачі та відновники.
Життя на планеті Земля - це складний і добре організований комплекс процесів. Тварини призначені для дихання киснем, а рослини призначені для виробництва кисню. Фотосинтез - це засіб, за допомогою якого ми отримуємо кисень, необхідний для життя. Світло, що вражає рослинний пігмент, відомий як хлорофіл, ініціює складну серію реакцій, багато з яких включають окислювально-відновні процеси в комплекті з рухом електронів. У цій серії реакцій вода перетворюється на кисневий газ, і нам є що підтримувати наше життя.
Реакція нижче - це окислювально-відновна реакція, яка виробляє сульфід цинку:
\[\ce{Zn} + \ce{S} \rightarrow \ce{ZnS}\nonumber \]
У напівреакціях можна записати:
\[\begin{align*} &\text{Oxidation:} \: \ce{Zn} \rightarrow \ce{Zn^{2+}} + 2 \ce{e^-} \\ &\text{Reduction:} \: \ce{S} + 2 \ce{e^-} \rightarrow \ce{S^{2-}} \end{align*} \nonumber \]
У вищеописаній реакції цинк окислюється, втрачаючи електрони. Однак повинна бути присутня інша речовина, яка отримує ці електрони, і в даному випадку це сірка. Іншими словами, сірка викликає окислення цинку. Сірка називається окислювачем. Цинк змушує сірку набирати електрони і зменшуватися, і тому цинк називається відновником. Окислювач - це речовина, яка викликає окислення, приймаючи електрони; отже, його ступінь окислення зменшується. Відновлювач - це речовина, яка викликає зменшення, втрачаючи електрони; тому його ступінь окислення збільшується. Найпростіший спосіб думати про це полягає в тому, що окислювач - це речовина, яка відновлюється, тоді як відновник - це речовина, яка окислюється, як показано на малюнку\(\PageIndex{1}\) і зведена в табл\(\PageIndex{1}\).
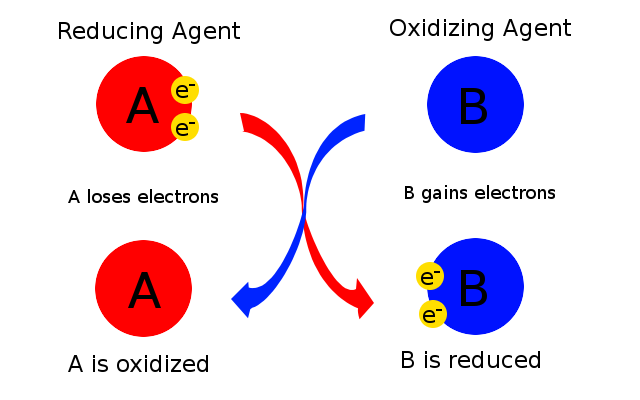
Як окислювачі, так і відновники є реагентами і тому з'являються на лівій стороні рівняння.
| Окислювачі | Редукуючі агенти | |
|---|---|---|
| Стан окислення | Зменшується | Збільшує |
| Кількість електронів | Отримав | Загублений |
| Речовина - це... | Знижений | Окислений |
Наведені нижче приклади показують, як проаналізувати окислювально-відновну реакцію та визначити окислювачі та відновники.
Коли хлорний газ пузириться в розчин броміду натрію, відбувається реакція, яка виробляє водний хлорид натрію і бром. Визначте, що окислюється, а що відновлюється. Визначте окислювачі та відновники.
\[\ce{Cl_2} \left( g \right) + 2 \ce{NaBr} \left( aq \right) \rightarrow 2 \ce{NaCl} \left( aq \right) + \ce{Br_2} \left( l \right) \nonumber \]
Рішення:
Крок 1: Плануйте проблему.
Розбийте реакцію на чисте іонне рівняння, а потім на напівреакції. Речовина, що втрачає електрони, окислюється і є відновником. Речовина, яка отримує електрони, відновлюється і є окислювачем.
Крок 2: Вирішіть.
\[\begin{align*} \ce{Cl_2} \left( g \right) + \cancel{2 \ce{Na^+} \left( aq \right)} + 2 \ce{Br^-} \left( aq \right) &\rightarrow \cancel{2 \ce{Na^+} \left( aq \right)} + 2 \ce{Cl^-} \left( aq \right) + \ce{Br_2} \left( l \right) \\ \ce{Cl_2} \left( g \right) + 2 \ce{Br^-} \left( aq \right) &\rightarrow 2 \ce{Cl^-} \left( aq \right) + \ce{Br_2} \left(l \right) \: \: \: \: \: \left( \text{net ionic equation} \right) \end{align*} \nonumber \]
\[\begin{align*} &\text{Reduction:} \: \ce{Cl_2} \left( g \right) + 2 \ce{e^-} \rightarrow 2 \ce{Cl^-} \left( aq \right) \\ &\text{Oxidation:} \: 2 \ce{Br^-} \left( aq \right) \rightarrow \ce{Br_2} \left( l \right) + 2 \ce{e^-} \end{align*} \nonumber \]
The\(\ce{Cl_2}\) відновлюється і є окислювачем. The\(\ce{Br^-}\) окислюється і є відновником.
Запишіть наступну реакцію у вигляді напіврівнянь. Визначте кожне піврівняння як окислення або відновлення. Також визначте окислювач та відновник у загальній реакції
\[\ce{Zn + 2Fe^{3+} -> Zn^{2+} +2Fe^{2+}} \nonumber \nonumber \]
Відповідь
Половинні рівняння
\(\ce{Zn -> Zn^{2+} + 2e^{-}}\)окислення—втрата електронів
\(\ce{2e^{-} + 2Fe^{3+} -> 2Fe^{2+}}\)зменшення—посилення електронів
Цинк був окислений, окислювачем повинен був бути інший реагент, а саме залізо (III).
Іон заліза (III) був відновлений, цинк повинен бути відновником.
Визначте відновлювальні та окислювачі в збалансованій окислювально-відновній реакції:
\[ Cl_2 (aq) + 2Br^- (aq) \rightarrow 2Cl^- (aq) + Br_2 (aq)\nonumber \]
Половинна реакція окислення
\[2 Br^- (aq) \rightarrow Br_2 (aq)\nonumber \]
Стан окислення: від -1 до 0
Зменшення половини реакції
\[Cl_2 (aq) \rightarrow 2 Cl^- (aq)\nonumber \]
Стан окислення: від 0 до -1
Огляд
- Br - втрачає електрон; окислюється від Br - до Br 2; таким чином, Br - є відновником.
- Cl 2 набирає один електрон; він відновлюється від Cl 2 до 2 Cl -; таким чином, Cl 2 є окислювачем.
Визначте окислювач та відновник у наступній окислювально-відновній реакції:
\[MnO_4^- + SO_3^{2-} \rightarrow Mn^{2+} + SO_4^{2-}\nonumber \]
Рішення
\(S\)є відновником і\(Mn\) є окислювачем.
Резюме
- Окислювач - це речовина, яка викликає окислення, приймаючи електрони; отже, він зменшується.
- Відновлювач - це речовина, яка викликає зменшення, втрачаючи електрони; тому він окислюється.
- Наведено приклади того, як ідентифікувати окислювачі та відновники.
Автори та атрибуція
- Template:ContribCK12
- Template:ContribChemPRIME
- Diana Pearson, Connie Xu, Luvleen Brar (UCD)
- Template:ContribAgnewM