8.1: Окислення та зменшення - Чотири думки
- Page ID
- 20538
- Визначте окислення і відновлення.
- Призначте числа окислення атомам в простих сполуках.
- Розпізнати реакцію як окислювально-відновну реакцію.
Кисень - елемент, який відомий століттями. У чистому елементарному вигляді кисень є високоактивним, і він легко робить сполуки з більшістю інших елементів. Це також найпоширеніший елемент за масою в земній корі. Клас реакцій, званих окисленням і відновленням, спочатку визначався щодо елемента кисню.
Багато елементів просто поєднуються з киснем, утворюючи оксид цього елемента. Нагрівання магнію в повітрі дозволяє йому поєднуватися з киснем, утворюючи оксид магнію.
\[2 \ce{Mg} \left( s \right) + \ce{O_2} \left( g \right) \rightarrow 2 \ce{MgO} \left( s \right) \nonumber \]
Багато сполук реагують з киснем, а також, часто в дуже екзотермічних процесах, які зазвичай називають реакціями горіння. Наприклад, при згорянні метану утворюється вуглекислий газ і вода.
\[\ce{CH_4} \left( g \right) + 2 \ce{O_2} \left( g \right) \rightarrow \ce{CO_2} \left( g \right) + 2 \ce{H_2O} \left( g \right) \nonumber \]
Вуглекислий газ - це оксид вуглецю, тоді як вода - оксид водню. Ранні вчені розглядали окислення як процес, при якому речовина реагувала з киснем з отриманням одного або декількох оксидів. У попередніх прикладах відбувається окислення магній і метан.
Визначення окислення та відновлення були в кінцевому підсумку розширені, включивши подібні типи реакцій, які не обов'язково включають кисень. Кисень більш електронегативний, ніж будь-який елемент, крім фтору. Тому, коли кисень пов'язаний з будь-яким елементом, крім фтору, електрони від іншого атома зміщуються від цього атома і до атома кисню. Окислювально-відновна реакція (іноді скорочено - окислювально-відновна реакція) - це реакція, яка передбачає повне або часткове перенесення електронів від одного реагенту до іншого. Окислення передбачає повну або часткову втрату електронів, тоді як зменшення передбачає повне або часткове посилення електронів.
Окислювально-відновні реакції вимагають, щоб ми відстежували електрони, призначені кожному атому в хімічній реакції. Як нам це зробити? Ми використовуємо окислювальні числа для відстеження електронів в атомах. Номери окислення присвоюються атомам на основі чотирьох правил. Числа окислення не обов'язково дорівнюють заряду на атомі (хоча іноді вони можуть бути); ми повинні тримати поняття чисел заряду і окислення окремо.
Призначення чисел окислення
Число окислення - це позитивне або негативне число, яке присвоюється атому для позначення його ступеня окислення або відновлення. В окисно-відновних процесах рушійною силою хімічних змін є обмін електронами між хімічними видами. Щоб допомогти нам, розроблено низку правил.
Правила присвоєння окислювальних чисел атомам такі:
- Атомам в їх елементарному стані присвоюється число окислення 0.
Приклади:\(\ce{H_2}\)\(\ce{Br_2}\)\(\ce{Na}\),\(\ce{Be}\),\(\ce{K}\),\(\ce{O_2}\),,\(\ce{P_4}\), всі мають число окислення 0. - Атомам в одноатомних (тобто одноатомних) іонам присвоюється число окислення, рівне їх заряду.
Приклад: У MgCl 2 магній має число окислення +2, тоді як кожен атом хлору має число окислення −1 - У сполуках фтору присвоюється число окислення −1; кисню зазвичай присвоюється число окислення −2 [за винятком пероксидних сполук (де це −1) та в бінарних сполуках з фтором (де він позитивний)]; і водню зазвичай присвоюється число окислення +1 [крім випадків, коли він існує як іон гідриду (H −), в цьому випадку переважає правило 2].
Приклад: У H 2 O атоми H мають число окислення +1, тоді як атом O має число окислення −2, хоча водню та кисню в цій сполуці не існують як іони. - У сполуках всім іншим атомам присвоюється число окислення так, що сума чисел окислення на всіх атомах у видах дорівнює заряду на вид (який дорівнює нулю, якщо вид нейтральний).
Приклад: У SO 2. Кожен атом O має число окислення −2; щоб сума чисел окислення дорівнювала заряду на вид (який дорівнює нулю) атому S присвоюється число окислення +4. Чи означає це, що атом сірки має 4+ заряд на ньому? Ні, це означає лише те, що атому S присвоюється число окислення +4 за нашими правилами розподілу електронів між атомами в з'єднанні.
Окислювальні числа зазвичай пишуться спочатку зі знаком, потім величиною, щоб диференціювати їх від зарядів.
Призначте числа окислення атомам в кожній речовині.
- Сл 2
- ГеО 2
- CaCl 2
Рішення
- Cl 2 є елементарною формою хлору. Правило 1 стверджує, що кожен атом має число окислення 0.
- За правилом 3 кисню в нормі присвоюється число окислення −2. Щоб сума чисел окислення дорівнювала заряду на вид (нуль), атому Ge присвоюється число окислення +4.
- Іон Ca 2 + має число окислення +2 за правилом 2. Також згідно з правилом 2 кожному атому хлору присвоюється число окислення −1.
Призначте числа окислення атомам в H 3 PO 4.
- Відповідь
-
Ч: +1; О: −2; Р: +5
Реакції окислення та відновлення
Процеси окислення і відновлення зазвичай розглядаються з точки зору посилення або втрати електронів або збільшення або зменшення числа окислення. Однак багато реакцій в органічній хімії, які передбачають посилення або втрату кисню або водню, також розглядаються як окислювально-відновні реакції.
Наведена нижче таблиця узагальнює процеси окислення і відновлення.
| Окислення | RF Лід Всмоктування |
|---|---|
| Повна втрата електронів (іонна реакція) | Повне посилення електронів (іонна реакція) |
| Збільшення числа окислення | Зниження числа окислення |
| посилення кисню | Втрата кисню |
| Втрата водню в молекулярній сполуці | Збільшення водню в молекулярній сполуці |
1. Окислення - це повна втрата електронів. Зменшення - це повне посилення електронів
Щоб зрозуміти реакції передачі електронів, подібні до реакції між металом цинку та іонами водню, хіміки розділяють їх на дві частини: одна частина фокусується на втраті електронів, а одна - на посилення електронів. Втрата електронів називається окисленням. Коефіцієнт посилення електронів називається редукцією.
Втрачені електрони записуються як продукти; отримані електрони записуються як реагенти. Наприклад, реакція нижче представляє, коли кислота додається до металу цинку.
\[\ce{Zn (s) + 2H^{+} (aq) → Zn^{2+}(aq) + H2(g)} \nonumber \]
атоми цинку окислюються до Zn 2 +. Половинна реакція для реакції окислення, опускаючи мітки фаз, виглядає наступним чином:
\[\ce{Zn → Zn^{2+} + 2e^{−}} \nonumber \]
Ця половина реакції збалансована за кількістю атомів цинку, а також показує два електрони, необхідні як продукти для обліку того, що атом цинку втрачає два негативні заряди, щоб стати іоном 2+. При половинних реакціях є ще один пункт для збалансування: загальний заряд з кожного боку реакції. Якщо перевірити кожну сторону цієї реакції, то зауважте, що обидві сторони мають нульовий чистий заряд.
Водень знижується в реакції. Збалансована реакція зменшення половини виглядає наступним чином:
\[\ce{2H^{+} + 2e^{−} → H2} \nonumber \]
З кожного боку є два атоми водню, і два електрони, записані як реагенти, служать для нейтралізації заряду 2+ на реагентах іонів водню. Знову ж таки, загальний заряд з обох сторін дорівнює нулю.
LEO позначає Втрата електронів є окислення, тоді як GER розшифровується як отримання електронів є зменшення.

Цей хлопець знає свої окислювально-відновні реакції.
2. Окислення - це збільшення числа окислення. Зменшення - це зменшення числа окислення.
Розглянемо реакцію нижче між елементарним залізом і мідним купоросом:
\[\ce{Fe} + \ce{CuSO_4} \rightarrow \ce{FeSO_4} + \ce{Cu} \nonumber \]
В ході реакції число окислення\(\ce{Fe}\) збільшується від нуля до\(+2\). Кількість окислення міді зменшується від\(+2\) до\(0\). Цей результат відповідає ряду активності. Залізо вище міді в серії, тому буде більш імовірно утворюватися\(\ce{Fe^{2+}}\) при перетворенні на\(\ce{Cu^{2+}}\) металеву мідь\(\left( \ce{Cu^0} \right)\).
3. Окислення - це посилення кисню. Зменшення - це втрата кисню.
Окислення і відновлення також можна визначити з точки зору зміни складу. Початкове значення окислення було «додавання кисню», тому, коли кисень додається до молекули, молекула окислюється. Зворотне вірно для відновлення: якщо молекула втрачає атоми кисню, молекула зменшується. Наприклад, молекула ацетальдегіду (\(CH3CHO\)) приймає атом кисню, щоб стати оцтовою кислотою (\(\ce{CH3COOH}\)).
\[\ce{2CH3CHO + O2 → 2CH_3COOH} \nonumber \]
Таким чином відбувається окислення ацетальдегіду.
4. Окислення - це втрата водню в молекулярній сполуці. Зниження - це посилення водню в молекулярній сполуці.
Окислення та відновлення можна визначити з точки зору посилення або втрати атомів водню. Якщо молекула додає атоми водню, вона відновлюється. Якщо молекула втрачає атоми водню, молекула окислюється. Наприклад, при перетворенні ацетальдегіду в етанол CH 3 CHO атоми водню додаються до ацетальдегіду, тому ацетальдегід знижується:
\[\ce{CH3CHO + H2 → CH3CH2OH} \nonumber \]
У кожному перетворенні вказуйте, чи відбувається окислення або відновлення.
- N 2 → Н 3
- СН 3 СН 2 ОХН 3 → СН 3 КОЧ 3
- ЧХОО → ЧОХОА
Рішення
- Водень додається до вихідної молекули реагенту, тому відбувається відновлення.
- Водень видаляється з вихідної молекули реагенту, тому відбувається окислення.
- Кисень додається до вихідної молекули реагенту, тому відбувається окислення.
У кожному перетворенні вказуйте, чи відбувається окислення або відновлення.
- СН 4 → СО 2 + Н 2 О
- НІ 2 → Н 2
- СН 2 = СН 2 → СН 3 СН 3
Відповіді
- окислення
- скорочення
- скорочення
Визначте, що окислюється та відновлюється в цій окислювально-відновній реакції.
\[\ce{2Na + Br2 → 2NaBr} \nonumber \]Рішення
Обидва реагенти є елементарними формами їх атомів, тому атоми Na і Br мають номери окислення 0. В іонному продукті іони Na + мають число окислення +1, тоді як іони Br − мають число окислення −1.
\[2\underset{0}{Na}+\underset{0}{Br_{2}}\rightarrow 2\underset{+1 -1}{NaBr} \nonumber \]
Натрій збільшує число окислення з 0 до +1, тому він окислюється; бром зменшує число окислення з 0 до −1, тому його зменшують:
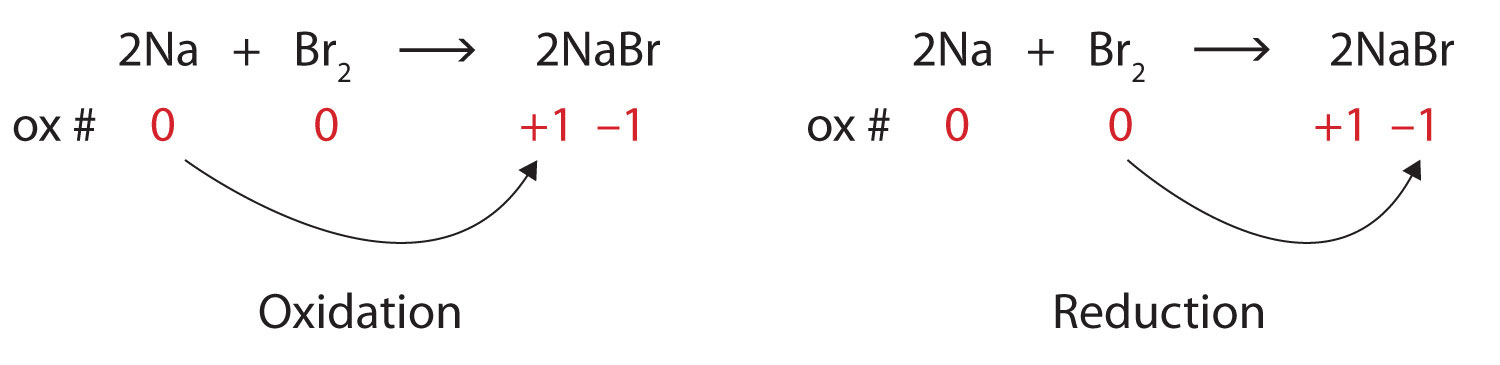
Оскільки числа окислення змінюються, це окислювально-відновна реакція. Загальна кількість електронів, втрачених натрієм (два, один втрачений від кожного атома Na) отримується бромом (два, один отриманий для кожного атома Br).
Визначте, що окислюється та відновлюється в цій окислювально-відновній реакції.
\[\ce{C + O2 → CO2}\nonumber \]
- Відповідь
-
C окислюється від 0 до +4; O відновлюється з 0 до −2.
Для кожної половини реакції визначте, чи була втрата або посилення електронів.
- 2Н 3 - → Н 2
- Автомобіль 6 + → Автомобіль 3 +
Рішення
а Коли ми порівнюємо загальні заряди з кожного боку рівняння, ми знаходимо заряд 2 (-3) =-6 зліва, але заряд 0 справа. Це рівняння не є належним чином збалансованим. Щоб збалансувати його, з правого боку необхідно додати шість електронів наступним чином:
\ [\ ce {2N^ {3-} → N2 + 6е^ {-}}\ номер\]
Так сталася втрата шести електронів. Тепер рівняння збалансоване не тільки з точки зору елементів, але і за рівнем заряду.
б. коли ми порівнюємо загальні заряди з кожного боку рівняння, ми знаходимо заряд +6 зліва і заряд +3 справа. Це рівняння не є належним чином збалансованим. Щоб в кінцевому підсумку з числом окислення +3 на правій стороні потрібно додати 3 електрони з лівого боку наступним чином:
\ [\ ce {Cr^ {6+} + 3e^ {-} → Cr^ {3+}\ номер\]
Так сталося посилення трьох електронів. Тепер рівняння збалансоване в плані заряду.
Для кожної половини реакції визначте, чи була втрата або посилення електронів.
- О 2 → 2О 2 -
- Cu + → Cu 2 +
Відповіді
a. посилення чотирьох електронів
b. втрата одного електрона
Запишіть та збалансуйте окислювально-відновну реакцію, яка має іони срібла та метал алюмінію як реагенти та іони срібла та алюмінію як продукти.
Рішення
Почнемо з використання символів елементів і іонів для представлення реакції:
\[\ce{Ag^{+} + Al → Ag + Al^{3+}} \nonumber \]
Рівняння виглядає збалансованим, як написано. Однак, коли ми порівнюємо загальні заряди з кожного боку рівняння, ми знаходимо заряд +1 зліва, але заряд +3 праворуч. Це рівняння не є належним чином збалансованим. Щоб збалансувати його, напишемо дві половинні реакції. Іони срібла відновлюються, і для зміни Ag + на Ag потрібно один електрон:
\[\ce{Ag^{+} + e^{−} → Ag} \nonumber \]
Алюміній окислюється, втрачаючи три електрони для зміни з Al на Al 3 +:
\[\ce{Al → Al^{3+} + 3e^{−}} \nonumber \]
Щоб об'єднати ці дві половинні реакції і скасувати всі електрони, нам потрібно помножити реакцію відновлення срібла на 3:
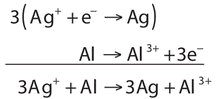
Тепер рівняння збалансоване не тільки з точки зору елементів, але і за рівнем заряду.
Запишіть та збалансуйте окислювально-відновну реакцію, яка має іони кальцію та метал калію як реагенти, а також іони металів кальцію та калію як продукти.
Резюме
- Перераховані правила визначення окислювальних чисел.
- Наведено приклади визначення окислювальних чисел.
- Хімічні реакції, в яких переносяться електрони, називаються окислювально-відновними, або окислювально-відновними, реакціями.
- Окислення визначається з точки зору втрати електронів, посилення кисню, втрати водню або збільшення числа окислення.
- Зменшення визначається з точки зору посилення електронів, втрати кисню, посилення водню або зменшення числа окислення.
- Окислення і відновлення завжди відбуваються разом, хоча їх можна записати як окремі хімічні рівняння.
Дописувачі та атрибуція
- Template:ContribCK12
- Libretext: Beginning Chemistry (Ball et al.)
- Libretext: The Basics of GOB Chemistry (Ball et al.)
- Libretext: Chemistry for Allied Health (Soult)
- Template:ContribAgnewM
- Template:ContribChemPRIME