7.8: Кислоти та основи в промисловості та в повсякденному житті
- Page ID
- 20281
- Знайте багато застосувань поширених кислот і підстав.
Антациди: основний засіб
Антациди містять лужні іони, які хімічно нейтралізують шлункову кислоту шлунка, зменшуючи пошкодження і знімаючи біль. Наприклад, Тумс - це дуже часто використовуваний антацид, який можна купити без рецепта. Інші антациди, такі як Алка Зельтцер, працюють аналогічними способами. Нижче наведено механізм та продукти реакції, при якій карбонат кальцію (активний інгредієнт Тумс) нейтралізує HCl в простій реакції переносу протонів.
АСО (3 и) + НСл (ак) → Н 2 СО (3 кв) + СаКл (кв)
Після цієї кислотно-лужної реакції вугільна кислота швидко розпадається на СО 2 і Н 2 О.
Н 2 СО 3 (ак) → СО 2 (г) + Н 2 О (л)
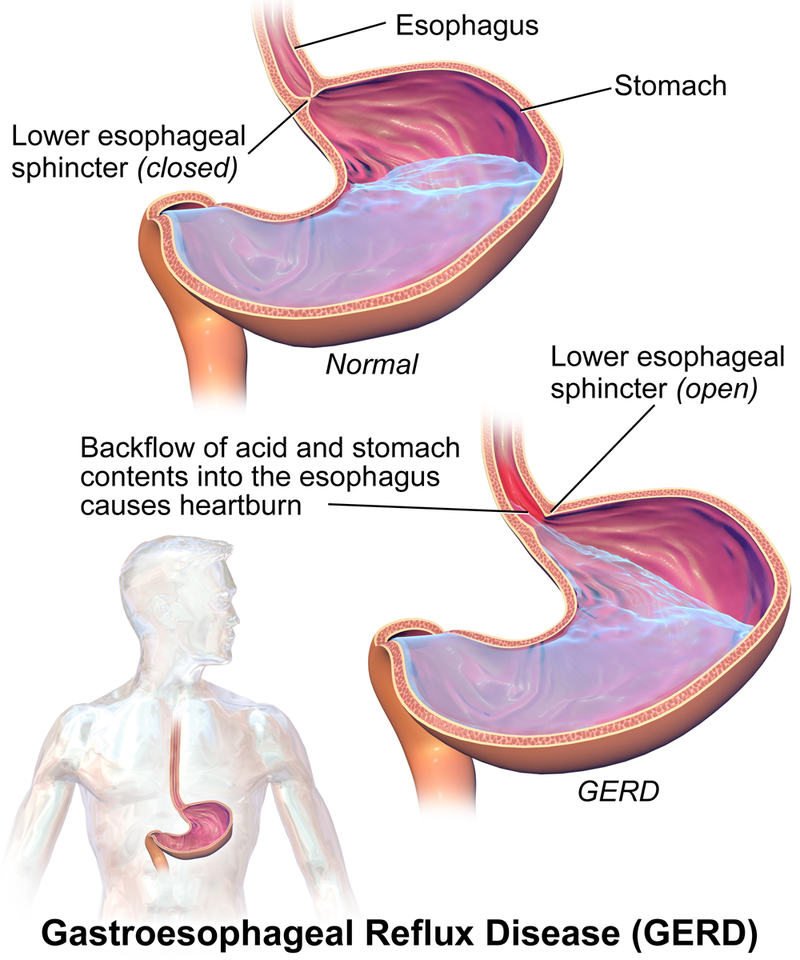
\(\PageIndex{1}\)Рисунок Порівняння здорового стану з ГЕРХ. Я
Зображення, що використовується з дозволу (Cc BY-SA 4.0; BruceBlaus.
Під загальною назвою альгельдрат гідроксид алюмінію використовується як антацид. Гідроксид алюмінію є кращим перед іншими альтернативами, такими як бікарбонат натрію, оскільки Al (OH) 3, будучи нерозчинним, не збільшує рН шлунка вище 7 і, отже, не викликає секреції надлишку шлункової кислоти. Торгові марки включають Alu-Cap, Aludrox, Gaviscon та Pepsamar. У 2016 році Gaviscon був одним з найбільших продаваних брендових безрецептурних ліків, що продаються у Великобританії, з продажами 62 мільйони фунтів стерлінгів. Він реагує з надлишком кислоти в шлунку, знижуючи кислотність вмісту шлунка, що може полегшити симптоми виразки, печії або диспепсії. Такі продукти можуть викликати запор, оскільки іони алюмінію гальмують скорочення гладком'язових клітин шлунково-кишкового тракту, сповільнюючи перистальтику і подовжуючи час, необхідний для проходження стільця через товсту кишку. Деякі такі продукти сформульовані для мінімізації таких ефектів за рахунок включення рівних концентрацій гідроксиду магнію або карбонату магнію, які мають протирівноважні проносні ефекти.
Антациди відрізняються від препаратів, що знижують кислоту, таких як антагоністи H 2 -рецепторів або інгібітори протонної помпи, і вони не вбивають бактерії Helicobacter pylori, що викликає більшість виразок. Ранитидин (Zantac), фамотидин (Pepcid AC) та циметидин (Тагамет) входять до класу ліків, які називаються блокаторами H 2. Це зменшує кількість кислоти, виробленої в шлунку, і використовується для лікування виразки; гастроезофагеальна рефлюксна хвороба (ГЕРХ), стан, при якому зворотний потік кислоти зі шлунка викликає печію та травму харчової труби (стравоходу); і умови, коли шлунок виробляє занадто багато кислоти, такі як Золлінгер -синдром Еллісона. Ці ліки без рецепта використовуються для запобігання та лікування симптомів печії, пов'язаних з кислотним розладом шлунка та кислим шлунком. Омепразол (Прілосек) також працює за рахунок зменшення кількості кислоти, що виробляється в шлунку, і входить до класу ліків, які називаються інгібіторами протонної помпи.
Кислоти та основи в промисловості та вдома
Загальні кислоти
Вам не повинно бути важко назвати кілька поширених кислот, але ви можете виявити, що перерахування основ просто трохи складніше. Ось неповний список деяких поширених кислот, а також деякі хімічні формули:
|
Ім'я хіміка
|
Загальна назва | Використовує |
|---|---|---|
| соляна кислота, HCl | сольова кислота (використовується в басейні) і шлункова кислота | Використовується при очищенні (рафінуванні) металів, в обслуговуванні басейнів, для побутового прибирання. |
| сірчана кислота, H 2 SO 4 | Використовується і в автомобільних акумуляторах, і при виготовленні добрив. | |
| азотна кислота, HNO 3 | Використовується у виробництві добрив, вибухових речовин і при видобутку золота. | |
| оцтова кислота, HC 2 H 3 O 2 | оцту | Основний інгредієнт оцту. |
| вугільна кислота, H 2 CO 3 | відповідає за «фіз» в газованих напоях | Як інгредієнт в газованих напоях. |
| лимонна кислота, С 6 Н 8 О 7 | Використовується в харчових продуктах і БАДах. Також додається як підкислювач в креми, гелі, рідини та лосьйони. | |
| ацетилсаліцилова кислота, С 6 Н 4 (ОКОЧ 3) СО 2 Н | аспірин | Діюча речовина в аспірині. |
Соляна кислота
Соляна кислота - це корозійна, сильна мінеральна кислота з багатьма промисловими застосуваннями. Одним з найважливіших застосувань соляної кислоти є травлення сталі для видалення іржі або окипу оксиду заліза з заліза або сталі перед подальшою обробкою. Іншим основним застосуванням соляної кислоти є виробництво органічних сполук, таких як вінілхлорид і дихлоретан для ПВХ. Інші органічні сполуки, що виробляються з соляною кислотою, включають бісфенол А для полікарбонату, активоване вугілля та аскорбінову кислоту, а також численні фармацевтичні продукти. Інші неорганічні сполуки, вироблені з соляною кислотою, включають в себе сіль хлорид кальцію для дорожнього застосування, хлорид нікелю (II) для гальванічного покриття та хлорид цинку для гальванічної промисловості та виробництва акумуляторів.
Сірчана кислота
Сірчана кислота є дуже важливою товарною хімічною речовиною, і дійсно, виробництво сірчаної кислоти в країні є хорошим показником її промислової міцності. Світове виробництво в 2004 році склало близько 180 млн тонн, з наступним географічним розподілом: Азія 35%, Північна Америка (включаючи Мексику) 24%, Африка 11%, Західна Європа 10%, Східна Європа і Росія 10%, Австралія і Океанія 7%, Південна Америка 7%. Велика частина цієї кількості (≈ 60%) витрачається на добрива, зокрема суперфосфати, фосфат амонію та сульфати амонію. Близько 20% використовується в хімічній промисловості для виробництва миючих засобів, синтетичних смол, барвників, фармацевтичних препаратів, нафтових каталізаторів, інсектицидів і антифризів, а також в різних процесах, таких як підкислення нафтових свердловин, відновлення алюмінію, калібрування паперу, очищення води. Близько 6% використання пов'язані з пігментами і включають фарби, емалі, друкарські фарби, тканини з покриттям та папір, а решта диспергується на безліч застосувань, таких як виробництво вибухових речовин, целофану, ацетату та віскози текстилю, мастильних матеріалів, кольорових металів та акумуляторів.

Оскільки гідратація сірчаної кислоти термодинамічно сприятлива (і дуже екзотермічна) і спорідненість її до води досить сильна, сірчана кислота є відмінним зневоднюючим агентом. Концентрована сірчана кислота має дуже потужну зневоднюючу властивість, видаляючи воду (\(\ce{H2O}\)) з інших сполук, включаючи цукор та інші вуглеводи, і виробляючи вуглець, тепло, пар. Сірчана кислота поводиться як типова кислота у своїй реакції з більшістю металів шляхом генерації водневого газу (Equation\ ref {Eq1}).
Азотна кислота
Азотна кислота (\(\ce{HNO3}\)) є висококорозійною мінеральною кислотою, а також зазвичай використовується як сильний окислювач. Азотна кислота зазвичай вважається сильною кислотою при температурі навколишнього середовища. Основне промислове використання азотної кислоти - це виробництво добрив. Азотну кислоту нейтралізують аміаком для отримання аміачної селітри. Ця програма споживає 75— 80% з 26 мільйонів тонн, вироблених щорічно (1987). Інші основні області застосування - виробництво вибухових речовин, нейлонових прекурсорів та спеціальних органічних сполук.
|
Деякі загальні основи
|
Використовує |
|---|---|
| гідроксид натрію, NaOH (луг або каустична сода) |
Використовується у виробництві мила та миючих засобів і як основний інгредієнт в очищувачі духовки та зливу. |
| гідроксид калію, КОН (луг або їдкий поташ) |
Використовується у виробництві рідкого мила і м'якого мила. Використовується в лужних батареях. |
| гідроксид магнію, Mg (ОН) 2 (молоко магнезії) |
Використовується як інгредієнт проносних засобів, антацидів та дезодорантів. Також використовується при нейтралізації кислих стічних вод. |
| гідроксид кальцію, Ca (OH) 2 (гашене вапно) |
Використовується при виготовленні цемент і вапняна вода. Також додають для нейтралізації кислого грунту. |
| гідроксид алюмінію | Використовується при очищенні води і як інгредієнт антацидів. |
| аміак, NH 3 | Використовується як будівельний блок для синтезу багатьох фармацевтичних продуктів і в багатьох комерційних чистячих засобах. Використовується при виготовленні добрив. |
Гідроксид натрію
Гідроксид натрію, також відомий як луг і каустична сода, є неорганічною сполукою з формулою\(\ce{NaOH}\).
Це популярна міцна основа, що використовується в промисловості. Близько 56% виробленого гідроксиду натрію використовується промисловістю, 25% з яких використовується в паперовій промисловості. Гідроксид натрію також використовується у виробництві солей натрію та миючих засобів, регуляції рН та органічного синтезу. Застосовується в процесі виробництва алюмінію Bayer. Навалом найчастіше обробляється як водний розчин, так як розчини дешевше і простіше в обробці.
Гідроксид натрію використовується в багатьох сценаріях, де бажано збільшити лужність суміші, або нейтралізувати кислоти.

Гідроксид кальцію
Гідроксид кальцію (традиційно називається гашене вапно) - неорганічна сполука з хімічною формулою\(\ce{Ca(OH)2}\). Являє собою безбарвний кристал або білий порошок. Він має багато назв, включаючи гашене вапно, їдке вапно, вапно будівельників, гашене вапно, кал або маринувальне вапно.
Одним із значних застосувань гідроксиду кальцію є флокулянт у воді та очищенні стічних вод. Він також використовується в очищенні прісної води для підвищення рН води, щоб труби не піддавалися корозії там, де основна вода є кислою, оскільки вона саморегулюється і не піднімає рН занадто сильно.
Він також використовується при приготуванні аміачного газу (NH 3), використовуючи наступну реакцію:
- Са (ОН) 2 + 2Н 4 Сл → 2Н 3 + СаСл 2 + 2Н 2 О
Ще одне велике застосування - в паперовій промисловості, де вона є проміжним продуктом в реакції при виробництві гідроксиду натрію. Через низьку токсичність і м'якості основних властивостей гашене вапно широко застосовується в харчовій промисловості:
Аміак
Аміак являє собою з'єднання азоту і водню з формулою\(\ce{NH3}\) і являє собою безбарвний газ з характерним різким запахом. Він є активним продуктом «пахнуть солей», і може швидко оживити слабкість серця і світло голови. Хоча поширений в природі і в широкому застосуванні, аміак є і їдким, і небезпечним в концентрованому вигляді.
У всьому світі приблизно 88% (станом на 2014 рік) аміаку використовується як добрива або у вигляді його солей, розчинів або безводно. При внесенні до ґрунту це сприяє підвищенню врожайності таких культур, як кукурудза та пшениця. 30% сільськогосподарського азоту, що застосовується в США, знаходиться у вигляді безводного аміаку, а у всьому світі щороку вноситься 110 млн т. Аміак також є будівельним блоком для синтезу багатьох фармацевтичних продуктів і використовується в багатьох комерційних чистячих засобах.
Резюме
Загальні кислоти та основи мають багато різних застосувань у промисловості та повсякденному житті.
Дописувачі та атрибуція
- Template:ContribCK12
- Template:ContribChemistry30
- Wikipedia
- TextMap: Chemistry-A Molecular Approach (Tro)
- Template:ContribAgnewM
- Template:ContribAgnewH
- MedlinePlus