7.7: Буфери та сполучені кислотно-лужні пари
- Page ID
- 20236
- Визначте кон'югатну кислотну пару основи.
- Визначте буфери і знайте склад різних буферних систем.
- Опишіть, як працюють буфери.
Сполучений кислотно-лужний пара
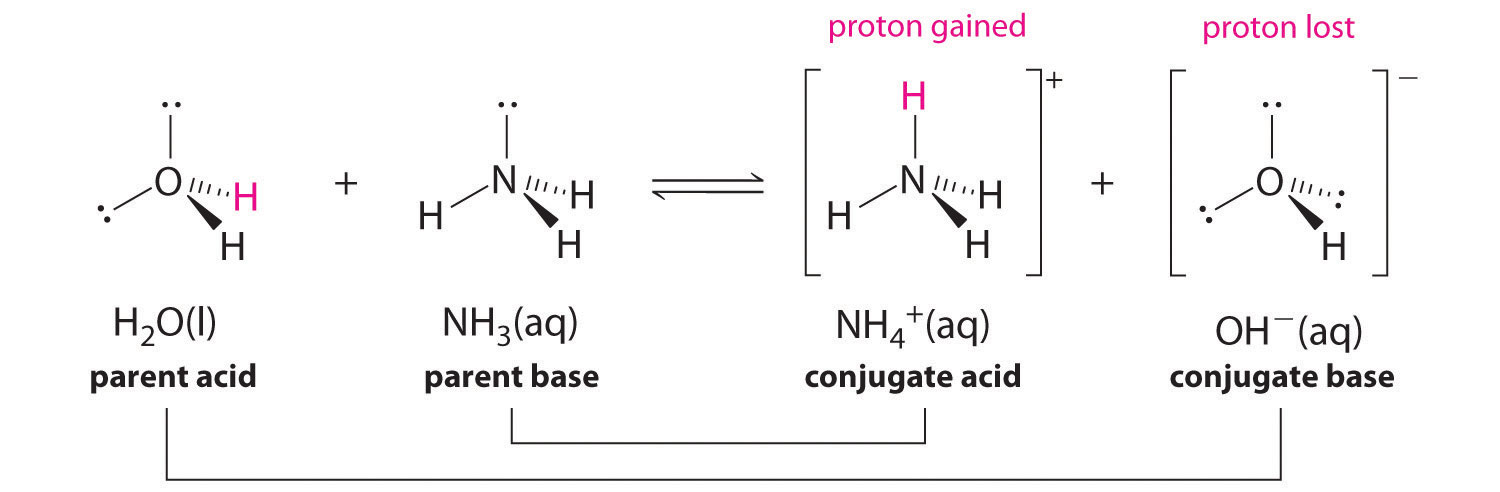
Насправді всі кислотно-лужні реакції передбачають перенесення протонів між кислотами і підставами. Для прикладу розглянемо кислотно-лужну реакцію, яка відбувається при розчиненні аміаку у воді. Молекула води (функціонує як кислота) переносить протон до молекули аміаку (функціонуючої як основа), отримуючи кон'югатну основу води\(\ce{OH^-}\), і кон'югатну кислоту аміаку,\(\ce{NH4+}\):
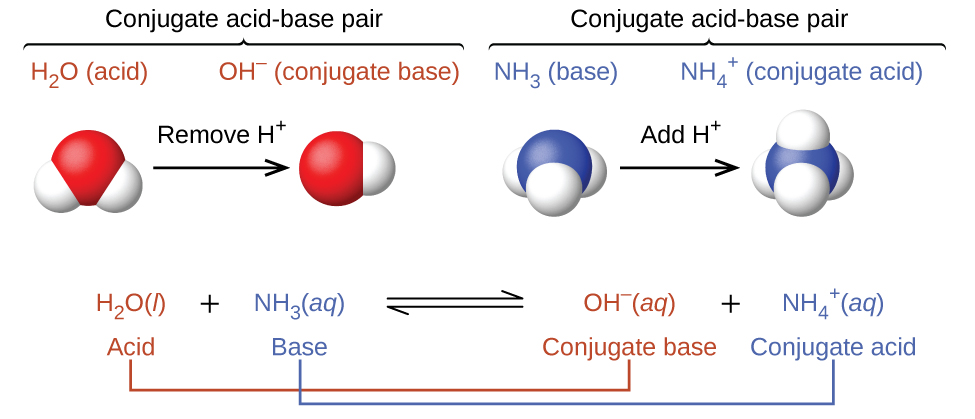
У реакції аміаку з водою для отримання іонів амонію та гідроксиду аміак виступає в якості основи, приймаючи протон з молекули води, що в даному випадку означає, що вода діє як кислота. У зворотній реакції іон амонію діє як кислота, передаючи протон гідроксидному іону, а гідроксид-іон виступає в якості основи. Сполученими парами кислота-основа для цієї реакції є\(NH_4^+/NH_3\) і\(H_2O/OH^−\).
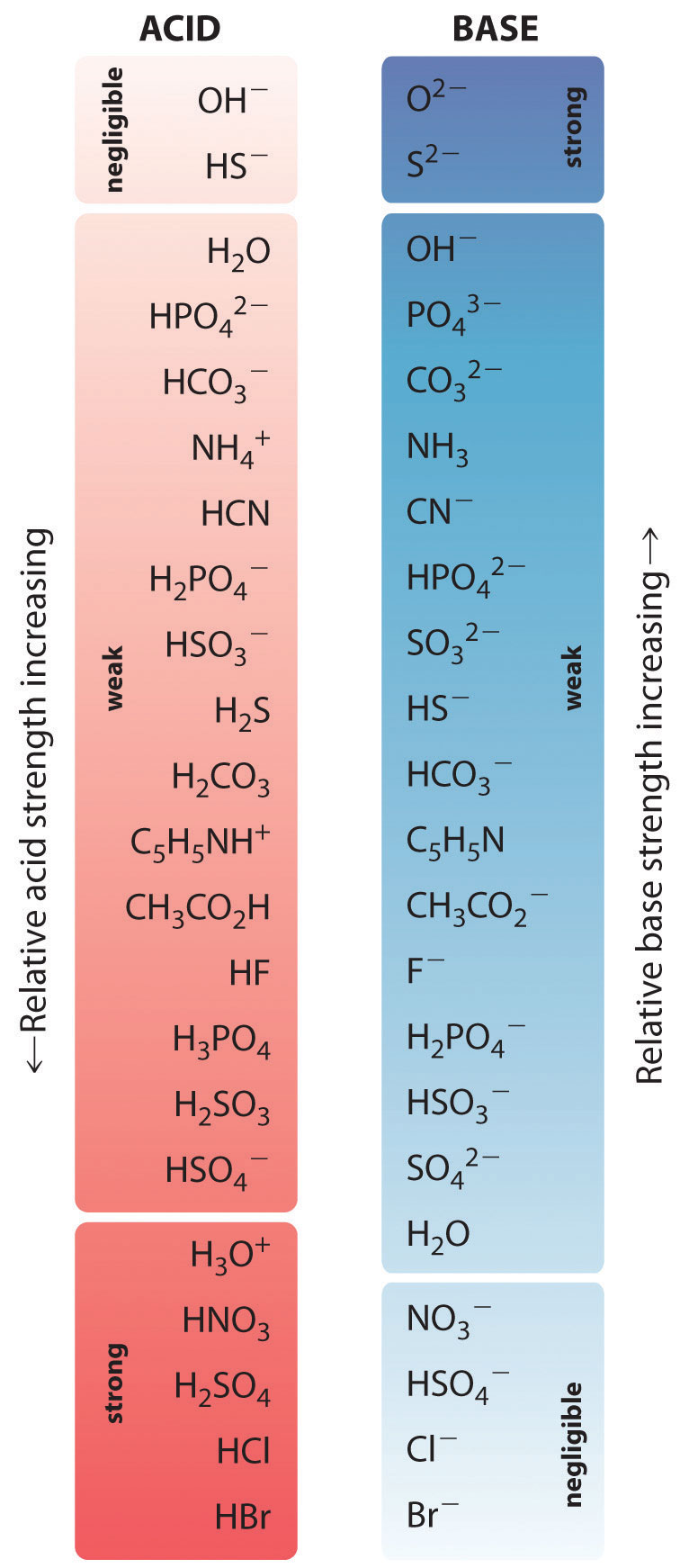
Найсильніші кислоти знаходяться внизу зліва, а найсильніші основи - вгорі праворуч. Кон'югатна основа сильної кислоти - дуже слабка основа, і, навпаки, кон'югатна кислота міцної основи - дуже слабка кислота.
Визначте сполучені кислотно-лужні пари в цій рівновазі.
\[\ce{CH3CO2H + H2O <=> H3O^{+} + CH3CO2^{-}} \nonumber \]
Рішення
Аналогічно в реакції оцтової кислоти з водою оцтова кислота дарує протон воді, який виступає в ролі основи. У зворотній реакції\(H_3O^+\) - це кислота, яка дарує протон ацетатному іону, який діє як основа.
Знову ж таки, у нас є дві сполучені пари кислота-основа:
- материнська кислота і її кон'югатна основа (\(CH_3CO_2H/CH_3CO_2^−\)) і
- батьківська основа і її кон'югатна кислота (\(H_3O^+/H_2O\)).
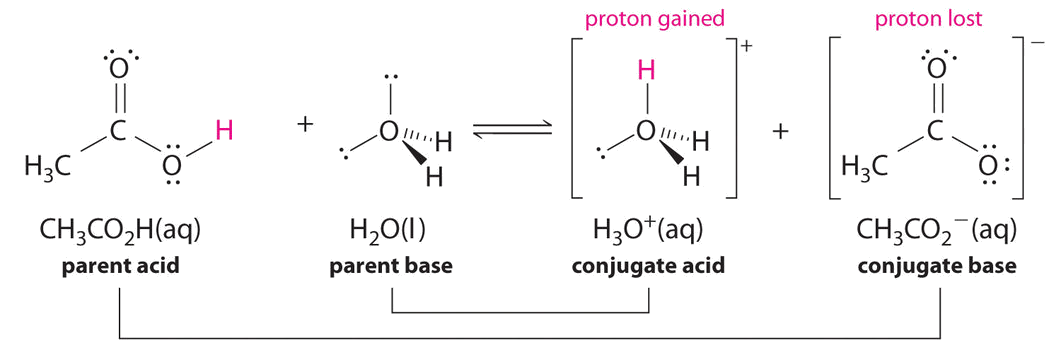
Визначте сполучені кислотно-лужні пари в цій рівновазі.
\[(CH_{3})_{3}N + H_{2}O\rightleftharpoons (CH_{3})_{3}NH^{+} + OH^{-} \nonumber \]
Рішення
Одна пара - H 2 O і OH −, де H 2 O має ще одну H + і є кон'югованою кислотою, тоді як OH - має на одну меншу H + і є сполученою основою.
Інша пара складається з (СН 3) 3 N і (CH 3) 3 NH +, де (CH 3) 3 NH + - сполучений кислота (вона має додатковий протон) і (СН 3) 3 Н є кон'югатною основою.
Визначте сполучені кислотно-лужні пари в цій рівновазі.
\[\ce{NH2^{-} + H2O\rightleftharpoons NH3 + OH^{-}} \nonumber \]
- Відповідь:
- H 2 O (кислота) і OH − (основа); NH 2 − (основа) і NH 3 (кислота)
Буферні розчини
Слабкі кислоти відносно поширені, навіть у продуктах, які ми їмо. Але ми зрідка стикаємося з сильною кислотою або основою, такою як шлункова кислота, яка має сильнокислий рН 1,7. За визначенням, сильні кислоти та основи можуть виробляти відносно велику кількість іонів H + або OH − і, отже, мають помітну хімічну активність. Крім того, дуже малі кількості сильних кислот і підстав можуть дуже швидко змінювати рН розчину. Якби 1 мл шлункової кислоти [приблизно як 0,1 М HCl (aq)] були додані до кровотоку і не було жодного коригуючого механізму, рН крові зменшився б приблизно з 7,4 до приблизно 4,7 - рН, який не сприяє продовженню життя. На щастя, в організмі є механізм мінімізації таких різких змін рН.
Цей механізм включає буфер, розчин, який протистоїть різким змінам рН. Буфери роблять це, складаючи певні пари розчинених речовин: або слабка кислота плюс сіль, отримана з цієї слабкої кислоти, або слабкої основи плюс сіль цієї слабкої основи. Наприклад, буфер може складатися з розчинених HC 2 H 3 O 2 (слабка кислота) і NaC 2 H 3 O 2 (сіль, отримана з цієї слабкої кислоти). Іншим прикладом буфера є розчин, що містить NH 3 (слабка основа) і NH 4 Cl (сіль, отримана з цієї слабкої основи).
Давайте використаємо буфер HC 2 H 3 O 2/NaC 2 H 3 O 2, щоб продемонструвати, як працюють буфери. Якщо до буферного розчину додається сильна основа - джерело іонів OH − (aq), ці іони OH - реагуватимуть з HC 2 H 3 O 2 в кислотно-лужній реакції:
\[\ce{HC2H3O2(aq) + OH^{-}(aq) \rightarrow H2O(ℓ) + C2H3O^{-}2(aq)} \label{Eq1} \]
Замість того, щоб різко змінювати рН, роблячи розчин основним, додані іони OH − реагують, щоб зробити H 2 O, тому рН не сильно змінюється.
Якщо до буферного розчину додати сильну кислоту - джерело іонів H +, іони Н + вступлять в реакцію з аніоном з солі. Оскільки HC 2 H 3 O 2 є слабкою кислотою, вона не сильно іонізується. Це означає, що якщо багато іонів H + та іонів C 2 H 3 O 2 − присутні в одному розчині, вони об'єднаються, щоб зробити HC 2 H 3 З 2:
\[\ce{H^{+}(aq) + C2H3O^{−}2(aq) \rightarrow HC2H3O2(aq)} \label{Eq2} \]
Замість того, щоб різко змінювати рН і робити розчин кислим, додані іони Н + реагують, утворюючи молекули слабкої кислоти. Малюнок\(\PageIndex{2}\) ілюструє обидві дії буфера.

Буфери, виготовлені зі слабких підстав і солей слабких підстав, діють аналогічно. Наприклад, в буфері, що містить NH 3 і NH 4 Cl, молекули NH 3 можуть реагувати з будь-якими надлишковими іонами Н +, що вводяться сильними кислотами:
NH 3 (ак) + Н + (ак) → NH 4 + (ак)
тоді як іон NH 4 + (aq) може реагувати з будь-якими OH − іонами, що вводяться сильними основами:
Н 4 + (ак) + ОН − (ак) → Н 3 (ак) + Н 2 О ()
Деякі поширені буферні системи наведені в таблиці нижче.
| Таблиця\(\PageIndex{1}\) деяких загальних буферів | ||
|---|---|---|
| \ (\ pageIndex {1}\) Деякі загальні буфери» style="vertical-align:middle; "> Буферна система | Компоненти буфера | рН буфера (рівні молярності обох компонентів) |
| \ (\ pageIndex {1}\) Деякі загальні буфери» style="вертикальне вирівнювання: середина; "> Оцтова кислота/ацетатний іон | \(\ce{CH_3COOH}\)/\(\ce{CH_3COO^-}\) | 4.74 |
| \ (\ pageIndex {1}\) Деякі загальні буфери» style="vertical-align:middle; ">Вуглекислота/іон гідрокарбонату | \(\ce{H_2CO_3}\)/\(\ce{HCO_3^-}\) | 6.38 |
| \ (\ pageIndex {1}\) Деякі загальні буфери» style="вертикальне вирівнювання: середина; "> Дигідрофосфат-іон/гідрофосфатний іон | \(\ce{H_2PO_4^-}\)/\(\ce{HPO_4^{2-}}\) | 7.21 |
| \ (\ pageIndex {1}\) Деякі загальні буфери» style="vertical-align:middle; "> Аміак/іон амонію | \(\ce{NH_3}\)/\(\ce{NH_4^+}\) | 9.25 |
Буфери добре працюють тільки для обмеженої кількості доданої сильної кислоти або основи. Після того, як будь-який розчинений розчин повністю реагує, розчин більше не є буфером, і можуть відбутися швидкі зміни рН. Ми говоримо, що буфер має певну ємність. Буфери, які мають більше розчиненої речовини, розчиненої в них для початку, мають більшу ємність, як можна було очікувати.
Кров людини має буферну систему, щоб мінімізувати екстремальні зміни рН. Один буфер в крові заснований на наявності HCO 3 − і H 2 CO 3 [друга сполука - ще один спосіб запису CO 2 (aq)]. З цим буфером, навіть якщо якась шлункова кислота знайде свій шлях безпосередньо в кров, зміна рН крові була б мінімальною. Усередині багатьох клітин організму є буферна система на основі фосфатних іонів.
З яких комбінацій з'єднань можна зробити буферний розчин?
- HCHO 2 і НаЧо 2
- HCl і NaCl
- СН 3 Н 2 і СН 3 Н 3 Сл
- NH 3 і NaOH
Рішення
- HCHO 2 - це мурашина кислота, слабка кислота, тоді як NaChO 2 - це сіль, виготовлена з аніону слабкої кислоти (іон форміату [CHO 2 −]). Поєднання цих двох розчинених речовин зробить буферний розчин.
- HCl - це сильна кислота, а не слабка кислота, тому комбінація цих двох розчинених речовин не зробить буферний розчин.
- CH 3 NH 2 - це метиламін, який схожий на NH 3 з одним із його атомів H, заміщеним групою CH 3. Оскільки вона не вказана в таблиці\(\PageIndex{1}\), можна вважати, що вона є слабкою базою. З'єднання CH 3 NH 3 Cl - це сіль, виготовлена з цієї слабкої основи, тому комбінація цих двох розчинених речовин зробить буферний розчин.
- NH 3 є слабкою базою, але NaOH є міцною базою. Поєднання цих двох розчинених речовин не створило б буферного розчину.
З яких комбінацій з'єднань можна зробити буферний розчин?
- NaHCO 3 і NaCl
- Н 3 РО 4 і нАг 2 РО 4
- NH 3 і (NH 4) 3 РО 4
- NaOH і NaCl
- Відповідь на
- Так.
- Відповідь б
- Ні. Потрібна слабка кислота або основа і сіль її кон'югатної основи або кислоти.
- Відповідь c
- Так.
- Відповідь d
- Ні. Потрібна слабка основа або кислота.
Хоча ліки не зовсім є «їжею та напоями», ми їх вживаємо, тому давайте подивимося на кислоту, яка, мабуть, є найпоширенішим ліками: ацетилсаліцилова кислота, також відома як аспірин. Аспірин добре відомий як знеболюючий і жарознижуючий засіб (зниження температури).
Будова аспірину показано на супровідному малюнку. Кислотна частина обводиться; це атом Н в цій частині, який може бути пожертвуваний як аспірин діє як кислота Бронстед-Лоурі. Оскільки він не наведено в табл\(\PageIndex{1}\), ацетилсаліцилова кислота є слабкою кислотою. Однак це все ще кислота, і враховуючи, що деякі люди щодня споживають відносно велику кількість аспірину, його кисла природа може спричинити проблеми в слизовій оболонці шлунка, незважаючи на захисні сили шлунка проти власної шлункової кислоти.

Оскільки кислотні властивості аспірину можуть бути проблематичними, багато брендів аспірину пропонують «буферний аспірин» форму ліки. У цих випадках аспірин також містить буферний агент - зазвичай MGO - який регулює кислотність аспірину, щоб мінімізувати його кислі побічні ефекти.
Настільки ж корисним і поширеним, як аспірин, він офіційно продавався як наркотик, починаючи з 1899 року. Управління з контролю за продуктами та ліками США (FDA), урядове агентство, яке звинувачується у нагляді та затвердженні наркотиків у Сполучених Штатах, не було сформовано до 1906 року. Деякі стверджували, що якщо FDA була сформована до введення аспірину, аспірин, можливо, ніколи не отримав схвалення через його потенціал для побічних ефектів - шлунково-кишкова кровотеча, дзвін у вухах, синдром Рейє (проблема з печінкою) та деякі алергічні реакції. Однак, останнім часом аспірин був рекламований за його наслідки в зменшенні інфарктів та інсультів, так що цілком ймовірно, що аспірин залишиться на ринку.
Резюме
- Буфер - це розчин, який протистоїть різким змінам рН.
- Описані реакції, що показують, як буфери регулюють рН.
Автори та атрибуція
- Template:ContribCK12
- TextMap: Beginning Chemistry (Ball et al.)
- Template:ContribAgnewM