7.2: Кислоти та основи
- Page ID
- 20269
- Визначте арренієву кислоту та основу Arrhenius.
- Визначте кислоту Бронстеда-Лоурі та основу Бронстеда-Лоурі.
- Напишіть хімічні реакції між кислотою Arrhenius і основою Arrhenius і між Бронстед-Лоурі кислотою і основою Brønsted-Lowry.
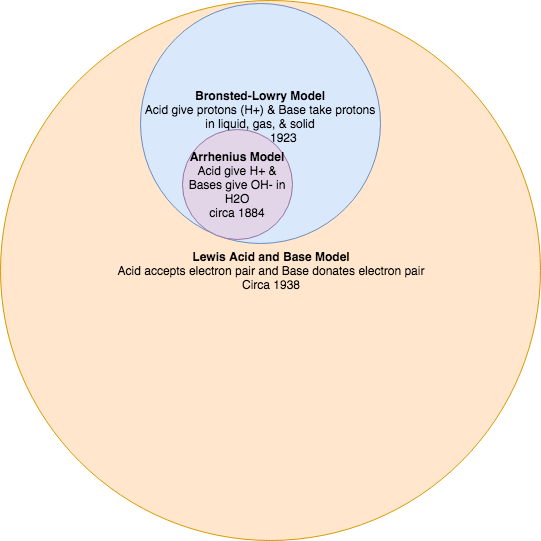
Існує три основні класифікації речовин, відомих як кислоти або основи. Визначення Arrhenius стверджує, що кислота виробляє Н + в розчині, а основа виробляє ОН -. Ця теорія була розроблена Сванте Арреніусом в 1883 році. Пізніше були запропоновані ще дві витончені і загальні теорії. Це Бронстед-Лоурі і Льюїс визначення кислот і підстав. Теорія Льюїса обговорюється в іншому місці.
Арренієва теорія кислот і основ
У 1884 році шведський хімік Сванте Арреніус запропонував дві конкретні класифікації сполук, які називаються кислотами і основами. При розчиненні у водному розчині в розчин виділялися певні іони. Арренієва кислота - це з'єднання, яке збільшує концентрацію\(\ce{H^{+}}\) іонів, які присутні при додаванні до води. Ці іони Н + утворюють іон гідронію (H 3 O +), коли вони поєднуються з молекулами води. Цей процес представлений в хімічному рівнянні шляхом додавання Н 2 О до сторони реагентів.
\[ \ce{HCl(aq) \rightarrow H^{+}(aq) + Cl^{-}(aq) } \nonumber \]
У цій реакції соляна кислота (\(HCl\)) повністю дисоціює на іони водню (H +) і хлору (Cl -) при розчиненні у воді, тим самим виділяючи в розчин іони Н +. Формування рівняння іонів гідронію:
\[\ce{ HCl(aq) + H_2O(l) \rightarrow H_3O^{+}(aq) + Cl^{-}(aq)} \nonumber \]
Основа Arrhenius - це з'єднання, яке збільшує концентрацію\(\ce{OH^{-}}\) іонів, які присутні при додаванні до води. Дисоціація представлена наступним рівнянням:
\[\ce{ NaOH \; (aq) \rightarrow Na^{+} \; (aq) + OH^{-} \; (aq) } \nonumber \]
У цій реакції гідроксид натрію (NaOH) при розчиненні у воді диасоціюється на іони натрію (\(Na^+\)\(OH^-\)) і гідроксиду (), тим самим виділяючи OH - іони в розчин.
Арренієві кислоти - це речовини, які виробляють іони водню в розчині, а основи Arrhenius - речовини, які виробляють гідроксидні іони в розчині.
Теорія Арренія має набагато більше обмежень, ніж дві інші теорії. Теорія не пояснює слабку основу аміаку (NH 3), який в присутності води виділяє гідроксид-іони в розчин, але не містить сам ОН-. Також визначення Arrhenius кислоти і основи обмежується водними (тобто водними) розчинами.
Теорія кислот і основ Бронстеда-Лоурі
У 1923 році датський хімік Йоганнес Бронстед та англійський хімік Томас Лоурі самостійно запропонували нові визначення кислот і основ, які зосереджені на перенесенні протонів. Кислота Бронстеда-Лоурі - це будь-який вид, який може пожертвувати протон (H +) іншій молекулі. Основа Бронстеда-Лоурі - це будь-який вид, який може приймати протон з іншої молекули. Коротше кажучи, кислота Бронстеда-Лоурі є донором протонів (ПД), тоді як основа Бронстеда-Лоурі - це акцептор протонів (ПА).
Кислота Бронстеда-Лоурі є донором протонів, тоді як основа Бронстеда-Лоурі - це акцептор протонів.
Давайте використаємо реакцію аміаку у воді, щоб продемонструвати визначення Бронстеда-Лоурі кислоти та основи. Молекули аміаку та води є реагентами, тоді як іон амонію та гідроксид-іон є продуктами:
\[\ce{NH3(aq) + H2O (ℓ) <=> NH^{+}4(aq) + OH^{−}(aq) }\label{Eq1} \]
Що сталося в цій реакції, полягає в тому, що вихідна молекула води подарила іон водню оригінальній молекулі аміаку, яка, в свою чергу, прийняла іон водню. Ми можемо проілюструвати це наступним чином (рис.\(\PageIndex{2}\)):
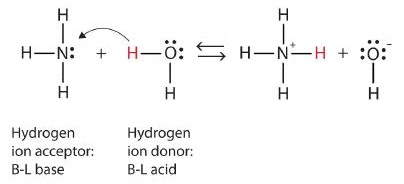
Оскільки молекула води дарує іон водню аміаку, це кислота Бронстеда-Лоурі, тоді як молекула аміаку, яка приймає іон водню, є основою Бронстеда-Лоурі. Таким чином, аміак діє як основа як в сенсі Арренія, так і в сенсі Бронстеда-Лоурі.
Чи є кислота Arrhenius, як соляна кислота, все ще кислотою в розумінні Бронстеда-Лоурі? Так, але це вимагає від нас зрозуміти, що насправді відбувається, коли HCl розчиняється у воді. Нагадаємо, що атом водню - це єдиний протон, оточений одним електроном. Щоб зробити іон водню, видаляємо електрон, залишаючи оголений протон. Чи справді у нас є голі протони, що плавають у водному розчині? Ні, ми цього не робимо. Що насправді відбувається, так це те, що іон Н + приєднується до H 2 O, щоб зробити H 3 O +, який називається іоном гідронію. Для більшості цілей H + і H 3 O + представляють один і той же вид, але написання H 3 O + замість H + показує, що ми розуміємо, що в розчині немає голих протонів. Швидше, ці протони насправді прикріплені до молекул розчинника.
Протон у водному розчині може бути оточений більш ніж однією молекулою води, що призводить до формул, як\(\ce{H5O2^{+}}\) або,\(\ce{H9O4^{+}}\) скоріше, ніж\(\ce{H3O^{+}}\). Простіше, однак, використовувати\(\ce{H3O^{+}}\) для представлення іона гідронію.
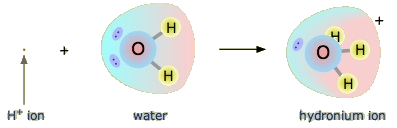
Маючи це на увазі, як ми визначаємо HCl як кислоту в сенсі Бронстеда-Лоурі? Розглянемо, що відбувається, коли HCl розчиняється в Н 2 О:
\[\ce{HCl(g) + H_2O (ℓ) \rightarrow H_3O^{+}(aq) + Cl^{−}(aq) }\label{Eq2} \]
Ми можемо зобразити цей процес за допомогою електронно-точкових діаграм Льюїса (рис.\(\PageIndex{4}\)):
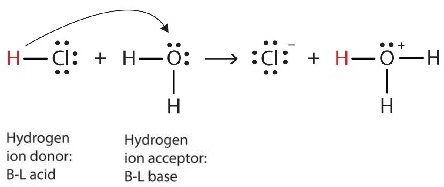
Тепер ми бачимо, що іон водню переноситься з молекули HCl до молекули H 2 O, утворюючи іони хлориду та іони гідронію. Як донор іонів водню, HCl діє як кислота Бронстеда-Лоурі; як акцептор іонів водню, H 2 O є основою Бронстеда-Лоурі. Так HCl є кислотою не тільки в Arrhenius сенсі, але і в Brønsted-Lowry сенсі. Більше того, за визначеннями Бренстеда-Лоурі, H 2 O є основою в утворенні водного HCl. Отже, визначення Brønsted-Lowry кислоти та основи класифікують розчинення HCl у воді як реакцію між кислотою та основою, хоча визначення Arrhenius не позначило б H 2 O основою в цій обставині.
Короткий зміст кислотно-лужних визначень, заснованих на теоріях Арренія і Бронстаса-Лоурі, наведено в табл\(\PageIndex{1}\).
| Тип | Кислота | База |
|---|---|---|
| Арреній | \(\ce{H^+}\)іони в розчині | \(\ce{OH^-}\)іони в розчині |
| Бронстед-Лоурі | \(\ce{H^+}\)донор | \(\ce{H^+}\)акцептор |
Усі кислоти та основи Arrhenius також є кислотами та основами Brønsted-Lowry. Однак не всі кислоти та основи Бронстеда-Лоурі є кислотами та основами Arrhenius.
Анілін (C 6 H 5 NH 2) слабо розчинний у воді. Він має атом азоту, який може приймати іон водню з молекули води так само, як це робить атом азоту в аміаку. Напишіть хімічне рівняння для цієї реакції та визначте кислоту та основу Бронстеда-Лоурі.
Рішення
C 6 H 5 NH 2 і H 2 O є реагентами. Коли C 6 H 5 NH 2 приймає протон з H 2 O, він отримує додатковий H і позитивний заряд і залишає OH − іон позаду. Реакція наступна:
\[\ce{C6H5NH2(aq) + H2O(ℓ) <=> C6H5NH3^{+}(aq) + OH^{−}(aq)} \nonumber \]
Оскільки C 6 H 5 NH 2 приймає протон, це основа Бронстеда-Лоурі. Молекула H 2 O, оскільки вона дарує протон, є кислотою Бронстеда-Лоурі.
Визначте кислоту Бренстеда-Лоурі та основу Бренстеда-Лоурі в цьому хімічному рівнянні.
\[\ce{H2PO4^{-} + H_2O <=> HPO4^{2-} + H3O^{+}} \nonumber \]
- Відповідь
- Розморожено-Lowry кислота: H 2 PO 4 -; Бронстед-Лоурі основа: H 2 O
Яке з перерахованих нижче сполук є основою Бронстеда-Лоурі?
- HCl
- ГПО 4 2 -
- Н 3 ПОЗ 4
- NH 4 +
- СН 3 Н 3 +
- Відповідь:
-
База Бронстеда-Лоурі - це протонний акцептор, що означає, що він буде приймати H +. Це усуває\(\ce{HCl}\)\(\ce{H3PO4}\),\(\ce{NH4^{+}}\) і\(\ce{CH_3NH_3^{+}}\) тому вони є Бронстед-Лоурі кислотами. Всі вони віддають протони. У разі\(\ce{HPO4^{2-}}\), розглянемо наступне рівняння:
\[\ce{HPO4^{2-} (aq) + H2O (l) \rightarrow PO4^{3-} (aq) + H3O^{+}(aq) } \nonumber \]
Тут зрозуміло, що HPO 4 2 - це кислота, оскільки вона дарує протон воді, щоб зробити H 3 O + та PO 4 3 -. Тепер розглянемо наступне рівняння:
\[ \ce{ HPO4^{2-}(aq) + H2O(l) \rightarrow H2PO4^{-} + OH^{-}(aq)} \nonumber \]
У цьому випадку HPO 4 2 - є основою, оскільки приймає протон з води для утворення H 2 PO 4 - і OH -. Таким чином, ГПО 4 2 - це кислота і основа разом, що робить її амфотерною.
Оскільки ГПО 4 2 - це єдине з'єднання з варіантів, яке може виступати в якості основи, відповідь буде (б) ГПО 4 2 -.
Резюме
- Арренієва кислота - це сполука, яка збільшує концентрацію іонів H +, а основа Арреніуса - сполука, яка збільшує концентрацію OH − іонів у водному розчині.
- Кислота Бронстеда-Лоурі є донором протонів; основа Бронстеда-Лоурі - це акцептор протонів.
- Усі кислоти та основи Arrhenius також є кислотами та основами Brønsted-Lowry. Однак не всі кислоти та основи Бронстеда-Лоурі є кислотами та основами Arrhenius.
Автори та атрибуція
- Libretext: The Basics of GOB Chemistry (Ball et al.)
- Template:ContribAgnewM
- Libretext: Chemistry for Allied Health (Soult)