6.3: Сили між молекулами
- Опишіть типи міжмолекулярних сил, можливих між атомами або молекулами в конденсованих фазах (сили дисперсії, дипольно-дипольні атракціони та водневий зв'язок)
- Визначте типи міжмолекулярних сил, які відчувають конкретні молекули на основі їх структур
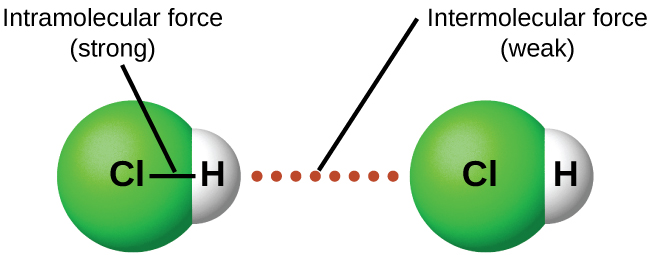
За відповідних умов атракціони між усіма молекулами газу призведуть до того, що вони утворюють рідини або тверді речовини. Це пов'язано з міжмолекулярними силами, а не внутрішньомолекулярними силами. Внутрішні молекулярні сили - це ті, що знаходяться всередині молекули, які утримують молекулу разом, наприклад, зв'язки між атомами. Між молекулярними силами є атракціони між молекулами, які визначають багато фізичних властивостей речовини. Малюнок6.3.1 ілюструє ці різні молекулярні сили. Сильні сторони цих привабливих сил сильно різняться, хоча зазвичай IMF між малими молекулами слабкі порівняно з внутрішньомолекулярними силами, які зв'язують атоми разом всередині молекули. Наприклад, для подолання ІМФ в одному молі рідкого HCl і перетворення його в газоподібний HCl потрібно всього близько 17 кілоджоулів. Однак для розриву ковалентних зв'язків між атомами водню і хлору в одному молі HCl потрібно приблизно в 25 разів більше енергії — 430 кілоджоулів.
Дипольно-дипольні сили
Дипольно-дипольні сили - це сили привабливості, що виникають між полярними молекулами (див. Малюнок нижче). Молекула хлористого водню має частково позитивний атом водню і частково негативний атом хлору. Колекція багатьох молекул хлористого водню вирівняється так, що протилежно заряджені області сусідніх молекул знаходяться поруч один з одним.
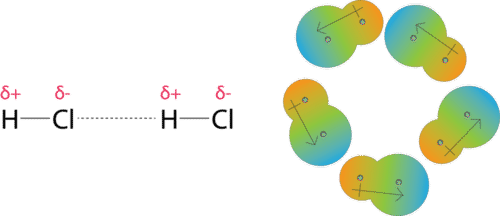
Сила міжмолекулярних взаємодій збільшується в міру збільшення дипольного моменту молекул, як показано в табл6.3.1.
| З'єднання | Молярна маса (г/моль) | Дипольний момент (D) | Точка кипіння (K) |
|---|---|---|---|
| C 3 H 6 (циклопропан) | 42 | 0 | 240 |
| СН 3 ОЧ 3 (диметиловий ефір) | 46 | 1.30 | 248 |
| СН 3 CN (ацетонітрил) | 41 | 3.9 | 355 |
Енергія привабливості між двома іонами пропорційна 1/r, тоді як енергія привабливості між двома диполями пропорційна 1/r6.
Передбачте, яка буде мати більш високу температуру кипіння: N 2 або CO. Поясніть свої міркування.
Рішення
CO і N 2 є двоатомними молекулами з масою близько 28 ам, тому вони відчувають подібні лондонські сили дисперсії. Оскільки СО є полярною молекулою, вона відчуває дипольно-дипольні атракціони. Оскільки N 2 неполярний, його молекули не можуть демонструвати дипольно-дипольні атракціони. Дипольно-дипольні атракціони між молекулами СО порівняно сильніші, ніж сили дисперсії між неполярними молекулами N 2, тому CO, як очікується, матиме вищу температуру кипіння.
Поширеним методом приготування кисню є розкладання.
Передбачте, яка буде мати більш високу температуру кипіння:ICl абоBr2. Поясніть свої міркування.
- Відповідь
-
iCl. iCl і Br 2 мають подібні маси (~ 160 аму) і тому відчувають подібні лондонські сили розсіювання. iCl є полярним і, таким чином, також демонструє дипольно-дипольні атракціони; Br 2 неполярний і не має. Відносно сильніші дипольно-дипольні атракціони вимагають більше енергії для подолання, тому iCl матиме вищу температуру кипіння
Дисперсійні сили
Сили дисперсії - найслабші з усіх міжмолекулярних сил. Їх часто називають лондонськими військами після Фріца Лондона (1900 - 1954), який вперше запропонував своє існування в 1930 році. Лондонські сили дисперсії - це міжмолекулярні сили, які виникають між усіма атомами і молекулами внаслідок випадкового руху електронів.
Наприклад, електронна хмара атома гелію містить два електрони, і при усередненні з часом ці електрони будуть рівномірно розподілятися навколо ядра. Однак в будь-який момент розподіл електронів може бути нерівномірним, в результаті чого утворюється миттєвий диполь. Цей слабкий і тимчасовий диполь може згодом впливати на сусідні атоми гелію за допомогою електростатичного тяжіння та відштовхування. Формування індукованого диполя показано нижче.

Сили дисперсії, що розвиваються між атомами в різних молекулах, можуть притягувати дві молекули один до одного. Однак сили відносно слабкі і стають значними лише тоді, коли молекули знаходяться дуже близько. Більші та важчі атоми та молекули виявляють сильніші сили дисперсії, ніж менші та легші атоми та молекули. F 2 і Cl 2 - гази кімнатної температури (відображають слабші сили притягання); Br 2 - рідина, а I 2 - тверда речовина (що відображає більш сильні сили тяжіння). Тенденції в спостережуваних температурах плавлення і кипіння галогенів наочно демонструють цей ефект, як видно в табл6.3.1.
| Галогенні | Молярна маса | Атомний радіус | Точка плавлення | Точка кипіння |
|---|---|---|---|---|
| фтор, F 2 | 38 г/моль | 72 вечора | 53 КМ | 85 КМ |
| хлор, Cl 2 | 71 г/моль | 9 вечора | 172 КМ | 238 КМ |
| бром, Br 2 | 160 г/моль | 114 вечора | 266 КМ | 332 КМ |
| йод, I 2 | 254 г/моль | 133 вечора | 387 КМ | 457 КМ |
| астатин, В 2 | 420 г/моль | 150 вечора | 575 КМ | 610 КМ |
Збільшення температури плавлення та кипіння зі збільшенням атомного/молекулярного розміру може бути раціоналізовано, враховуючи, як на силу сил дисперсії впливає електронна структура атомів або молекул речовини. У більшому атомі валентні електрони знаходяться, в середньому, далі від ядер, ніж в меншому атомі. Таким чином, вони менш міцно утримуються і можуть легше утворювати тимчасові диполі, які виробляють тяжіння. Міра того, наскільки легко або важко інший електростатичний заряд (наприклад, сусідній іон або полярна молекула) спотворює розподіл заряду молекули (її електронна хмара), відома як поляризуваність. Молекула, яка має хмару заряду, яка легко спотворюється, вважається дуже поляризованою і матиме великі сили дисперсії; одна з хмарою заряду, яку важко спотворювати, не дуже поляризується і матиме малі сили дисперсії.
Для подібних речовин лондонські сили дисперсії стають сильнішими зі збільшенням атомних або молекулярних розмірів.
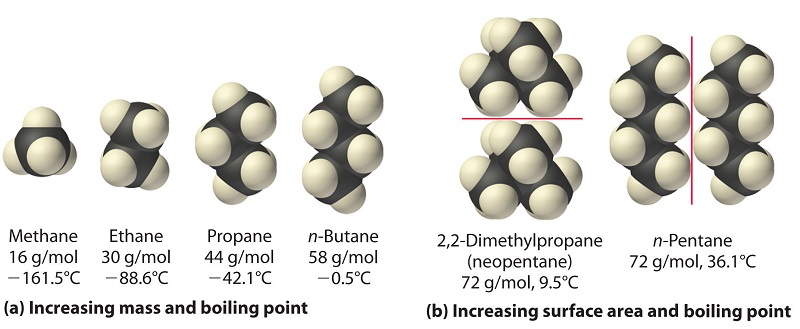
Сильні сили лондонських сил дисперсії також значно залежать від молекулярної форми, оскільки форма визначає, наскільки одна молекула може взаємодіяти з сусідніми молекулами в будь-який момент часу. Наприклад, частина (b) на малюнку6.3.4 показує 2,2-диметилпропан (неопентан) і n -пентан, обидва з яких мають емпіричну формулу C 5 H 12. Неопентан майже сферичний, з невеликою площею поверхні для міжмолекулярних взаємодій, тоді як n -пентан має розширену конформацію, яка дозволяє йому вступати в тісний контакт з іншими молекулами n -пентану. В результаті температура кипіння неопентану (9,5° C) більш ніж на 25° C нижча за температуру кипіння n -пентану (36,1° C).
Усі молекули, будь то полярні чи неполярні, притягуються один до одного лондонськими силами дисперсії на додаток до будь-яких інших привабливих сил, які можуть бути присутніми.
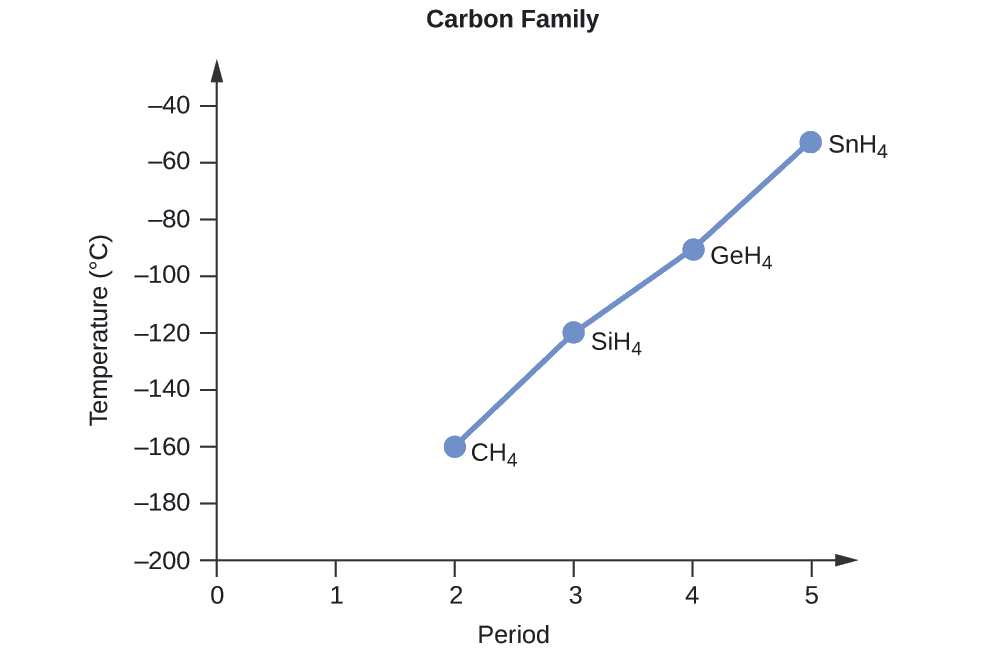
Замовте наступні сполуки елемента 14 групи та водню від найнижчої до найвищої температури кипіння: CH 4, SiH 4, GeH 4 та SnH 4. Поясніть свої міркування.
Дано: сполуки
Запитано: порядок збільшення температури кипіння
Стратегія:
Визначте міжмолекулярні сили в з'єднанні. Також порівняйте молярні маси і площу поверхні з'єднань зі схожими типами міжмолекулярної сили. Речовина з найслабшими силами і найнижчими молярними масами і найменшою площею поверхні мають найнижчу температуру кипіння.
Рішення
Застосовуючи навички, набуті в розділі про хімічне зв'язування та молекулярну геометрію, всі ці сполуки прогнозуються як неполярні, тому вони можуть відчувати лише сили дисперсії: чим менше молекула, тим менше поляризуються і слабкіші сили дисперсії; чим більше молекула, тим більше сили розсіювання. Молярні маси СН 4, SiH 4, GeH 4 і SnH 4 складають приблизно 16 г/моль, 32 г/моль, 77 г/моль і 123 г/моль відповідно. Тому очікується, що CH 4 матиме найнижчу температуру кипіння, а SnH 4 - найвищу температуру кипіння. Очікується, що замовлення від найнижчої до найвищої температури кипіння буде
СН 4 < SiH 4 < ГеГ 4 < SnH 4
Графік фактичних температур кипіння цих сполук у порівнянні з періодом групи 14 елементів показує, що це прогноз є правильним:
Замовте наступні вуглеводні від найнижчої до найвищої температури кипіння: C 2 H 6, C 3 H 8, і C 4 H 10.
- Відповідь
-
Всі ці сполуки неполярні і мають лише лондонські сили дисперсії: чим більше молекула, тим більші сили дисперсії і тим вище температура кипіння. Тому замовлення від найнижчої до найвищої температури кипіння
С 2 Н 6 < С 3 Н 8 < С 4 Н 10.
водневі зв'язки
Приваблива сила між молекулами води є надзвичайно сильним типом дипольно-дипольної взаємодії. Вода містить атоми водню, які пов'язані з високоелектронегативним атомом кисню, що робить для дуже полярних зв'язків. Частково позитивний атом водню однієї молекули потім притягується до атома кисню сусідньої молекули води (див. Малюнок нижче).
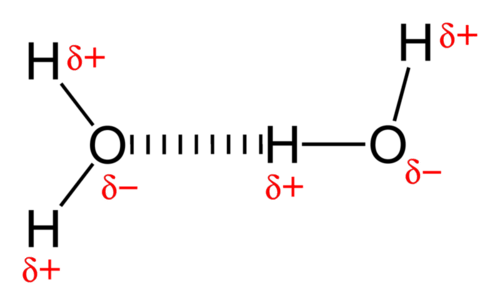
Водневий зв'язок - це міжмолекулярна сила привабливості, в якій атом водню, ковалентно пов'язаний з невеликим високоелектронегативним атомом, притягується до одинокої пари електронів на атомі в сусідній молекулі. Водневі зв'язки дуже міцні в порівнянні з іншими дипольно-дипольними взаємодіями, але все ще набагато слабкіше, ніж ковалентний зв'язок. Типовий водневий зв'язок приблизно такий5% же міцний, як і ковалентний зв'язок.
Водневий зв'язок відбувається тільки в молекулах, де водень ковалентно пов'язаний з одним з трьох елементів: фтором, киснем або азотом. Ці три елементи настільки електронегативні, що виводять більшу частину електронної щільності з ковалентного зв'язку з воднем, залишаючиH атом дуже електронно-дефіцитним. Оскільки атом водню не має ніяких електронів, крім тих, що знаходяться в ковалентному зв'язку, його позитивно заряджене ядро майже повністю піддається впливу, дозволяючи сильні притягання до інших сусідніх одиноких пар електронів.
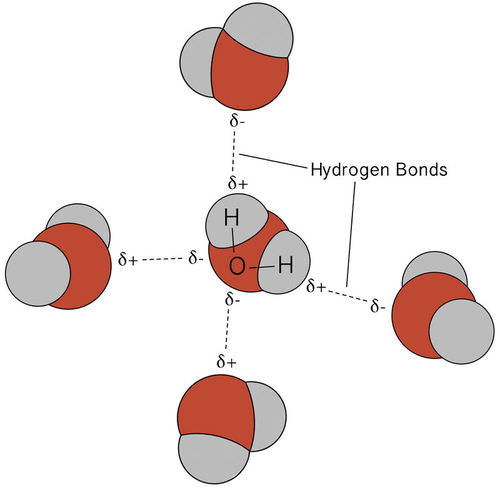
Водневе з'єднання, яке відбувається у воді, призводить до деяких незвичайних, але дуже важливих властивостей. Більшість молекулярних сполук, які мають масу, подібну до води, є газами кімнатної температури. Однак через міцних водневих зв'язків молекули води здатні залишатися конденсованими в рідкому стані. На малюнку нижче показано, як її зігнута форма та наявність двох атомів водню на молекулу дозволяють кожній молекулі води зв'язуватися з декількома іншими молекулами.
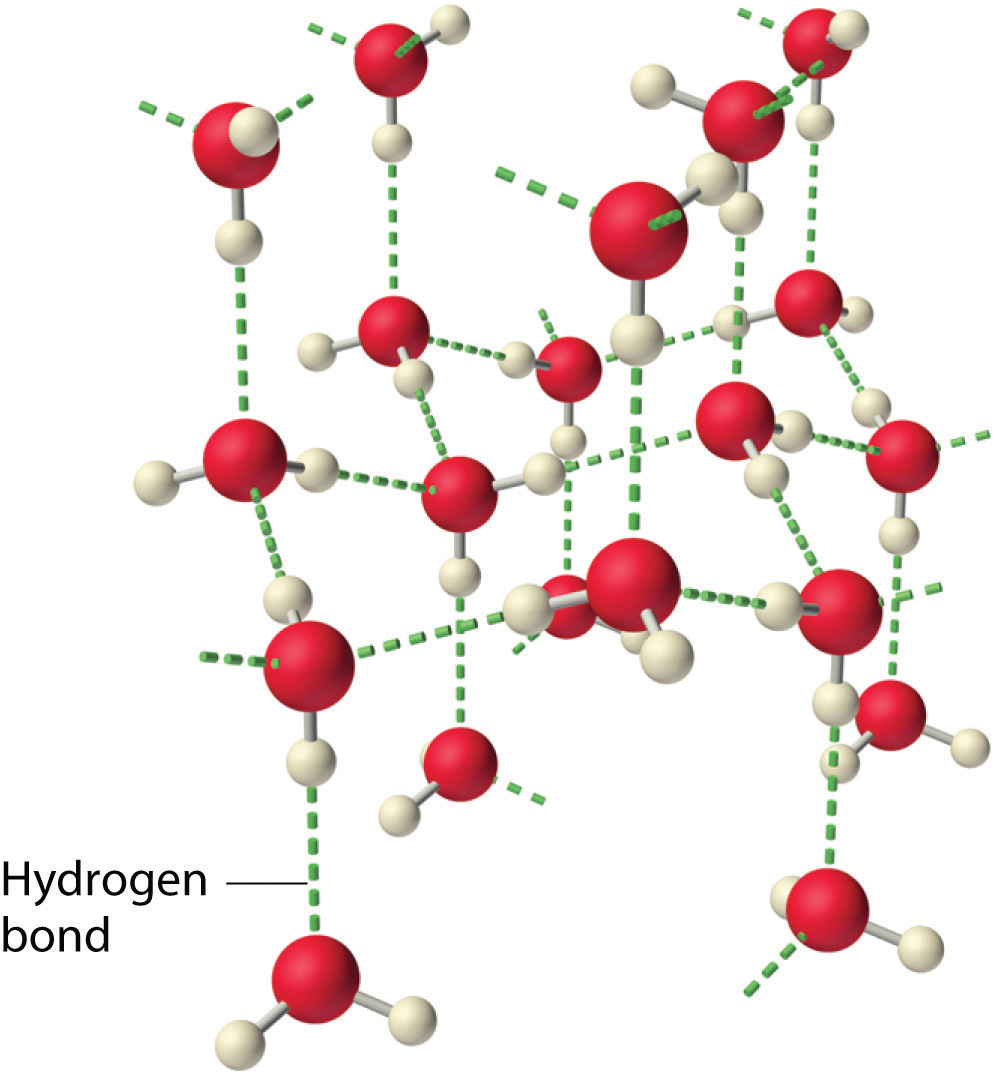
У рідкому стані водневі зв'язки води можуть розриватися і реформуватися в міру перетікання молекул з одного місця в інше. Коли вода охолоджується, молекули починають сповільнюватися. Зрештою, коли вода замерзає до льоду, водневі зв'язки стають більш жорсткими і утворюють чітко визначену мережу (рис6.3.7). . Зігнута форма молекул призводить до розривів у водневій мережі зв'язку льоду. Лід має дуже незвичайну властивість, що його твердий стан менш щільне, ніж рідкий. В результаті лід плаває в рідкій воді. Практично всі інші речовини щільніше в твердому стані, ніж в рідкому. Водневі зв'язки також відіграють дуже важливу біологічну роль у фізичних структурах білків і нуклеїнових кислот.
Утворення водневих зв'язків вимагає як донора водневих зв'язків, так і акцептора водневих зв'язків.
Оскільки лід менш щільний, ніж рідка вода, річки, озера та океани замерзають зверху вниз. Насправді лід утворює захисний поверхневий шар, який ізолює решту води, дозволяючи рибам та іншим організмам виживати на нижніх рівнях замерзлого озера чи моря. Якби лід був щільніше рідини, лід, що утворюється на поверхні в холодну погоду, опускався б так само швидко, як і утворювався. Водойми замерзнуть знизу вгору, що було б смертельно для більшості водних істот. Розширення води при замерзанні також пояснює, чому автомобільні або човнові двигуни повинні бути захищені «антифризом» і чому ламаються незахищені труби в будинках, якщо їм дозволяють замерзнути.
Сила міжмолекулярних сил
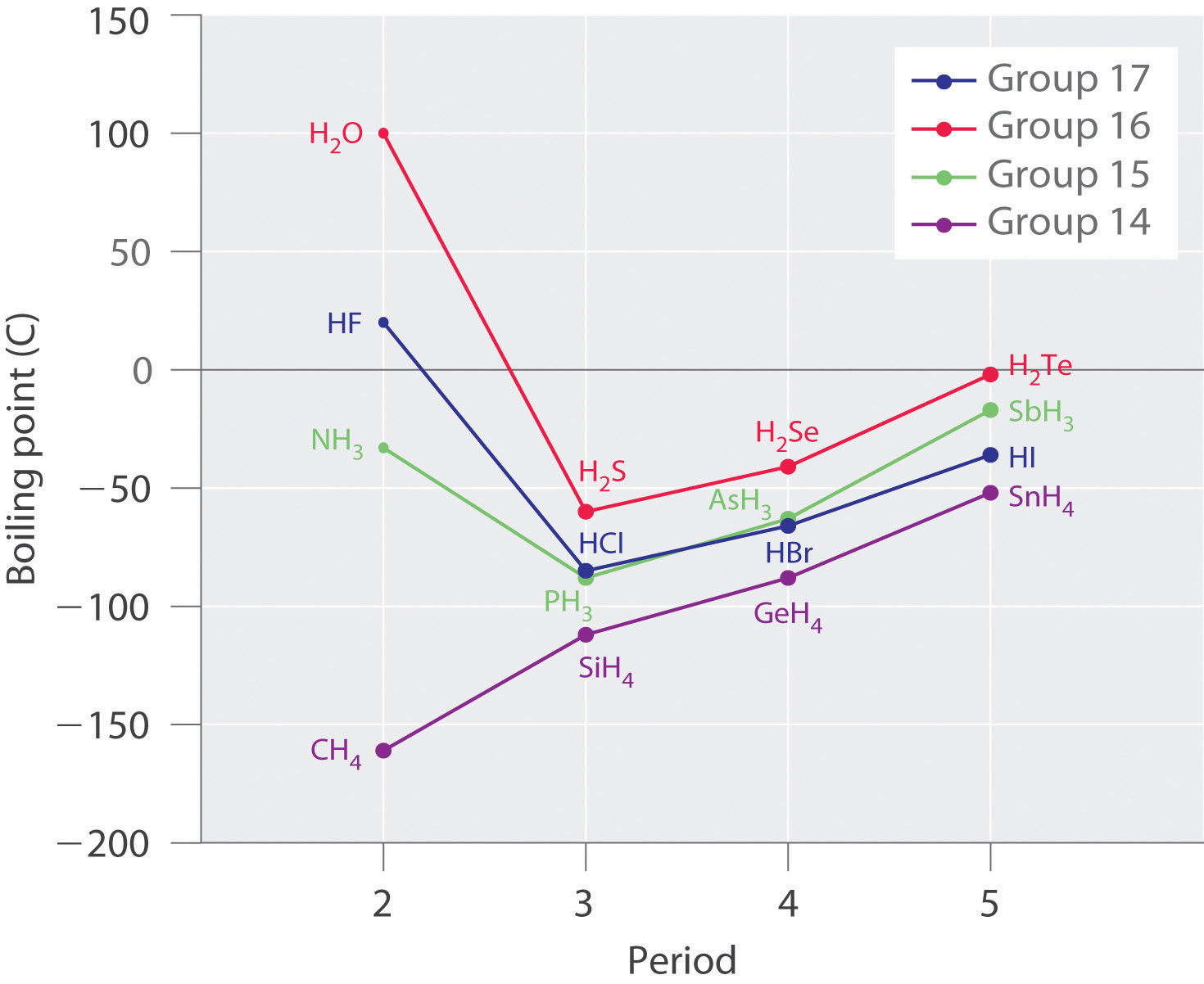
Молекули з атомами водню, пов'язані з електронегативними атомами, такими як O, N і F, мають тенденцію виявляти надзвичайно сильні міжмолекулярні взаємодії завдяки водневим зв'язкам, як показано для ковалентних гідридів елементів груп 14-17 на рис6.3.8. Це призводить до набагато вищих температур кипіння, ніж спостерігаються для речовин, в яких домінують дипольно-дипольні сили або лондонські сили дисперсії. Всі полярні молекули (з переважно дипольно-дипольними силами) групи 16 (H 2 S до H 2 Te) мають більш низькі температури кипіння, ніж H 2 O (з водневими зв'язками). Метан та його важчі родичі в групі 14 утворюють ряд, температури кипіння якого плавно збільшуються зі збільшенням молярної маси. Це очікувана тенденція в неполярних молекулах, для яких лондонські сили дисперсії є винятковими міжмолекулярними силами. На відміну від цього, гідриди найлегших членів груп 15—17 мають точки кипіння, які більш ніж на 100° C перевищують прогнозовані на основі їх молярних мас. Ефект найбільш драматичний для води: якщо продовжити пряму лінію, що з'єднує точки для H 2 Te і H 2 Se до лінії за період 2, то отримаємо розрахункову температуру кипіння −130°C для води! Уявіть собі наслідки для життя на Землі, якщо вода кип'ятилася при −130° C, а не 100° C.
Розглядаючи СН 3 ОН, С 2 Н 6, Xe, і (СН 3) 3 N, які можуть утворювати водневі зв'язки з собою? Намалюйте конструкції, пов'язані з воднем.
Дано: сполуки
Запитували: формування водневих зв'язків і структури
Стратегія:
- Визначте сполуки з атомом водню, приєднаним до O, N або F. Вони, ймовірно, зможуть діяти як донори водневих зв'язків.
- З сполук, які можуть виступати донорами водневих зв'язків, виділіть ті, які також містять поодинокі пари електронів, які дозволяють їм бути акцепторами водневих зв'язків. Якщо речовина є і донором водню, і акцептором водневих зв'язків, намалюйте структуру, що показує водневий зв'язок.
Рішення:
A З перерахованих видів ксенон (Xe), етан (C 2 H 6) та триметиламін [(CH 3) 3 N] не містять атома водню, приєднаного до O, N або F; отже, вони не можуть діяти як донори водневих зв'язків.
B Єдина сполука, яка може діяти як донор водневих зв'язків, метанол (CH 3 OH), містить як атом водню, приєднаний до O (що робить його донором водневих зв'язків), так і дві самотні пари електронів на O (що робить його акцептором водневих зв'язків); метанол може таким чином утворювати водневі зв'язки, діючи як або донор водневих зв'язків або акцептор водневих зв'язків. Воднева структура метанолу виглядає наступним чином:
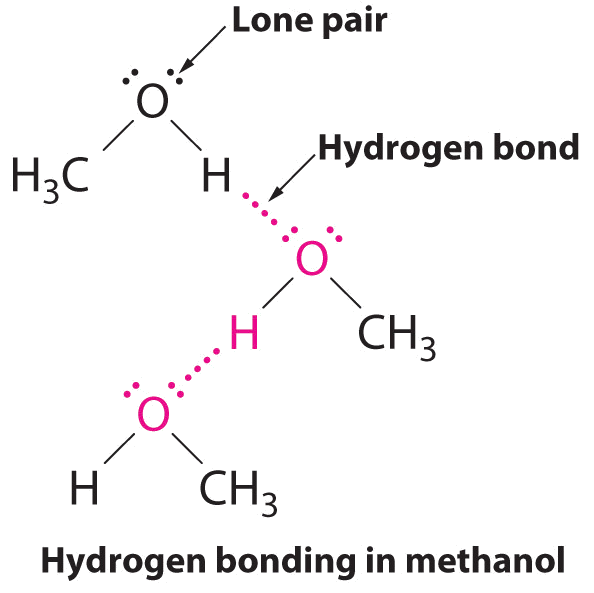
Розглядаючи CH 3 CO 2 H, (CH 3) 3 N, NH 3 і CH 3 F, які можуть утворювати водневі зв'язки з собою? Намалюйте конструкції, пов'язані з воднем.
- Відповідь
-
СН 3 СО 2 Н і Н 3;
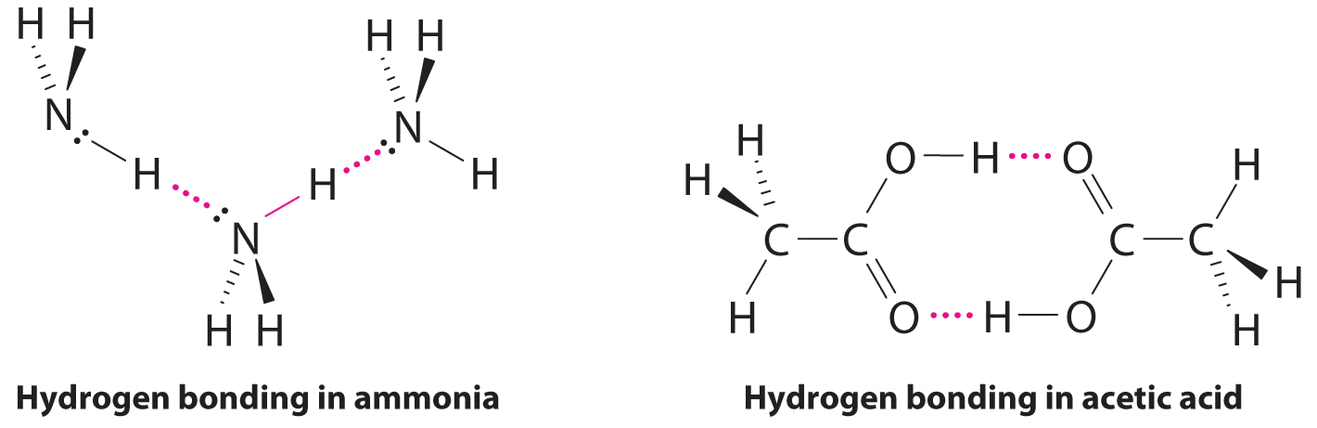
Хоча водневі зв'язки значно слабкіше ковалентних зв'язків, при типових енергіях дисоціації всього 15-25 кДж/моль вони мають значний вплив на фізичні властивості сполуки. Такі сполуки, як HF, можуть одночасно утворювати лише дві водневі зв'язки, як це може, в середньому, чиста рідина NH 3. Отже, навіть незважаючи на те, що їх молекулярні маси подібні до води, їх температура кипіння значно нижча за температуру кипіння води, яка одночасно утворює чотири водневі зв'язки.
Організувати C 60 (бакмінстерфуллерен, який має структуру клітини), NaCl, He, Ar і N 2 O в порядку збільшення температури кипіння.
Дано: сполуки
Запитано: порядок збільшення температури кипіння
Стратегія:
Визначте міжмолекулярні сили в кожній сполуці, а потім організуйте сполуки відповідно до сили цих сил. Речовина з найслабшими силами матиме найнижчу температуру кипіння.
Рішення:
Електростатичні взаємодії є найсильнішими для іонної сполуки, тому ми очікуємо, що NaCl матиме найвищу температуру кипіння. Щоб передбачити відносні точки кипіння інших сполук, ми повинні враховувати їх полярність (для диполь-дипольних взаємодій), їх здатність утворювати водневі зв'язки та їх молярну масу (для лондонських сил дисперсії). Гелій неполярний і на сьогоднішній день найлегший, тому він повинен мати найнижчу температуру кипіння. Аргон і N 2 O мають дуже схожі молярні маси (40 і 44 г/моль відповідно), але N 2 O є полярним, тоді як Ar - ні. Отже, N 2 O повинен мати більш високу температуру кипіння. Молекула C 60 неполярна, але її молярна маса становить 720 г/моль, набагато більше, ніж у Ar або N 2 O. Оскільки точки кипіння неполярних речовин швидко зростають з молекулярною масою, C 60 повинен кипіти при більш високій температурі, ніж інші неіонні речовини. Таким чином, прогнозований порядок виглядає наступним чином, з фактичними точками кипіння в дужках:
Він (−269° C) < Ar (−185,7° C) < N 2 O (−88,5° C) < C 60 (>280° C) < NaCl (1465° C).
Організуйте 2,4-диметилгептан, Ne, CS 2, Cl 2 і KBr в порядку зменшення температури кипіння.
- Відповідь
-
KBr (1435° C) > 2,4-диметилгептан (132,9° C) > CS 2 (46,6° C) > Cl 2 (−34,6° C) > Ne (−246° C)
Визначте найбільш значущу міжмолекулярну силу в кожній речовині.
- С 3 Ч 8
- СН 3 ОН
- Н 2 С
Рішення
а Хоча зв'язки C—H полярні, вони лише мінімально полярні. Найбільш значущою міжмолекулярною силою для цієї речовини були б сили дисперсії.
б Ця молекула має атом Н, пов'язаний з атомом O, тому вона буде відчувати водневий зв'язок.
c Хоча ця молекула не відчуває водневого зв'язку, електронна діаграма Льюїса та VSEPR вказують на те, що вона зігнута, тому вона має постійний диполь. Найзначнішою силою в цій речовині є дипольно-дипольна взаємодія.
Визначте найбільш значущу міжмолекулярну силу в кожній речовині.
- HF
- HCl
- Відповідь на
-
водневий зв'язок
- Відповідь б
-
дипольно-дипольні взаємодії
Резюме
- Молекули в рідинях утримуються до інших молекул за допомогою міжмолекулярних взаємодій, які слабкіші, ніж внутрішньомолекулярні взаємодії, які утримують атоми разом всередині молекул та багатоатомних іонів.
- Дипольно-дипольні взаємодії виникають внаслідок електростатичних взаємодій позитивних та негативних кінців молекул з постійними дипольними моментами.
- Лондонські сили дисперсії обумовлені утворенням миттєвих дипольних моментів в полярних і неполярних молекулах в результаті короткочасних флуктуацій розподілу електронного заряду, які, в свою чергу, викликають тимчасове утворення індукованого диполя в сусідніх молекули.
- Водневі зв'язки є особливо сильними дипольно-дипольними взаємодіями між молекулами, які мають водень пов'язаний з високоелектронегативним атомом, таким як O, N або F. Отриманий частково позитивно заряджений атом Н на одній молекулі (донор водневих зв'язків) може сильно взаємодіяти з одинока пара електронів частково негативно зарядженого атома O, N або F на сусідніх молекулах (акцептор водневих зв'язків).
Автори та атрибуція
- TextMap: Chemistry the Central Science (Brown et al.
- Template:ContribOpenStax
- Template:ContribAgnewM
- Libretext: Chemistry for Allied Health (Soult)