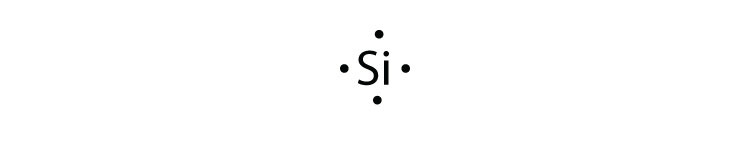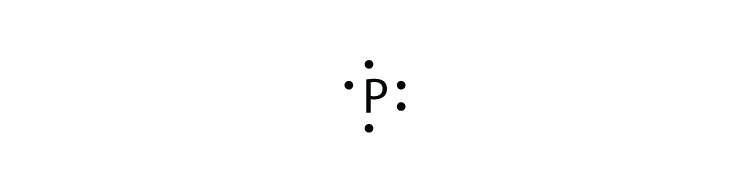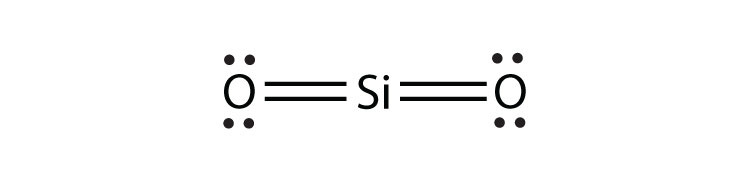9.E: Хімічні зв'язки (вправи)
- Page ID
- 22559
9.2: Електронні діаграми Льюїса
- Поясніть, чому перші дві точки на електронній діаграмі Льюїса намальовані на тій же стороні атомного символу.
- Чи потрібно, щоб перша точка навколо атомного символу йшла на певну сторону атомного символу?
- Який стовпець таблиці Менделєєва має електронно-точкові діаграми Льюїса з двома електронами?
- Який стовпець таблиці Менделєєва має електронні точкові діаграми Льюїса, які мають шість електронів в них?
- Намалюйте електронну точкову діаграму Льюїса для кожного елемента.
- стронцій
- кремній
- Намалюйте електронну точкову діаграму Льюїса для кожного елемента.
- криптон
- сірки
- Намалюйте електронну точкову діаграму Льюїса для кожного елемента.
- титан
- фосфор
- Намалюйте електронну точкову діаграму Льюїса для кожного елемента.
- брому
- галію
- Намалюйте електронну точкову діаграму Льюїса для кожного іона.
- Мг 2+
- S 2−
- Намалюйте електронну точкову діаграму Льюїса для кожного іона.
- В +
- Br −
- Намалюйте електронну точкову діаграму Льюїса для кожного іона.
- Фе 2+
- N 3−
- Намалюйте електронну точкову діаграму Льюїса для кожного іона.
- Н +
- H −
Відповіді
- Перші два електрони в валентній оболонці є s електронів, які є парними.
- друга колонка таблиці Менделєєва
-
-
-
- Мг 2+
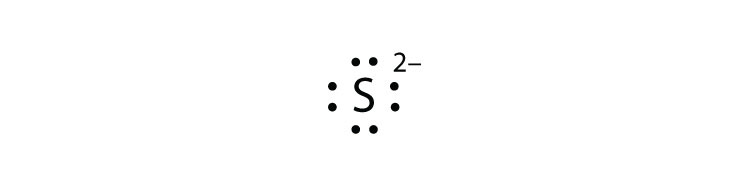
-
- Фе 2+

9.3: Перенесення електронів - іонні зв'язки
- Прокоментуйте можливе утворення іона К 2+. Чому його утворення малоймовірне?
-
Прокоментуйте можливе утворення іона Cl 2−. Чому його утворення малоймовірне?
-
Скільки електронів повинен втратити атом Ba, щоб мати повний октет у своїй валентній оболонці?
-
Скільки електронів повинен втратити атом Pb, щоб мати повний октет у своїй валентній оболонці?
-
Скільки електронів повинен отримати атом Se, щоб мати повний октет у своїй валентній оболонці?
-
Скільки електронів повинен отримати атом N, щоб мати повний октет у своїй валентній оболонці?
-
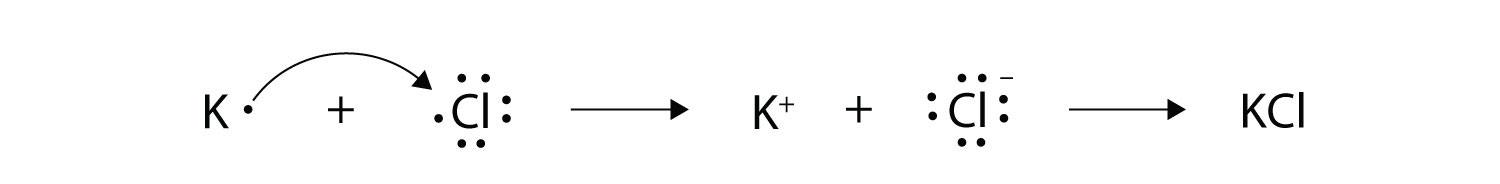
Стрілками проілюструйте перенесення електронів з утворенням хлориду калію з атомів K і атомів Cl.
-
Стрілками проілюструйте перенесення електронів з утворенням сульфіду магнію від атомів Mg і S атомів.
-
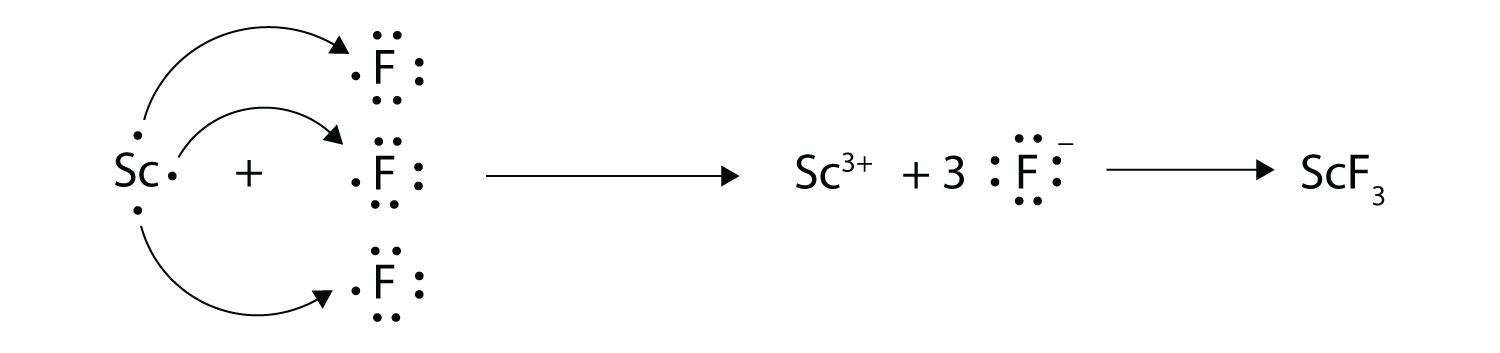
Стрілками проілюструйте перенесення електронів з утворенням фториду скандію з атомів Sc і атомів F.
-
Стрілками проілюструйте перенесення електронів з утворенням фосфіду рубідію з атомів Rb і атомів P.
-
Яка іонна сполука має вищу енергію решітки - Ki або MgO? Чому?
-
Яка іонна сполука має вищу енергію решітки - Ki або LiF? Чому?
- Яка іонна сполука має вищу енергію решітки - Bas або MgO? Чому?
Відповіді
- Іон K 2+ навряд чи сформується, оскільки іон K + вже задовольняє октетному правилу і є досить стабільним.
- два
- два
- MgO, оскільки іони мають більш високу величину заряду
- MgO, оскільки іони менші
9.4: Ковалентні облігації
- Скільки електронів буде в валентній оболонці атомів Н, коли вона утворює ковалентний зв'язок?
- Скільки електронів буде в валентній оболонці атомів, що не є Н, коли вони утворюють ковалентні зв'язки?
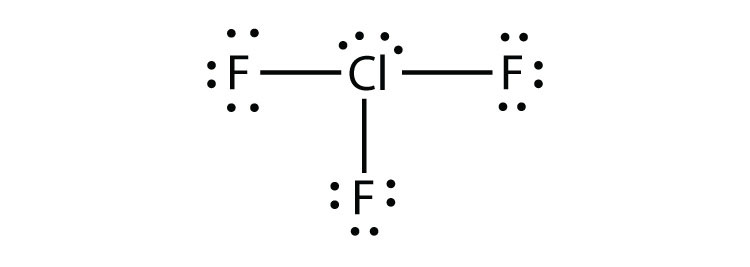
- Що таке електронна точкова діаграма Льюїса I 2? Обведіть електрони навколо кожного атома, щоб переконатися, що кожна валентна оболонка заповнена.
- Що таке електронна точкова діаграма Льюїса H 2 S? Обведіть електрони навколо кожного атома, щоб переконатися, що кожна валентна оболонка заповнена.
- Що таке електронна точкова діаграма Льюїса NCl 3? Обведіть електрони навколо кожного атома, щоб переконатися, що кожна валентна оболонка заповнена.
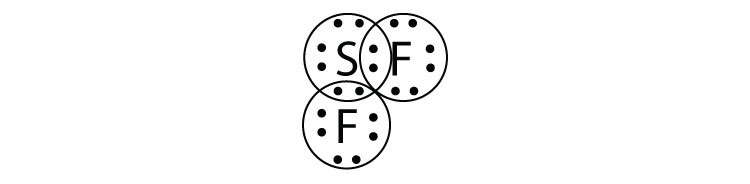
- Що таке електронна точкова діаграма Льюїса SiF 4? Обведіть електрони навколо кожного атома, щоб переконатися, що кожна валентна оболонка заповнена.
- Намалюйте електронну точкову діаграму Льюїса для кожної речовини.
- СФ 2
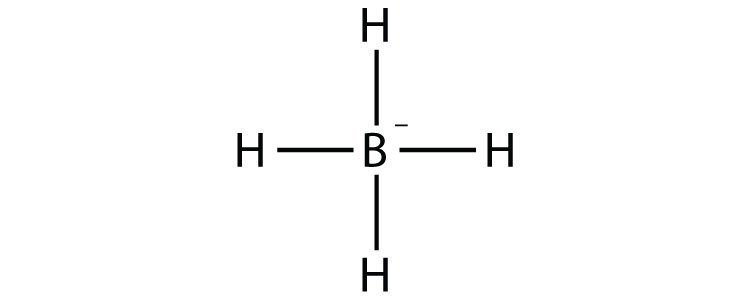
- ВН 4 −
- Намалюйте електронну точкову діаграму Льюїса для кожної речовини.
- ПІ 3
- ОХ −
- Намалюйте електронну точкову діаграму Льюїса для кожної речовини.
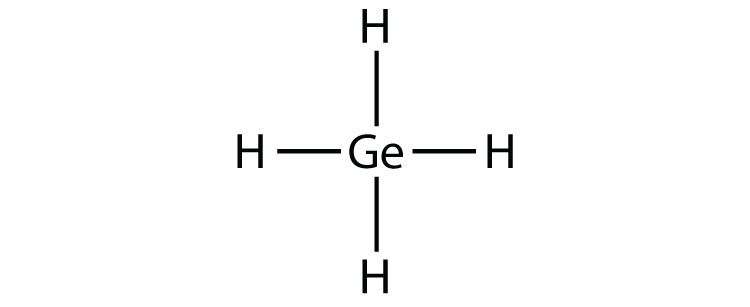
- Гех 4
- CLF
- Намалюйте електронну точкову діаграму Льюїса для кожної речовини.
- СаФ 3
- NH 4 +
- Намалюйте електронну точкову діаграму Льюїса для кожної речовини. Можуть знадобитися подвійні або потрійні зв'язки.
- ІСО 2
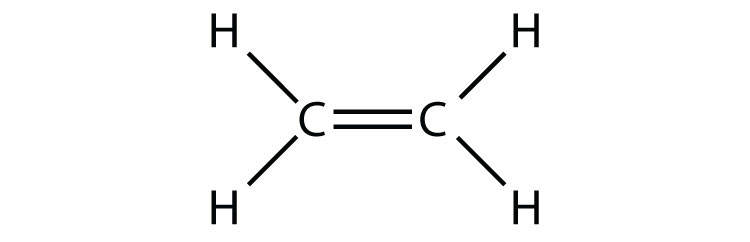
- C 2 H 4 (припустимо два центральних атома)
- Намалюйте електронну точкову діаграму Льюїса для кожної речовини. Можуть знадобитися подвійні або потрійні зв'язки.
- CN −
- C 2 Cl 2 (припустимо два центральних атома)
- Намалюйте електронну точкову діаграму Льюїса для кожної речовини. Можуть знадобитися подвійні або потрійні зв'язки.
- КС 2
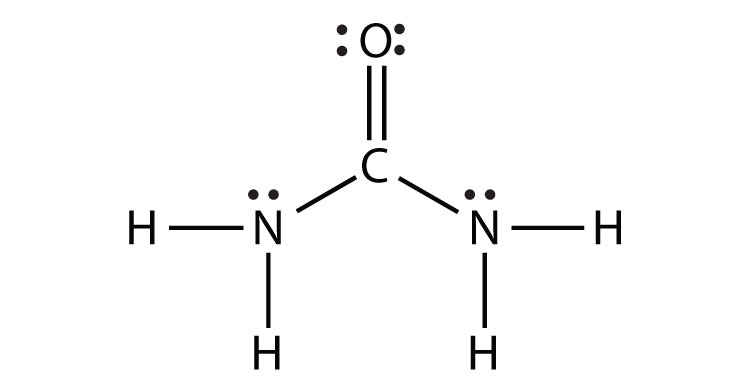
- NH 2 CONH 2 (припустимо, що атоми N і C є центральними атомами)
- Намалюйте електронну точкову діаграму Льюїса для кожної речовини. Можуть знадобитися подвійні або потрійні зв'язки.
- PoCl
- HCOOH (припустимо, що атом С і один атом O є центральними атомами)
Відповіді
- два
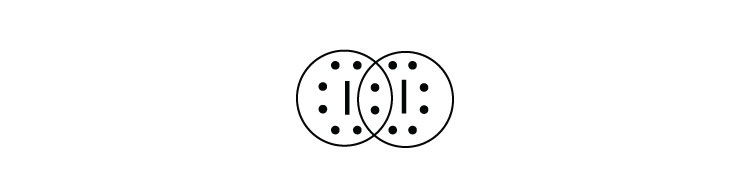
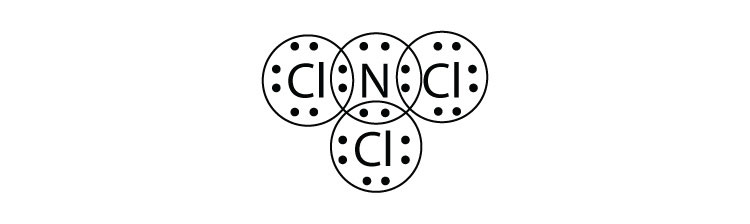
-
-
-
-
9.5: Інші аспекти ковалентних зв'язків
- Наведіть приклад неполярного ковалентного зв'язку. Звідки ви знаєте, що це неполярно?
- Наведіть приклад полярної ковалентної зв'язку. Звідки ви знаєте, що це полярно?
- Як дізнатися, яка сторона полярного зв'язку має частковий негативний заряд? Визначте негативно заряджену сторону кожного полярного зв'язку.
- H — Cl
- Ч—С
- Як дізнатися, яка сторона полярного зв'язку має частковий позитивний заряд? Визначте позитивно заряджену сторону кожного полярного зв'язку.
- H — Cl
- Н-Ф
- Позначте зв'язок між даними атомами як неполярний ковалентний, трохи полярний ковалентний, безумовно полярний ковалентний або, ймовірно, іонний.
- Н і С
- С і Ф
- К і Ф
- Позначте зв'язок між даними атомами як неполярний ковалентний, трохи полярний ковалентний, безумовно полярний ковалентний або, ймовірно, іонний.
- S і Cl
- П і О
- Cs і O
- Який ковалентний зв'язок міцніший - зв'язок C - C або зв'язок C - H?
- Який ковалентний зв'язок міцніший - подвійний зв'язок O—O або подвійний зв'язок N—N?
- Оцініть зміну ентальпії для цієї реакції: N 2 + 3H 2 → 2NH 3 .Почніть з малювання електронних точкових діаграм Льюїса для кожної речовини.
- Оцініть зміну ентальпії для цієї реакції. Почніть з малювання електронних точкових діаграм Льюїса для кожної речовини: HN = NH+ 2H 2 → 2NH 3
- Оцініть зміну ентальпії для цієї реакції. Почніть з малювання електронних точкових діаграм Льюїса для кожної речовини: CH 4 + 2O 2 → CO 2 + 2H 2 O
- Оцініть зміну ентальпії для цієї реакції. Почніть з малювання електронних точкових діаграм Льюїса для кожної речовини: 4NH 3 + 3O 2 → 2N 2 + 6H 2 O
Відповіді
- H—H; це неполярно, оскільки два атоми мають однакову електронегативність (відповіді будуть відрізнятися).
-
- Cl сторона
- S сторона
-
- злегка полярний ковалентний
- виразно полярний ковалентний
- ймовірно іонний
- С—Н облігація
- −80 кДж
- −798 кДж
9.6: Порушення правила октету
- Чому непарно-електронна молекула може не задовольнити правило октета?
- Чому атом у другому рядку таблиці Менделєєва може не утворювати розширені молекули валентної оболонки?
- Намалюйте прийнятну електронну точкову діаграму Льюїса для цих молекул, які порушують правило октету.
- НІ 2
- ДеФ 4
- Намалюйте прийнятну електронну точкову діаграму Льюїса для цих молекул, які порушують правило октету.
- BCL 3
- КЛО 2
- Намалюйте прийнятну електронну точкову діаграму Льюїса для цих молекул, які порушують правило октету.
- ПОФ 3
- КЛ 3
- Намалюйте прийнятну електронну точкову діаграму Льюїса для цих молекул, які порушують правило октету.
- СФ 4
- БеХ 2
Відповіді
- Ні в якому разі не можна спарювати всі електрони, якщо їх непарне число.
-
-
9.7: Молекулярні форми
- Яка основна передумова за VSEPR?
- У чому відмінність геометрії електронної групи від молекулярної геометрії?
- Визначте геометрію електронної групи та молекулярну геометрію кожної молекули.
- Н 2 С
- ОпКЛ 3
- Визначте геометрію електронної групи та молекулярну геометрію кожної молекули.
- КС 2
- Н 2 С
- Визначте геометрію електронної групи та молекулярну геометрію кожної молекули.
- HCN
- ККл 4
- Визначте геометрію електронної групи та молекулярну геометрію кожної молекули.
- БІ 3
- РН 3
- Яка геометрія кожного виду?
- CN −
- ПО 4 3−
- Яка геометрія кожного виду?
- РО 3 −
- НЕМАЄ 3 −
- Яка геометрія кожного виду?
- КОФ 2
- C 2 Cl 2 (обидва атома С є центральними атомами і пов'язані між собою)
- Яка геометрія кожного виду?
- СО 3 2−
- N 2 H 4 (обидва атома N є центральними атомами і пов'язані між собою)
Відповіді
- Електронні пари відштовхують один одного.
-
- геометрія електронної групи: тетраедрична; молекулярна геометрія: гнута
- геометрія електронної групи: тетраедрична; молекулярна геометрія: тетраедрична
-
- геометрія електронної групи: лінійна; молекулярна геометрія: лінійна
- геометрія електронної групи: тетраедрична; молекулярна геометрія: тетраедрична
-
- лінійний
- чотиригранний
-
- тригональний площинний
- лінійні та лінійні щодо кожного центрального атома
9.8 Додаткові вправи
- Поясніть, чому залізо і мідь мають однакову електронну точкову діаграму Льюїса, коли вони мають різну кількість електронів.
-
Назвіть два іони з такою ж електронною точковою діаграмою Льюїса, що і іон Cl −.
-
Виходячи з відомих тенденцій, яке іонне з'єднання з першого стовпця таблиці Менделєєва і найближчого до останнього стовпця періодичної таблиці має володіти найвищою енергією решітки?
-
Виходячи з відомих тенденцій, яке іонне з'єднання з першого стовпця таблиці Менделєєва і найближчого до останнього стовпця періодичної таблиці має володіти найменшою енергією решітки?
-
P 2 не є стабільною формою фосфору, але якби це було, якою була б його ймовірна електронна точкова діаграма Льюїса?
-
Se 2 не є стабільною формою селену, але якби це було, якою була б його ймовірна електронна точкова діаграма Льюїса?
-
Що таке електронні точкові діаграми Льюїса SO 2, SO 3 та SO 4 2−?
-
Що таке електронні точкові діаграми Льюїса PO 3 3 − та PO 4 3−?
-
Який зв'язок ви очікуєте бути більш полярним - облігація O—H або облігація N—H?
-
Які облігації ви очікуєте бути більш полярними - облігація O—F або облігація S—O?
-
Використовуйте енергії зв'язку для оцінки зміни енергії цієї реакції.
С 3 Н 8 + 5О 2 → 3СО 2 + 4Н 2 О -
Використовуйте енергії зв'язку для оцінки зміни енергії цієї реакції.
Н 2 Н 4 + О 2 → Н 2 + 2Н 2 О -
Етилен (C 2 H 4) має два центральних атома. Визначте геометрію навколо кожного центрального атома і форму загальної молекули.
-
Перекис водню (H 2 O 2) має два центральних атома. Визначте геометрію навколо кожного центрального атома і форму загальної молекули.
Відповіді
- Залізо має d електронів, які зазвичай не відображаються на електронно-точкових діаграмах Льюїса.
-
-
ЛіФ
-
-
Це було б як N 2:
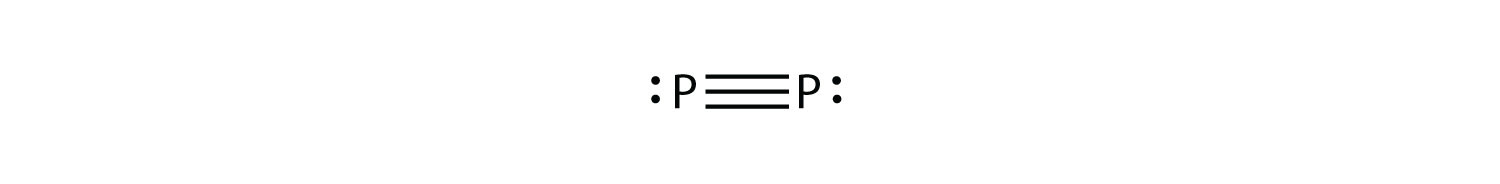
-
-
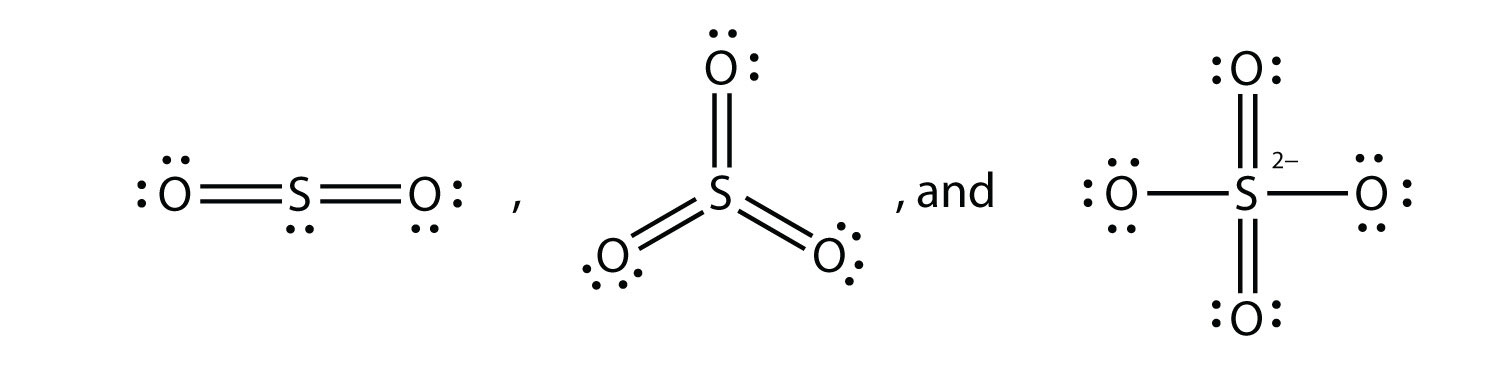
-
-
облігація O—H
-
-
−2,000 кДж
-
-
тригональний планарний близько обох центральних атомів С